中国弯颈霉多糖抗氧化和抑制氧化应激活性研究
白明健,周 颖,程 昊,边 聪,李名正,李 林,张春晶
(齐齐哈尔医学院医学技术学院,黑龙江齐齐哈尔 161006)
冬虫夏草作为一种名贵中药,是特定真菌寄生于蝙蝠蛾幼虫后形成的结合体[1]。冬虫夏草具有抗氧化、增强免疫力、调节代谢等多种生物学功能[2]。天然的冬虫夏草主要生长在高海拔地区且自然资源稀少无法满足人们需求[3]。中国弯颈霉是天然冬虫夏草经过组织分离培养获得的无性型品种,其药理成分和生物活性与冬虫夏草基本相似[4]。
关于中国弯颈霉的国内外研究较少,早期主要集中在培养条件的探索和药理成分的分析[4-5]。近年来有研究报道了中国弯颈霉提取液能够抑制破骨细胞功能、促进成骨细胞的分化及矿化治疗小鼠的骨质疏松。此外有研究表明中国弯颈霉提取物能够增强γ辐射后的小鼠免疫力等[6-7]。本课题组前期研究发现,中国弯颈霉菌丝体能够有效抑制高脂饮食诱导小鼠高脂血症的发生发展,缓解肥胖引起的慢性炎症,降低小鼠的氧化应激水平[8]。中国弯颈霉菌丝体多糖(Tolypocladium sinensepolysaccharide,TSP)是中国弯颈霉菌丝体的活性成分之一,目前关于其抗氧化和抑制氧化应激能力的相关研究尚未有明确报道。
本实验通过测定TSP 对多种自由基的清除作用来分析其体外抗氧化活性。进一步使用过氧化氢诱导小鼠胰岛MIN6 细胞氧化应激,通过测定氧化应激和细胞凋亡相关指标的变化,探索TSP 对过氧化氢损伤MIN6 细胞的保护作用,为TSP 通过抗氧化和抑制氧化应激治疗疾病提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜冬虫夏草 2020 年6 月采集于西藏那曲市;葡萄糖 天津市大茂化学试剂厂;蛋白胨、酵母浸粉 北京奥博星生物技术有限责任公司;硫酸镁天津市巴斯夫化工有限公司;磷酸二氢钾 天津市福晨化学试剂厂;维生素(Vitamin C,VC)陕西颐生堂药业有限公司;硫酸亚铁 天津天大化学试剂厂;水杨酸 恒兴试剂;对1,1-二苯基苦基苯肼(P-1,1-diphenylpicryl phenylhydrazine,DPPH)上海麦克林生化试剂有限公司;小鼠胰岛MIN6 细胞株中国医学科学院基础医学研究所基础医学细胞中心;RPMI-1640 培养基 Hyclone;胎牛血清 Clark;Annexin V-FITC 细胞凋亡检测试剂盒(货号FXP018-100)四正柏生物;邻苯三酚、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(货号BC0175)、丙二醛(malondialdehyde,MDA)试剂盒(货号BC0025)北京索莱宝科技有限公司;MTT 试剂盒(货号C0009S)、乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒(货号C0017)、BCA 蛋白浓度测定试剂盒(货号P0010)、兔抗小鼠核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf-2)抗体碧云天生物技术有限公司;磷酸化c-Jun 氨基末端激酶(phosphorylated c-jun N-terminal kinase,pJNK)抗体 英国Abcam 公司;HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)二抗、HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)二抗 美国Proteintech 公司;小鼠胰岛MIN6 细胞 中国医学科学院基础医学研究所基础医学细胞中心。
Infinite E Plex 多功能全波段连续光谱检测仪瑞士Tecan 公司;Centrifuge 5424 R 低温高速离心机德国Eppendorf 公司;JY300E 电泳仪 北京君意东方电泳设备有限公司;UVP Chemstudio PLUS 自动化分子成像仪 美国Analytik Jena US LLC 公司;IX73P1F 倒置显微镜 日本Olympus 公司。
1.2 实验方法
1.2.1 中国弯颈霉菌丝体的分离和培养 采集新鲜冬虫夏草,组织分离培养得到纯种菌落,经过形态学分析和ITS 序列比对确定为中国弯颈霉[8]。将分离培养获得的菌丝体按1:100 的体积比接种到含有马铃薯200 g/L、葡萄糖20 g/L、蛋白胨5 g/L、酵母浸粉5 g/L、硫酸镁1 g/L、磷酸二氢钾2.5 g/L 的液体培养基中,置于摇床上150 r/min,26 ℃培养96 h[1]。
1.2.2 中国弯颈霉菌丝体多糖的提取、纯化及糖含量测定 中国弯颈霉菌丝体培养96 h 后离心(4000 r/min,15 min)收集菌丝体沉淀,使用热水浸提法提取中国弯颈霉菌丝体粗多糖[9]。随后,使用三氯乙酸法对中国弯颈霉菌丝体粗多糖进行纯化得到TSP[10],并使用苯酚-硫酸法检测TSP 的糖含量[11]。
式中:C1表示多糖溶液带入标准曲线得到的糖浓度;C2表示多糖溶液浓度。
1.2.3 TSP 超氧阴离子自由基、羟自由基和DPPH自由基清除率测定
1.2.3.1 TSP 超氧阴离子自由基清除率测定 称取TSP 粉末0.1 g 溶于10 mL 蒸馏水中,得到10 mg/mL的TSP 母液,精确量取0.4 mg/mL 邻苯三酚溶液0.1 mL 和磷酸盐缓冲液5 mL 于试管中振荡摇匀,分别加入(5、2.5、1.25、0.625、0.3125、0.15625、0.078125 mg/mL)的TSP 溶液1 mL 再加入3.9 mL蒸馏水振荡摇匀,阳性对照使用相同浓度的VC替代TSP 溶液,空白组用蒸馏水代替TSP 溶液。使用酶标仪测量3~30 min 内混合溶液320 nm 处吸光度变化曲线,把各组曲线斜率带入公式计算TSP 超氧阴离子自由基清除率[12]。
式中:K空白表示空白组吸光度曲线斜率;K样本表示样品组吸光度曲线斜率。
1.2.3.2 TSP 羟自由基清除率测定 在试管中依次加入6 mmol/L 硫酸亚铁溶液2 mL、不同浓度的TSP 溶液2 mL 和6 mmol/L 过氧化氢溶液2 mL 振荡摇匀,静置10 min 后加入6 mmol/L 水杨酸溶液2 mL 振荡摇匀,在37 ℃水浴反应30 min,阳性对照组用相同浓度VC替代TSP,空白组用蒸馏水代替TSP 溶液。使用酶标仪测量510 nm 处吸光度,把各组吸光度值带入公式计算TSP 羟自由基清除率[13]。
式中:A空白表示空白组吸光光度值;A样品表示样品组吸光度值。
1.2.3.3 TSP 对DPPH 自由基清除率测定 参考冯书珍等[14]的方法精确称取DPPH 溶于无水乙醇配制成0.04 mg/mL 的DPPH 溶液。分别取不同浓度的TSP 溶液2 mL 加入DPPH 溶液2 mL 涡旋振荡摇匀,室温避光反应30 min 后,离心(4000 r/min,15 min),取上清液测定517 nm 处吸光度。阳性对照组用相同浓度VC替代TSP,对照组用无水乙醇代替DPPH溶液,空白组用蒸馏水代替TSP 溶液,把各组吸光度值带入公式计算TSP 对DPPH 自由基的清除率。
式中:A空白表示空白组吸光度值;A样品表示样品组吸光度值,A对照表示对照组吸光度值
1.2.4 TSP 对过氧化氢损伤MIN6 细胞的保护作用
1.2.4.1 细胞培养 小鼠胰岛MIN6 细胞株具有普通胰岛细胞的生理特性。细胞培养在含有10%胎牛血清、100 U/mL 青霉素和100 U/mL 链霉素的1640培养基中,培养条件为37 ℃,5% CO2。
1.2.4.2 TSP 给药浓度和过氧化氢损伤浓度的选择
称取TSP 粉末0.05 g 溶于10 mL 培养基得到5 mg/mL 的含药培养基,量取3%过氧化氢溶液1 mL溶于439.5 mL 培养基得到含2 mmol/L 过氧化氢培养基母液。收取处于对数生长期的MIN6 细胞,按每孔5×103个接种于96 孔板培养24 h,分别用含TSP 培养基(0~5 mg/mL)和含过氧化氢培养基(0~250 μmol/L)单独处理细胞24 h,最后使用MTT试剂盒检测生存率变化。选取对细胞生存率没有显著影响且对多种自由基具有较强清除作用的浓度作为TSP 给药浓度。
1.2.4.3 实验分组 根据MTT 结果进行实验分组:对照组(Control),正常培养48 h;模型组(Model),正常培养24 h 后更换含200 μmol/L 过氧化氢培养基培养24 h;高剂量给药组(High-TSP),正常培养24 h后更换含200 μmol/L 过氧化氢和0.625 mg/mL TSP培养基培养24 h;低剂量给药组(Low-TSP),正常培养24 h 后更换含200 μmol/L 过氧化氢和0.156 mg/mL TSP 培养基培养24 h。
1.2.4.4 细胞形态学观察 将MIN6 细胞接种于6 孔板后按照1.2.4.3 的分组和处理方式培养48 h,在光学显微镜下拍照观察细胞的形态和贴壁状态,并计数160000 μm2范围内悬浮细胞数量。
1.2.4.5 LDH 释放量检测 将细胞接种于24 孔板按照1.2.4.3 的分组和处理方式培养48 h 收集培养基离心(1000 r/min,5 min)取上清液,用试剂盒进行测定。
1.2.4.6 流式细胞术检测凋亡 将细胞接种于6 孔板按1.2.4.3 分组和处理方式培养48 h 收集细胞,按照试剂盒说明书依次加入Annexin V-FITC 和碘化丙啶(propidium iodide,PI)避光孵育5 min 后利用流式细胞仪检测。
1.2.4.7 氧化应激相关指标测定 将细胞接种于6 孔板按1.2.4.3 分组和处理方式培养48 h 收集细胞,每5×106个细胞加入1 mL 提取液,反复冻融使细胞裂解,离心(12000 r/min,15 min)收集上清,按照试剂盒说明书进行操作。
1.2.4.8 Western Blot 检测蛋白 将按1.2.4.3 分组和处理方式培养48 h 的细胞收集进行蛋白提取,经BCA 试剂盒测定蛋白浓度后,用SDS-PAGE 凝胶将其分离并转至PVDF 膜,5%脱脂奶粉封闭2 h,进行抗体孵育,并使用化学发光分析仪进行曝光。
1.3 数据处理
所有实验重复4 次,数值采用均数 ±标准差(mean±SD)表示,实验数据使用SPSS 26.0 进行统计分析。两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 TSP 多糖含量测定
与大多数菌类相比[9,15-16],中国弯颈霉菌丝体多糖含量较低,使用热水浸提法的提取率为5.27%±0.27%。以葡萄糖浓度为横坐标,490 nm 处吸光度值为纵坐标,绘制葡萄糖标准曲线得到的回归方程为:y=6.376x+0.1605,R2=0.9992,说明在0~0.1 mg/mL区间内,葡萄糖浓度与490 nm 处吸光度值具有良好的线性关系。把菌丝体多糖490 nm处吸光度值带入方程经过计算后得出纯化前和纯化后中国弯颈霉菌丝体的多糖含量分别为28.74%±1.81%和75.27%±2.09%。
2.2 TSP 体外自由基清除作用
研究发现TSP 对多种自由基均具有较好的清除作用且呈剂量依赖趋势,TSP 清除超氧阴离子自由基、羟自由基和DPPH 自由基的IC50分别为1.16、0.55 和0.68 mg/mL(图1A~图1C),其中TSP 对羟自由基和DPPH 自由基清除效果要优于超氧阴离子自由基。此外,TSP 对于多种自由基的清除作用极显著低于VC组(P<0.01)。李泉等[9]提取杏鲍菇多糖并测定其对DPPH 自由基清除作用的IC50为0.70 mg/mL。杨亚萍等[17]发现灵芝多糖清除超氧阴离子自由、羟自由基和DPPH 自由基的IC50分别为1.25、0.88 和1.04 mg/mL。上述菌类多糖对自由基的清除作用基本相似,TSP 相较于普通灵芝多糖展示出了较强的自由基清除活性。
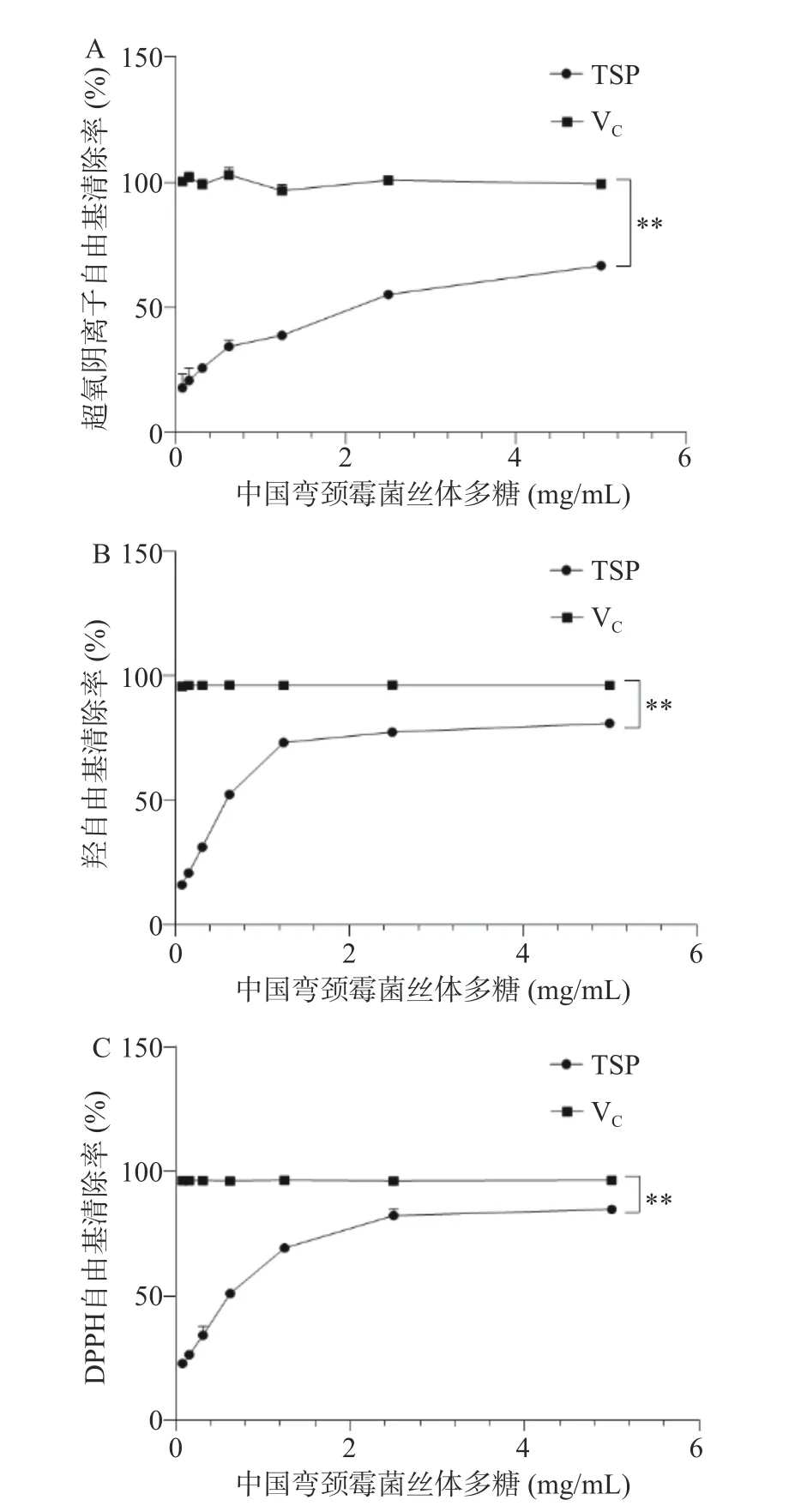
图1 中国弯颈霉菌丝体多糖自由基清除率Fig.1 Scavenging rate of polysaccharides from Tolypocladium sinense against radical
2.3 TSP 对过氧化氢损伤MIN6 细胞的保护作用
2.3.1 MIN6 细胞的生存率 不同浓度TSP(0~5 mg/mL)处理MIN6 细胞24 h 后,与对照组相比1.25~5 mg/mL 的TSP 处理使得细胞生存率极显著降低(P<0.01),提示TSP 浓度在较高范围能够抑制MIN6 细胞增殖。TSP 浓度在0.78~0.625 mg/mL 范围内对MIN6 细胞生存率没有显著影响(P>0.05)(图2A),结合自由基清除实验结果在此浓度范围内选取对自由基具有较强清除作用且差距较大的两个浓度作为高剂量给药组和低剂量给药组。因此分别选择0.625 mg/mL 作为高剂量给药组,0.156 mg/mL作为低剂量给药组。
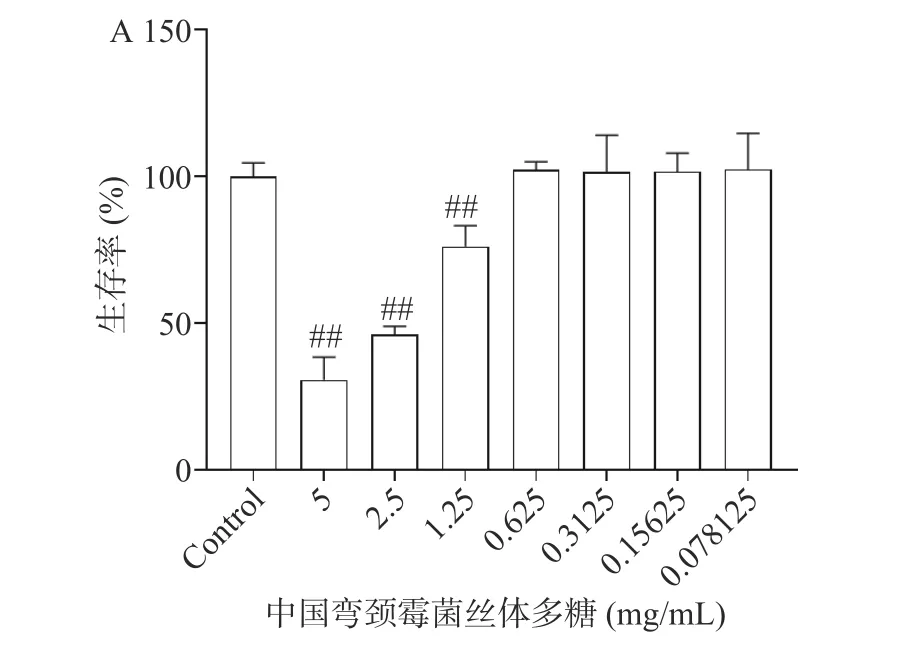
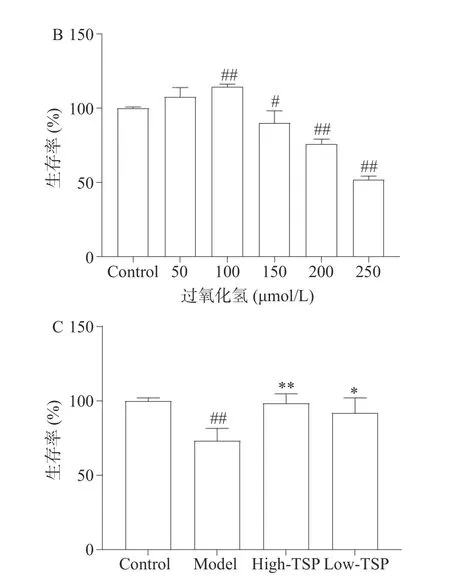
图2 中国弯颈霉菌丝体多糖对过氧化氢损伤MIN6 细胞生存率的影响Fig.2 Effects of polysaccharide from Tolypocladium sinense on the survival rate of H2O2 injured MIN6 cells
不同浓度的过氧化氢(0~250 μmol/L)处理MIN6细胞24 h 后,与对照组相比较低浓度的过氧化氢促进了MIN6 细胞的增殖活性,使得MIN6 细胞的生存率出现极显著增高的现象(P<0.01)。随着过氧化氢的浓度增高,MIN6 细胞的生存率逐渐降低(P<0.05),并呈现出剂量依赖趋势(图2B)。一般选取细胞生存率75%附近的浓度作为损伤浓度最佳,故本实验选择200 μmol/L 过氧化氢处理MIN6 细胞诱导氧化应激模型。
TSP 对过氧化氢诱导的细胞生存率降低具有显著的保护作用(图2C),与对照组相比过氧化氢损伤模型组细胞生存率极显著下降(P<0.01),与模型组相比,高剂量组和低剂量组的细胞生存率显著升高(P<0.01,P<0.05)。MIN6 细胞对于氧化应激高度敏感是糖尿病发生的关键因素之一[18],TSP 给药能够保护氧化应激导致的细胞生存率降低展示出其对于缓解氧化应激相关疾病的潜力。
2.3.2 TSP 改善过氧化氢损伤MIN6 细胞的生长状态和细胞形态 细胞的正常形态是其发挥生理功能的重要保障[19],在倒置显微镜下观察MIN6 细胞的生长状态发现(图3),与对照组相比过氧化氢刺激24 h 后MIN6 细胞悬浮数量极显著增多(P<0.01)贴壁状态较差(圆圈所示)、胞体变圆、丝状伪足明显缩短或消失(箭头所示)表明细胞生长状态较差。相对于过氧化氢模型组,高剂量和低剂量给药组悬浮细胞数量极显著减少(P<0.01),丝状伪足长度恢复。说明过氧化氢刺激导致MIN6 细胞的正常生理结构破坏,TSP 治疗能够逆转这一现象。

图3 中国弯颈霉菌丝体多糖对过氧化氢损伤MIN6 细胞形态的影响Fig.3 Effect of polysaccharide from Tolypocladium sinense on the morphology of MIN6 cells damaged by H2O2
2.3.3 TSP 能够减少过氧化氢损伤MIN6 细胞的乳酸脱氢酶释放 正常情况下乳酸脱氢酶大量存在于细胞内部,当细胞膜结构受损后会释放到培养基中,通过测定培养基中乳酸脱氢酶的水平能够判断细胞膜系统的受损程度[20]。与对照组相比过氧化氢处理后的模型组乳酸脱氢酶释放量极显著上升(P<0.01)提示细胞膜完整性破坏(图4),与模型组相比TSP高低剂量给药组乳酸脱氢酶释放量极显著降低(P<0.01)。研究表明,TSP 给药降低了培养基中乳酸脱氢酶的含量,说明TSP 能够减轻氧化应激对于细胞膜的损伤,增加细胞膜结构的完整性。
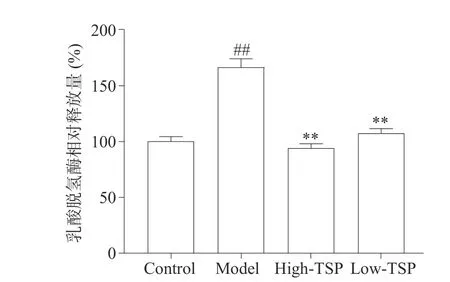
图4 中国弯颈霉菌丝体多糖对过氧化氢损伤MIN6 细胞乳酸脱氢酶释放量的影响Fig.4 Effect of polysaccharide from Tolypocladium sinense on the release of lactate dehydrogenase in MIN6 cells injured by H2O2
2.3.4 TSP 能够降低过氧化氢损伤MIN6 细胞的凋亡水平 细胞凋亡是机体维持自身稳态的重要机制,通常情况下细胞的凋亡水平能够反映出疾病的严重程度[21],如图5 所示,过氧化氢处理组与对照组相比细胞凋亡率极显著上升(P<0.01),与模型组相比高剂量给药组和低剂量给药组细胞凋亡率显著下降(P<0.01,P<0.05),TSP 给药能够显著降低过氧化氢诱导的细胞凋亡水平,同样展示出其具有治疗疾病的潜在药用价值。

图5 中国弯颈霉菌丝体多糖对过氧化氢损伤MIN6 细胞凋亡水平的影响Fig.5 Effect of polysaccharide from Tolypocladium sinense on the apoptosis of MIN6 cells injured by H2O2
2.3.5 TSP 降低过氧化氢损伤MIN6 细胞的氧化应激水平 SOD 是细胞内重要的抗氧化酶之一,主导多种自由基的清除过程,使细胞不受氧化损伤[22],MDA 是细胞膜脂质过氧化产物能够反映细胞的氧化应激水平,其在细胞内过量堆积会诱导细胞能量代谢和信号传导障碍对细胞造成损伤[23]。与对照组相比,模型组细胞内SOD 活力降低(P<0.05),MDA 水平极显著升高(P<0.01),与模型组相比TSP 高剂量给药组和低剂量给药组细胞内SOD 活力显著升高(P<0.01,P<0.05),MDA 水平显著下降(P<0.01)(图6),TSP 给药能够通过降低细胞内MDA 水平,增加SOD活力从而减少氧化应激导致的细胞损伤。
2.3.6 TSP 调节过氧化氢损伤MIN6 细胞中Nrf-2 和pJNK 的表达 Nrf-2 是人体抗氧化防御系统的重要组成部分,能够通过上调SOD、谷胱甘肽过氧化物酶和过氧化氢酶等抗氧化酶的表达发挥保护细胞作用[24]。JNK 是凋亡经典通路p38MAPK/JNK 信号通路中的关键分子,磷酸化是其活化方式,研究证明细胞发生氧化应激后pJNK 的表达增高从而诱导了凋亡的发生[25]。过氧化氢处理模型组细胞Nrf-2表达量极显著降低(P<0.01),pJNK 表达量显著升高(P<0.05),与模型组相比高剂量给药组细胞中Nrf-2 表达量显著增加(P<0.05),高低剂量给药组pJNK表达显著下降(P<0.01,P<0.05)(图7)。结果表明过氧化氢诱导细胞氧化应激从而导致了细胞凋亡的发生,TSP 给药能够通过缓解氧化应激状态减少细胞凋亡的发生。

图7 中国弯颈霉菌丝多糖对过氧化损伤MIN6 细胞Nrf-2 和pJNK 表达的影响Fig.7 Effects of polysaccharide from Tolypocladium sinense on the expression of Nrf-2 and pJNK in MIN6 cells injured by H2O2
3 讨论与结论
氧化应激是指体内的氧化系统与抗氧化系统失衡处于倾向氧化的状态[26],大量的自由基在组织和细胞中堆积,从而损伤细胞导致细胞的凋亡[27]。研究报道了氧化应激在疾病的发生和发展过程中扮演着重要角色[28],其中在2 型糖尿病的胰岛β细胞中这一现象尤为显著[29],因此逆转氧化应激状态治疗疾病成为当下的研究热点[30-31]。例如在治疗糖尿病的过程中,研究者通过降低患者的氧化应激水平缓解胰岛β细胞的损伤[32]。
与大多数研究相似[33-34],本课题组初步探讨了TSP 的体外抗氧化活性,自由基清除实验结果表明:TSP 具有较好的抗氧化活性,对多种自由基均有显著的清除作用,与VC组相比依然有显著的差距。自由基清除实验可以证明中国弯颈霉菌丝体中多糖是一种主要的抗氧化成分,同时也是开展后续细胞内抑制氧化应激实验的基础。
为了探究TSP 抑制氧化应激损伤的分子学机制,使用200 μmol/L 的过氧化氢刺激MIN6 细胞模拟氧化应激状态,并给予不同剂量的TSP 保护,观察细胞各项指标的变化。本课题组首先探讨了TSP 对过氧化氢损伤MIN6 细胞生存率的影响,发现TSP给药能够显著恢复过氧化氢诱导的细胞生存率下降,表明TSP 能够保护MIN6 细胞免受过氧化氢的细胞死亡。细胞生存率对于研究细胞的生长状态具有很大的局限性,在一些情况下细胞可能并未死亡但是已经失去了正常的生理功能。正常的形态结构是细胞发挥生理作用的基础[19],本研究发现过氧化氢诱导的氧化应激模型组细胞悬浮数量增多和丝状伪足明显缩短,在这种状态下细胞的生理功能是被限制的,给予TSP 保护能够显著恢复细胞形态,并可能恢复细胞的正常生理功能。乳酸脱氢酶是评价细胞状态的又一个常用指标,通过测定培养基中乳酸脱氢酶的水平能够判断细胞膜系统的受损程度[20]。本研究表明过氧化氢刺激损伤了细胞膜的完整性,TSP 给药能够显著降低培养基中乳酸脱氢酶水平,增加细胞膜完整性。一些研究报道了2 型糖尿病小鼠胰岛细胞凋亡水平显著升高,给予药物治疗后能够显著减少胰岛细胞凋亡,改善糖尿病症状,其部分作用可能与氧化应激水平降低相关[35]。本研究发现TSP 给药能够显著降低过氧化氢诱导的细胞凋亡升高。总而言之,本研究从多角度证明了TSP 对于过氧化氢损伤MIN6 细胞的保护作用。
在一项代谢性疾病的研究中,通过药物治疗能够显著缓解模型小鼠的氧化应激状态,主要表现为降低MDA 水平,提高SOD 活力[36]。SOD 作为细胞内一种重要的抗氧化酶能够催化超氧阴离子的清除过程,从而维持细胞的氧化与抗氧化平衡状态,MDA是细胞膜脂质过氧化产物,能够反应细胞的氧化应激水平[37]。TSP 能够显著增加氧化应激损伤细胞内的SOD 活力,降低细胞内MDA 含量,这表明细胞氧化应激状态得到缓解,氧化与抗氧化的失衡得到恢复。总之,TSP 能够增加MIN6 细胞的抗氧化能力,减轻自由基对于细胞的损伤,其机制可能与TSP 增加了Nrf-2 的表达量相关[38]。有研究报道,三白草酮能够通过上调HT22 细胞Nrf-2 的表达抑制过氧化氢诱导的氧化应激损伤,进而减少细胞凋亡的发生[39]。Nrf-2 是人体抗氧化防御系统的重要组成部分能够通过调节SOD、谷胱甘肽过氧化物酶和过氧化氢酶水平发挥作用[24],由此推测TSP 的抗氧化应激作用可能是通过上调Nrf-2 的表达水平,启动其下游抗氧化基因的表达,增加包括SOD 在内的抗氧化酶活性来减少氧化应激对细胞造成的损伤。多种疾病的发生与氧化应激状态诱导的细胞凋亡密切相关[40],JNK作为凋亡经典通路p38MAPK/JNK 信号通路中的关键分子与氧化应激导致的凋亡密切相关[41]。本研究发现TSP 给药能够显著降低MIN6 细胞中pJNK 表达水平,结合流式细胞术结果分析发现给药后能够显著减少MIN6 细胞凋亡的发生。猜测TSP 可能通过增加Nrf-2 的表达水平改善细胞内的氧化应激状态,从而降低pJNK 表达和其诱导的细胞凋亡。但也有研究指出JNK 的磷酸化对于Nrf-2 的激活存在一定的促进作用[42]。由于氧化应激状态下,机体多种信号通路的相互作用可能发生改变,因此TSP 在细胞内的抗氧化机制还需要进一步的深入研究。
综上所述,本研究发现TSP 在体外具有较好的自由基清除作用,在细胞水平的实验发现TSP 可以通过增加Nrf-2 的表达来提高细胞的抗氧化能力进而减少过氧化氢诱导的细胞凋亡发生。由于本实验只是进行了细胞水平的探索,后续需要通过构建特殊疾病动物模型研究TSP 对动物疾病状态下氧化应激水平和相关蛋白表达的影响,为中药多糖的应用提供新的理论依据。

