利用mPCR 方法检测巴氏奶中致病菌的鲁棒性研究
刘芝荣,张英华
(1.黑龙江省绿色食品科学研究院,黑龙江哈尔滨 150028;2.东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030;3.东北农业大学食品学院,黑龙江哈尔滨 150030)
由于巴氏奶杀菌条件温和,能够最大限度地保留原料奶中的营养物质和风味,深受消费者欢迎[1-2]。然而,有研究表明近50%的液态奶在巴氏杀菌后会被来自加工环境及设施中的细菌污染[3]。阪崎克罗诺杆菌、大肠杆菌、沙门氏菌是影响乳制品安全常见的致病菌[4-6]。感染阪崎克罗诺杆菌会导致严重坏死性小肠结肠炎、菌血症和脑膜炎,病死率可达40%~80%[7]。大肠杆菌是自然界中分布最广泛的细菌,被认为是乳制品污染的重要指标,10~102CFU/g 的感染剂量即可致病[8]。沙门氏菌在散装牛奶中的分离率高达11%,感染沙门氏菌会导致肠道疾病、妊娠中断、休克及意志薄弱[9-10]。由于原料奶的质量以及巴氏奶在生产过程中存在的污染风险难以完全控制,因此选择一种合适的方法并开发一种快速、准确、实用性高的巴氏奶中致病菌的检测技术,对于保障消费者的安全具有重要意义。
目前,国家对食源性致病菌的检测仍依赖于传统的微生物方法,包括微生物分离、培养和生化鉴定,整个检测过程需要5~7 d,然而巴氏奶保质期一般只有3~7 d,传统的微生物方法在时效上已不能满足快速检测的需求。为此,国内外学者建立了食源性致病菌的多种检测方法[11-13],其中多重聚合酶链式反应(multiple polymerase chain reaction,mPCR)方法成为乳中致病菌检测的重要手段[14-16]。该方法快速、灵敏、特异性强[17],且一次性可以同时检测几种病原体,为检测的定性分析提供依据[18]。Liu 等[19]建立了一种应用于牛奶的mPCR 方法,同时检测大肠杆菌、沙门氏菌、金黄色葡萄球菌的灵敏度为103CFU/mL。Wei 等[20]建立mPCR 方法同时检测牛奶中的大肠杆菌O157:H7、金黄色葡萄球菌和沙门氏菌,检测灵敏度为104CFU/mL。虽然mPCR 技术在检测乳制品中的致病菌方面取得了一定的进展,但仍存在一些局限性。以往的研究中,对于一种致病菌,通常只选择一种该致病菌的特异性基因来设计引物,然而,PCR 扩增的关键在于靶基因的存在。如果靶基因缺失或发生突变,病原体的DNA 将无法被检测到,这可能导致假阴性结果的出现[21]。此外,在对退火温度优化选择时,以往的研究仅根据电泳图谱选择一个最优的退火温度值,但mPCR 对退火温度的精度要求很高,仪器老化或温度精度偏差等原因可能会导致设置的退火稳定和实际的退火温度不一致,进而影响检测方法的准确性和稳定性[22-23]。因此,在实际应用中需要进一步完善mPCR 技术,提高其检测的准确性和可靠性。实际上,鲁棒性是反映系统有能力抵抗或克服不利条件的一种方式,在生物学研究中,鲁棒性意味着当生物系统受到外部环境或内部参数等不确定因素的干扰时,仍然具有保持功能稳定性的能力[24]。因此,在mPCR 方法中,DNA 是否具有靶基因可以被看作是检测系统的外部干扰,退火温度的实际偏差影响是检测系统的内部干扰。
基于上述分析,本文对mPCR 方法进行鲁棒性研究,一方面,针对每种目标菌都选择了两种不同的特异性保守基因,并设计了两套特异引物,以减少外部环境对检测系统的干扰。另一方面,在保证方法灵敏度不变的情况下优化并确定了具有稳定性的退火温度范围,以减少内部参数对检测系统的干扰。本研究方法将进一步提高mPCR 技术的实用性,应用于巴氏奶中阪崎克罗诺杆菌、大肠杆菌和沙门氏菌的快速、准确检测。
1 材料与方法
1.1 材料与仪器
阪崎克罗诺杆菌(ATCC 51024)、大肠杆菌(ATCC 25922、UB 9002、CMCC 44752)、沙门氏菌(ATCC 14028、CMCC 50115)、李氏放线菌(ATCC 19393)、巴氏杆菌(ATCC 25923)、金黄色葡萄球菌(ATCC 25923)、霍乱弧菌(ATCC 17802)、蜡样芽孢杆菌(ATCC 11778)、铜绿假单胞菌(ATCC 27853)、粪肠球菌(ATCC 13433)、单增李斯特菌(ATCC 19111)均由东北农业大学食品学院实验室保存提供;酵母提取物、胰蛋白胨、氯化钠、丙三醇 琼脂奥博星生物技术公司;Gel Red 染料 沃比森科技有限公司;琼脂糖 西班牙Biowest 公司;细菌基因组DNA 提取试剂盒、DNA Marker 2000、2×Taq PCR Mastermix(KT201)天根生化科技有限公司;TE 缓冲液(pH8.0)索莱宝科技有限公司;引物合成 上海生物工程股份有限公司;巴氏奶 购于超市。
VornadoTM 微型漩涡混合器 北京赛百奥科技有限公司;HZQ-F160 振荡培养箱 哈尔滨东联电子技术有限公司;GR60DA 高压灭菌锅 美国致微仪器公司;2-16KL 台式冷冻离心机 德国Sigma 公司;FE28 -Standard pH 计 梅特勒-托利多仪器上海有限公司;JB-CJ-1FQ 超净工作台 苏州佳宝净化工程设备有限公司;HD-9704 核酸蛋白检测仪 上海精科实业有限公司;DYY-11 电泳仪 北京市六一仪器厂;BioSpectrum 310 凝胶成像系统 美国UVP公司;Veriti 96 PCR 仪 美国Applied Biosystems公司。
1.2 实验方法
1.2.1 菌悬液的制备 将菌株接种到固体培养基中,37 ℃的条件下过夜培养活化。活化后的菌株接种于LB 液体培养基中,37 ℃的条件下210 r/min 振荡过夜培养。通过微生物计数(所有菌株109CFU/mL)评估生长,获得菌悬液备用。
1.2.2 DNA 模板制备及浓度测定 三种目标菌株的菌悬液各取1 mL,使用细菌基因组DNA 提取试剂盒提取DNA。HD-9704 核酸蛋白检测仪测定DNA的浓度和纯度。
1.2.3 基因的选择及引物设计 按照基因保守性及特异性原则,选择了阪崎克罗诺杆菌的gyrB基因[25]和grxB基因[26]、大肠杆菌的uidA基因[27]和dnaE基因[28]、沙门氏菌的mgtC基因[29]和orgC的基因[30]。从NCBI 网站中获取基因序列,利用Primer Premier 5.0 及Oligo 6.0 软件设计并评价引物。最终确定的两套mPCR 的6 对引物序列、相应的靶基因及预期扩增产物长度如表1 和表2 所示。
1.2.4 两套mPCR 扩增体系建立及优化
1.2.4.1 引物浓度的优化 配制两个25 μL 的mPCR反应体系,反应体系如下:三种目标菌DNA 模板各1 μL,2×Taq PCR Mastermix 12.5 μL,引物(20 μmol/L)添加量分别设定为0.25、0.5、0.75、1、1.25 μL,使得引物在PCR 反应液中的最终浓度为0.2、0.4、0.6、0.8、1 μmol/L,ddH2O 补至25 μL。PCR 扩增程序设置为:95 ℃预变性1 min,95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸1 min 进行30 个循环,最后72 ℃再延伸7 min。同时利用ddH2O 作为mPCR 反应体系阴性对照模板。PCR 扩增后,经2%浓度的琼脂糖凝胶电泳,凝胶成像分析,电泳条带最亮则为最优引物浓度结果。
1.2.4.2 循环数的优化 配制两个25 μL 的mPCR反应体系,反应体系如下:三种目标菌DNA 模板各1 μL,2×Taq PCR Mastermix 12.5 μL,上下游引物添加量以优化后的结果为准,ddH2O 补至25 μL。PCR 扩增程序设置为:95 ℃预变性1 min,95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸1 min 循环,循环数依次设定为25、30、35、40 进行优化,最后72 ℃再延伸7 min。同时利用ddH2O 作为mPCR 反应体系阴性对照模板。PCR 扩增后,经2%浓度的琼脂糖凝胶电泳,凝胶成像分析,电泳条带最亮则为最优循环数结果。
1.2.4.3 退火温度范围选择 配制两个25 μL 的mPCR 反应体系,反应体系如下:三种目标菌DNA模板各1 μL,2×Taq PCR Mastermix 12.5 μL,上下游引物添加量以优化后的结果为准,ddH2O 补至25 μL。PCR 扩增程序设置为:95 ℃预变性1 min,95 ℃变性15 s,退火温度依次设定为55、55.5、56、56.5、57、57.5、58、58.5、59、59.5、60、60.5、61、61.5、62、62.5、63、63.5 ℃,退火时间为15 s,72 ℃延伸1 min 进行循环,循环数以优化后的结果为准,最后72 ℃再延伸7 min。同时利用ddH2O 作为mPCR 反应体系阴性对照模板。PCR 扩增后,经2%浓度的琼脂糖凝胶电泳,凝胶成像分析,电泳条带最亮且亮度相似则为最优退火温度范围结果。
1.2.5 特异性验证
1.2.5.1 引物间特异性验证 配制两个25 μL 的mPCR 反应体系,模板添加情况如表3 所示,按已建立好的两套mPCR 方法进行扩增。同时利用ddH2O作为mPCR 反应体系阴性对照模板。根据电泳图谱中扩增产物有无交叉错配为依据,进行引物间特异性验证。
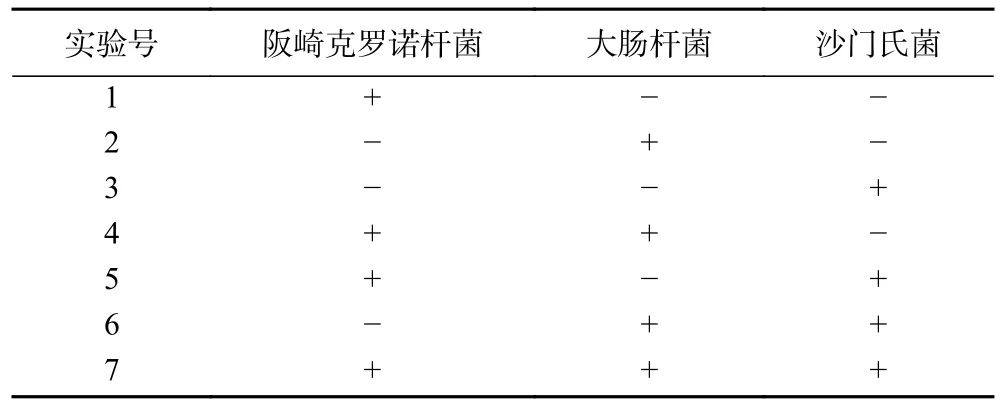
表3 三种目标菌的模板添加情况Table 3 Template addition of the three target bacteria
1.2.5.2 菌间特异性验证 按已建立好的检测方法对三种目标病原菌和八种非目标病原菌扩增进行菌间特异性验证。以李氏放线菌、巴氏杆菌、金黄色葡萄球菌、霍乱弧菌、蜡样芽孢杆菌、铜绿假单胞菌、粪肠球菌、单增李斯特菌作为非目标验证菌株,并使用ddH2O 做阴性对照。
1.2.6 灵敏度测试及温度稳定性验证
1.2.6.1 灵敏度测试 生理盐水梯度稀释得到范围为109至100CFU/mL 的菌悬液,提取DNA。按已建立好的两套mPCR 对三种目标菌进行灵敏度测试,第一套mPCR 扩增程序设置为:95 ℃预变性1 min,95 ℃变性15 s,59.5 ℃退火15 s,72 ℃延伸1 min 进行40 个循环,最后72 ℃再延伸7 min。第二套mPCR 扩增程序设置为:95 ℃预变性1 min,95 ℃变性15 s,59 ℃退火15 s,72 ℃延伸1 min进行40 个循环,最后72 ℃再延伸7 min。同时利用ddH2O 作为mPCR 反应体系阴性对照模板。通过2%的琼脂糖凝胶电泳确定两套mPCR 方法同时检测三种目标菌的灵敏度。
1.2.6.2 人工污染巴氏奶的灵敏度测试 人工污染巴氏奶,使巴氏奶中三种目标菌的浓度分别为106~100CFU/mL,提取DNA。按已建立好的两套mPCR 对巴氏奶中三种目标菌进行灵敏度测试,第一套mPCR 扩增程序设置为:95 ℃预变性1 min,95 ℃变性15 s,59.5 ℃退火15 s,72 ℃延伸1 min 进行40 个循环,最后72 ℃再延伸7 min。第二套mPCR扩增程序设置为:95 ℃预变性1 min,95 ℃变性15 s,59 ℃退火15 s,72 ℃延伸1 min进行40 个循环,最后72 ℃再延伸7 min。同时利用ddH2O 作为多重PCR 反应体系阴性对照模板。通过2%的琼脂糖凝胶电泳确定两套mPCR 方法同时检测巴氏奶中三种目标菌的灵敏度。
1.2.6.3 温度稳定性验证 生理盐水梯度稀释得到浓度为103CFU/mL 至100CFU/mL 的菌悬液和巴氏奶,提取DNA 作为温度稳定性验证模板。按已建立好的两套mPCR 方法对验证模板进行扩增,第一套mPCR 扩增程序设置为:95 ℃预变性1 min,95 ℃变性15 s,验证的退火温度为59、58.5、58 ℃,退火时间为15 s,72 ℃延伸1 min 进行40 个循环,最后72 ℃再延伸7 min。第二套mPCR 扩增程序设置为:95 ℃预变性1 min,95 ℃变性15 s,验证的退火温度为58.5、58、57.5 ℃,退火时间为15 s,72 ℃延伸1 min 进行40 个循环,最后72 ℃再延伸7 min。同时利用ddH2O 作为mPCR 反应体系阴性对照模板。通过2%的琼脂糖凝胶电泳确定在灵敏度一致的前提下,具有稳定性的退火温度范围。
1.2.7 检测50 份人工污染的巴氏奶的方法评价 三种不同浓度的目标菌组合后人工污染到50 份巴氏奶中,其中三种目标菌组合污染32 份,两种目标菌组合污染12 份,单种目标菌污染6 份。其中阪崎克罗诺杆菌污染总份数为42 份,大肠杆菌污染总份数为42 份,沙门氏菌污染总份数为42 份。采用本研究方法和国标方法GB 4789.40-2016、GB 4789.38-2012、GB 4789.4-2016 进行同步检测,并对检测结果及检测时效进行评价。
1.3 数据处理
PCR 扩增产物凝胶电泳图谱均由美国UVP 公司的BioSpectrum 310 凝胶成像系统产生,后由Visio 2003 进行处理。
2 结果与分析
2.1 两套mPCR 扩增程序的优化
2.1.1 引物浓度优化 引物的浓度是影响mPCR 中条带扩增的关键,引物浓度偏低会降低目标DNA 的扩增程度,引物浓度偏高会出现其他非特异性条带[31]。本研究在对引物浓度优化时,将每一套mPCR 反应体系中的三对引物设置为同一浓度,避免因某引物的浓度明显高于其他引物的浓度所产生的引物间竞争性抑制[32]。且在同一PCR 反应体系中使用多对引物会增加形成引物二聚体的概率,因此在本实验中我们根据六对引物设计了两套mPCR 反应体系,以减少引物之间的相互干扰,从而提高mPCR 反应的准确性和可靠性。第一套mPCR 扩增程序的引物浓度优化结果如图1a 所示,泳道1 中扩增出的条带亮度最大,因此gyrB、uidA和mgtC的最佳引物浓度组合为0.2 μmol/L。第二套mPCR 扩增程序的引物浓度优化结果如图1b 所示,泳道1 中扩增出的条带亮度最大,因此grxB、dnaE和orgC的最佳引物组合为0.2 μmol/L。

图1 引物浓度的优化结果Fig.1 Result of primer concentrations seleted
2.1.2 循环数的优化 循环数过低会导致目标PCR 产物低,循环数过高则会导致非特异性条带的出现,通常来讲循环数一般在25~40 之间。第一套mPCR 扩增程序的循环数优化结果如图2a 所示,泳道4 中扩增出的条带亮度最大,且均未出现其他非特异性条带,因此第一套mPCR 扩增程序中循环数设置为40 是最佳选择。第二套mPCR 扩增程序的循环数优化结果如图2b 所示,泳道4 中扩增出的条带亮度最大,且均未出现其他非特异性条带,因此第二套mPCR 扩增程序中循环数设置为40 是最佳选择。
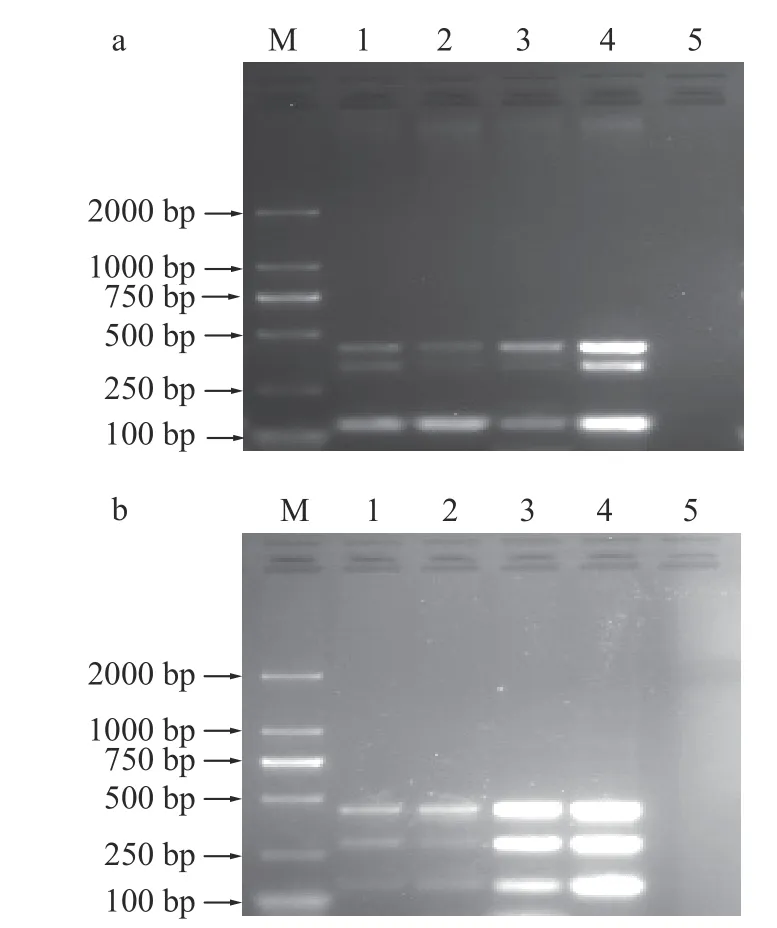
图2 循环数优化结果Fig.2 Result of cycles seleted
2.1.3 退火温度范围的优化选择 退火温度是PCR程序的关键,影响着方法的特异性和敏感性[33]。第一套mPCR 退火温度范围的优化结果如图3a 所示,泳道7、泳道8、泳道9、泳道10 亮度程度相似且最亮,因此,第一套mPCR 退火温度选择58~59.5 ℃。第二套mPCR 退火温度范围的优化结果如图3b 所示,泳道6、泳道8、泳道9、泳道10 亮度程度相似且最亮,因此,第二套mPCR 退火温度选择57.5~59 ℃。
2.2 特异性验证
2.2.1 引物间特异性验证 对已建立好的两套mPCR 扩增程序进行引物间特异性验证,第一套mPCR 引物间特异性验证结果如图4a 所示,泳道1 中扩增出了含有三种目标菌的条带,泳道2~4 中扩增出了两种目标菌任意组合相应的条带,泳道5~7 中分别扩增出单种目标菌相应的条带,泳道8 阴性对照无扩增条带。第二套mPCR 引物间特异性验证结果如图4b 所示,泳道1~3 中分别扩增出单种目标菌相应的条带,泳道4~6 中扩增出了两种目标菌任意组合相应的条带,泳道7 中扩增出了含有三种目标菌的条带,泳道8 阴性对照无扩增条带。本研究所设计的引物在PCR 反应扩增中无交叉错配现象,且无其他非特异性条带出现,验证结果表明所设计的引物具有较高的特异性。
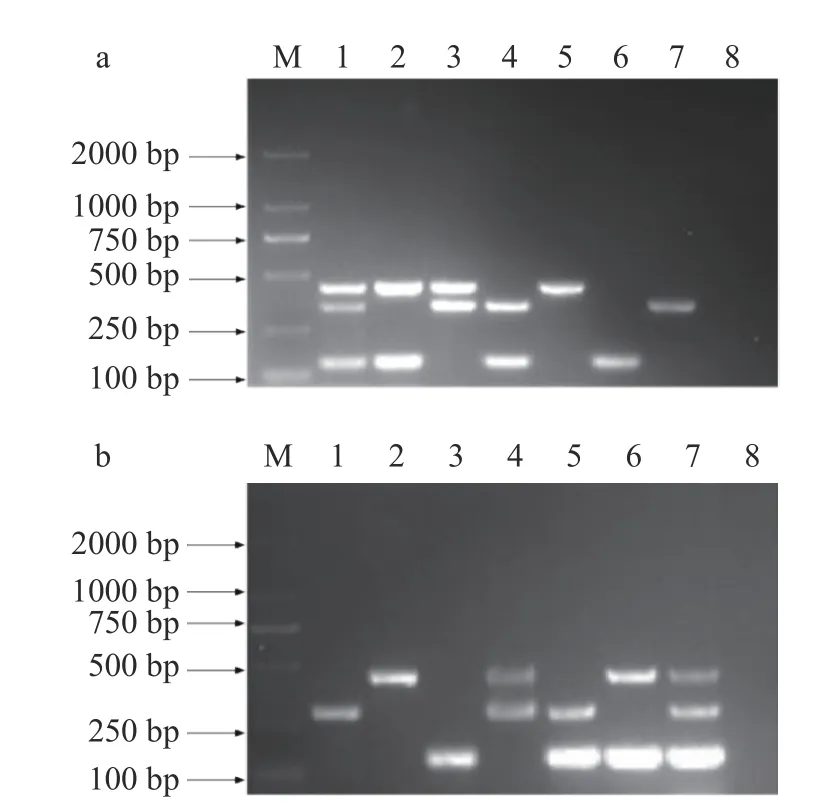
图4 引物间的特异性验证结果Fig.4 Result of specificity validation between primers
2.2.2 菌间特异性验证 对已建立的两套mPCR 扩增程序进行菌间特异性验证。第一套mPCR 扩增程序菌间特异性验证结果如图5a 所示,泳道1 中同时扩增出三种目标菌的特异性片段,阪崎克罗诺杆菌429 bp、大肠杆菌129 bp、沙门氏菌339 bp,且无非目标菌扩增条带,泳道2~4 中无非目标菌扩增条带出现,泳道5 阴性对照无扩增条带。第二套mPCR扩增程序菌间特异性验证结果如图5b 所示,泳道1 中同时扩增出三种目标菌的特异性片段,阪崎克罗诺杆菌288 bp、大肠杆菌441 bp、沙门氏菌144 bp,且无非目标菌扩增条带,泳道2~4 中无非目标菌扩增条带出现,泳道5 阴性对照无扩增条带。可见,已建立的两套mPCR 扩增程序具有良好的特异性。
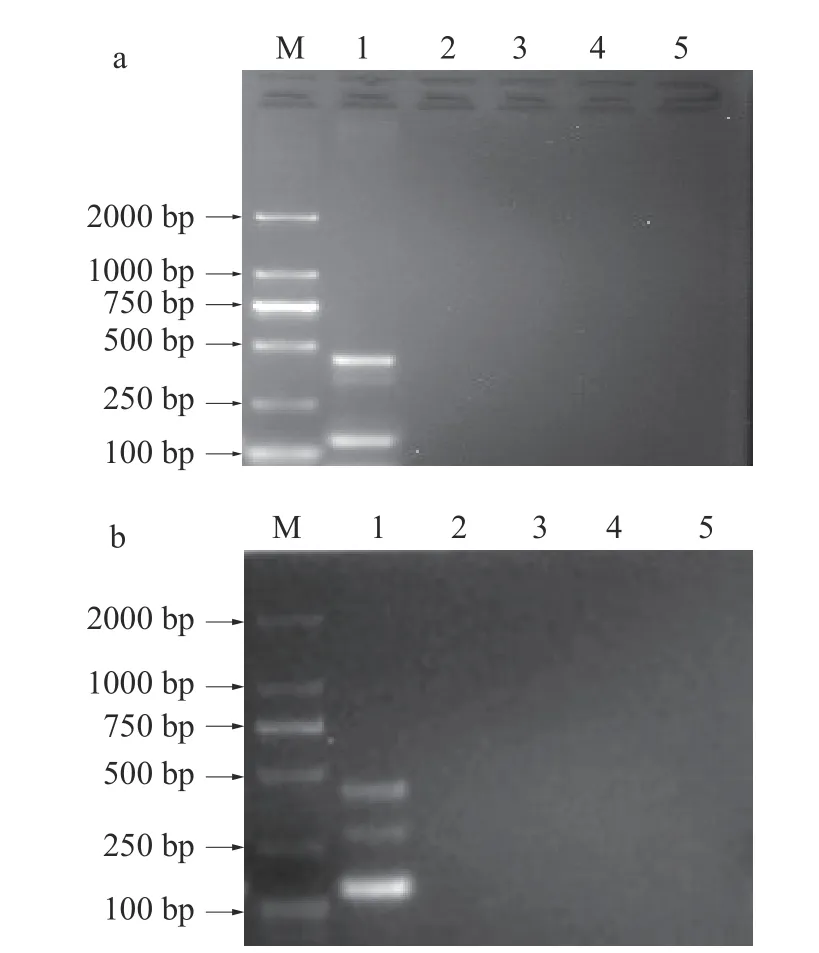
图5 菌间特异性验证结果Fig.5 Result of inter-bacterial specificity verification
2.3 mPCR 的灵敏度和温度稳定性验证
测定已建立好的两套mPCR 扩增程序同时检测三种目标菌的灵敏度及确定不改变方法灵敏度的情况下具有稳定性的退火温度范围。如图6a 所示,退火温度为59.5 ℃时第一套mPCR 同时检测三种目标菌的灵敏度均为10 CFU/mL;如图6b 所示,58~59 ℃的退火温度范围内均可以保证同时检测三种目标菌的灵敏度为10 CFU/mL,因此第一套mPCR方法可在退火温度58~59.5 ℃(温差为1.5 ℃)的范围内有效扩增。如图6c 所示,退火温度为59 ℃时第二套mPCR 同时检测三种目标菌的灵敏度均为10 CFU/mL;如图6d 所示,57.5~58.5 ℃的退火温度范围内均可以保证同时检测三种目标菌的灵敏度为10 CFU/mL,因此第二套mPCR 方法可在退火温度57.5~59 ℃(温差为1.5 ℃)的范围内有效扩增。
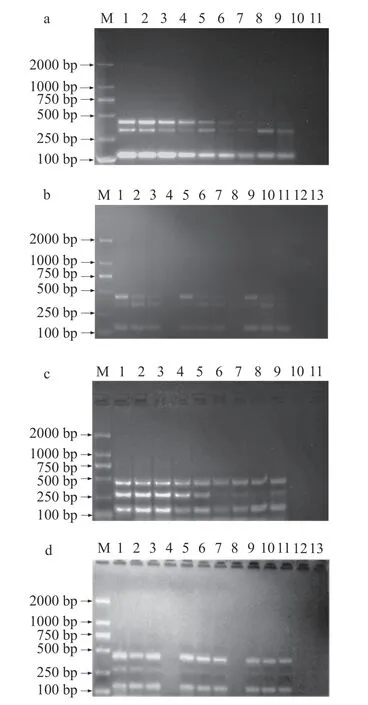
图6 灵敏度和温度稳定性测定结果Fig.6 Result of sensitivity and temperature stability detected
2.4 人工污染的巴氏奶测定
测定已建立好的两套mPCR 方法同时检测巴氏奶中三种目标菌灵敏度及确定不改变方法灵敏度的情况下具有稳定性的退火温度范围。如图7a 所示,退火温度为59.5 ℃时第一套mPCR 同时检测巴氏奶中三种目标菌的灵敏度均为10 CFU/mL;如图7b所示,59 ℃的退火温度可以保证同时检测巴氏奶三种目标菌的灵敏度为10 CFU/mL,而在58.5 ℃、58 ℃的退火温度下不能保证方法灵敏度均为10 CFU/mL,因此第一套mPCR 方法检测巴氏奶样品时可在退火温度59~59.5 ℃(温差为0.5 ℃)的范围内有效扩增。通过比较,巴氏奶中得到的温差范围结果比菌悬液中小1 ℃。根据图7c 所示,当退火温度为59 ℃时,第二套mPCR 同时检测巴氏奶中三种目标菌的灵敏度均为10 CFU/mL,但在扩增结果中出现了非特异性条带。与此不同的是,在图6c 中退火温度为59 ℃时菌悬液扩增并没有出现这样的结果。因此,第二套mPCR 方法检测巴氏奶中目标菌时退火温度不宜设置为59 ℃。在图7d 中,57.5~58.5 ℃的退火温度范围内均可以保证同时检测巴氏奶中三种目标菌的灵敏度为10 CFU/mL,且未出现非特异性条带。因此第二套mPCR 方法的退火温度选择57.5~58.5 ℃(温差为1 ℃),以获得更可靠的结果。通过比较巴氏奶和菌悬液的实验结果发现,尽管在mPCR 方法建立时第一套mPCR 方法在退火温度58~59.5 ℃范围内以及第二套mPCR 方法在退火温度57.5~59 ℃范围内表现出同样的扩增潜力,但将该方法实际应用到巴氏奶中退火温度范围结果却有所减小。说明巴氏奶中存在多种干扰成分如较高的脂肪和蛋白质会导致PCR 反应体系的复杂性增加,对扩增结果会产生不利影响,从而影响了退火温度的稳定性[22]。以上结果进一步验证了本研究对mPCR方法退火温度范围优化的必要性,以保证方法的稳定性和灵敏度。近年来,许多学者利用mPCR 方法检测不同食品中的致病菌。Abdeen 等[15]利用mPCR检测技术对人工染菌牛奶样品中6 种致病菌进行检测,在退火温度为55 ℃的条件下检测灵敏度为103CFU/mL;姜华等[34]建立一种能够同时检测婴幼儿配方奶粉中阪崎克罗诺杆菌、沙门氏菌和金黄色葡萄球菌的mPCR 检测方法,在退火温度为55 ℃的条件下检测灵敏度为103CFU/mL;杨国兴等[35]建立一种mPCR 快速检测肉制品中金黄色葡萄球菌、沙门氏菌、志贺氏菌和单增李斯特菌的分析方法,在退火温度为56.6 ℃的条件下检测灵敏度为103CFU/mL。本研究建立的鲁棒性检测方法的灵敏度与其相比提高了两个数量级,且本研究方法建立优化了两套mPCR 反应体系,对检测的结果提供了双重保护。
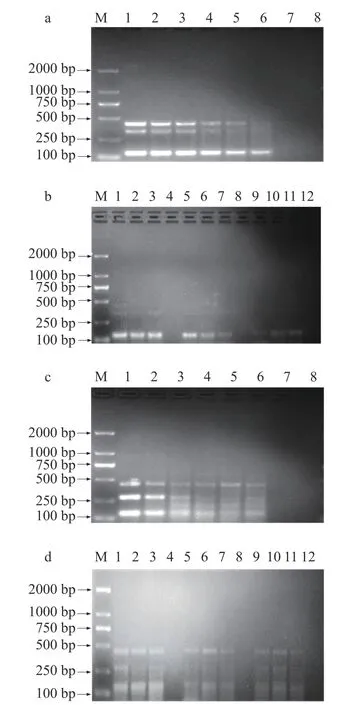
图7 人工污染巴氏奶的灵敏度和温度稳定性测定结果Fig.7 Result of sensitivity and temperature stability detected in pasteurized milk
2.5 鲁棒性mPCR 方法和国标方法检测结果的评价和比较
鲁棒性mPCR 方法和国标方法GB 4789.40-2016、GB 4789.38-2012、GB 4789.4-2016 同时检测50 份人工污染的巴氏奶样品的结果如表4 所示。两种方法检测出阪崎克罗诺杆菌显现阳性的样品数量均为42 件,检出率均为84%;检测出大肠杆菌显现阳性的样品数量均为42 件,检出率均为84%;检测出沙门氏菌显现阳性的样品数量均为42 件,检出率均为84%。本研究建立的方法与国标方法相比较,敏感性、特异性和符合率相同,分别为100%、100%、100%。在检测时效上,本研究方法整个过程需要4 h,包括PCR 反应液配置、扩增、电泳,国标检测方法需要62~148 h,包括细菌培养和后续的生化检测。因此,本研究建立的鲁棒性mPCR 方法在检测时效上和国标法相比具有明显优势。

表4 50 份人工污染的巴氏奶样品检测结果Table 4 Test results of 50 artificially contaminated pasteurized milk samples
3 结论
本研究建立了一种鲁棒性mPCR 方法,可用于检测巴氏奶中的阪崎克罗诺杆菌、大肠杆菌、沙门氏菌。该方法不仅提高了常规mPCR 方法的实用性,还解决了巴氏奶货架期短与致病菌传统检测方法耗时长相矛盾的问题。经过优化和鲁棒性研究,该方法检测结果得到双重保护,且确定了具有稳定性的退火温度范围,保证了方法的稳定性和实用性。与国标方法GB 4789.40-2016、GB 4789.38-2012、GB 4789.4-2016 相比,鲁棒性mPCR 方法具有明显的时效优势,为乳品行业和监管机构提供了更加及时的检测手段。因此,本研究在理论和实用方面都具有重要价值。然而,对于实际检测过程中存在巴氏奶中致病菌污染小于10 CFU/mL 的情况,本研究建立的鲁棒性mPCR 方法可以结合预增菌步骤获得活菌足量且杂质较少的培养物进行检测。此外,由于不同乳制品中成分的差异性会影响方法的检测效果,因此对于其他类型的乳制品如酸奶、奶粉等中的致病菌污染问题,本研究提出的方法未来仍需进一步的验证及改进。

