超声波辅助黄鳍金枪鱼免疫活性肽酶解工艺优化
徐远芳,王馨怡,刘 悦,杜童申,杨 华,张慧恩,王 燕,沈存宽,
(1.浙江万里学院生物与环境学院,浙江宁波 315100;2.宁波海关技术中心,浙江宁波 315048)
黄鳍金枪鱼是一种大型鱼类,具有高度洄游特性,为无国界鱼类[1]。我国是金枪鱼制品的生产大国,据《2022 中国渔业统计年鉴》统计,我国海洋捕捞产量逐年提高,达到了3387.2 万吨[2]。在金枪鱼加工过程中,产生大量的副产物同样拥有丰富的营养物质,例如氨基酸、牛磺酸、维生素与矿物质等,是开发各种功能性食品的优质原料。因此研究如何利用金枪鱼的加工副产物,对实现水产资源的高值化应用具有重要意义。
免疫活性肽是一类具有调节机体免疫力的小分子多肽,具有生物活性高、稳定性强、免疫原性弱等特点[3-4]。另一方面,酶解法的条件温和、转移性强,是当前从鱼类蛋白中制备免疫活性肽的主要方法[5-6]。有研究证明免疫活性肽具有刺激小鼠巨噬细胞增殖并增强吞噬作用等功能[4,7-8],例如LIU 等[7]从玉米蛋白中提取出5 种多肽,并利用人巨噬细胞中白细胞介素6 作为标记,鉴定出FLPFNQL 的活性最高。李桂芬等[9]通过酶解法制备金枪鱼蛋白抗痛风活性肽,结果显示该抗痛风肽有着良好的XOD抑制率。超声波是一种具有能量和波动的双重机械波[10],将超声波与酶解反应结合,可以提高酶解反应的速度从而缩短酶解时间[11],但目前将超声波工艺与金枪鱼免疫活性肽的制备相结合的研究未见报道,所以本研究以黄鳍金枪鱼肉作为研究对象,首先通过比较酶解产物对小鼠巨噬细胞相对增殖率的影响,从胰蛋白酶、木瓜蛋白酶、酸性蛋白酶、碱性蛋白酶中筛选出最适蛋白酶,然后在单因素实验基础上结合超声波辅助,采用响应面试验优化水解工艺,确定制备金枪鱼肉免疫活性肽的最优酶解条件,旨在为黄鳍金枪鱼资源的进一步高值化开发利用提供思路。
1 材料与方法
1.1 材料与仪器
黄鳍金枪鱼 宁波今日食品提供;Counting Kit-8(CCK-8)试剂盒 上海宏叶生物科技有限公司;中性蛋白酶(5000 U/g)、酸性蛋白酶(5000 U/g)、碱性蛋白酶(200000 U/g)、胰蛋白酶(250000 U/g)、木瓜蛋白酶(100000 U/g)、无菌磷酸盐缓冲液(PBS)、低糖DMEM 培养基 美国Gibco 公司;氢氧化钠(NaOH)、盐酸(HCl)国药集团化学试剂有限公司;杆菌肽、牛血清白蛋白、溶菌酶 上海博升生物科技有限公司;重组人工胰岛素 上海麦克林生化科技股份公司;小鼠单核巨噬细胞(RAW264.7)中科院上海细胞所。
DKS-24 磁力搅拌水浴锅 常州市伟嘉仪器制造有限公司;CF16RXⅡ超低温高速离心机 日本HITACHI 公司;超声波清洗机 广州市科洁盟实验仪器有限公司;Forma 3111CO2细胞培养箱 美国Thermo 公司;CX31 倒置显微镜 日本OLYMPUS公司;PHS-29A 数显酸度计 上海虹益仪器有限公司;ZHJH-C1109C 超净工作台 上海智诚分析仪器制造公司;Spectra Max 酶标仪 美国Bio-Rad 公司;LCJ-25C 真空冷冻干燥机 北京四环科学仪器厂有限公司产品;HITACHI L-8900 氨基酸自动分析仪 日本Hitachi 公司;UPLC-ELSD 高效液相色谱仪 美国Waters 公司。
1.2 实验方法
1.2.1 样品预处理 取黄鳍金枪鱼碎肉中白肉部分,在无水的条件下用碎肉机搅碎后形成肉糜,去除筋膜部分,将其纯肉糜用塑封袋分装置于-60 ℃冰箱冷冻备用。
1.2.2 金枪鱼肉一般营养成分的测定 水分:参考GB 5009.3-2016 中的直接干燥法[12];脂肪含量:参考GB 5009.6-2016 中的索氏提取法[13];灰分:参考GB 5009.4-2016 中的高温灰化法[14];蛋白质含量:参考GB 5009.5-2016 中的凯氏定氮法[15]。
1.2.3 金枪鱼肉酶解最适蛋白酶的筛选 参考胡旭阳[16]报道的方法并稍作修改,首先利用0.1 mol/L的NaOH 与HCl 按照表1 中pH 配制成相应的缓冲溶液,按照料液比1:5 加入上述得到的金枪鱼肉糜,搅匀至金枪鱼肉糜匀浆液后,再分别加入酶添加量为6000 U/g 的胰蛋白酶、木瓜蛋白酶、酸性蛋白酶、碱性蛋白酶、中性蛋白酶按照最适酶解温度进行酶解。酶解反应参数如表1 所示,在磁力搅拌水浴锅中酶解6 h 后,沸水浴15 min 灭酶,冷却至室温后离心收集上清液。真空冷冻干燥得酶解物冻干粉,置于-60 ℃冰箱中保存。采用CCK-8 法测定五种酶解产物对小鼠单核巨噬细胞相对增殖率,筛选出最适蛋白酶。

表1 不同蛋白酶酶解条件Table 1 Respond surface experimental design and results
1.2.4 酶解制备单因素实验
1.2.4.1 最适酶解时间筛选 实验设置4、5、6、7、8 h的5 个酶解时间。按照1.2.3 的实验步骤,以改变酶解时间为条件进行最适酶解时间筛选。
1.2.4.2 最适酶解温度筛选 实验设置17、27、37、47、57 ℃的5 个酶解温度。按照1.2.3 的实验步骤,以改变酶解温度为条件进行最适酶解温度筛选。
1.2.4.3 最适超声时间筛选 参考周燕芳等[10]的方法设置1、10、20、30、40 min 的5 个超声时间,按照1.2.3 的实验步骤,将胰蛋白酶配制的金枪鱼肉匀液置于120 W 超声波处理不同时间后,再酶解6 h进行最适超声波辅助酶解的时间筛选。
1.2.5 响应面试验 在单因素实验结果的基础上,以酶解时间、酶解温度、超声时间为优化因素,以小鼠巨噬细胞相对增殖率为响应值,设计三因素三水平Box-Behnken 响应面优化试验,优化胰蛋白酶制备金枪鱼肉免疫活性肽的最佳酶解工艺,实验因素水平如表2 所示。
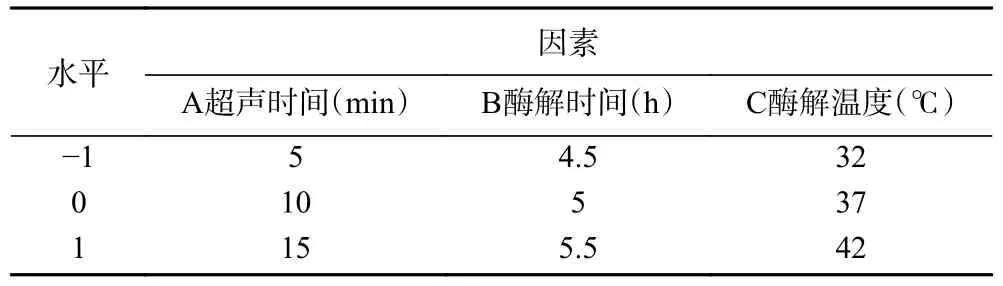
表2 响应面试验因素与水平设计Table 2 Factor and levels in response surface experiment
1.2.6 小鼠巨噬细胞的相对增殖率的测定 CCK-8 法是测定细胞增殖或毒性实验中活细胞数目的一种高灵敏度、无放射性的比色检测法[17],其原理为能将活细胞中的脱氢酶还原为黄色甲瓚产物,甲瓚产物数量与活细胞成正比。收集对数生长周期的RAW264.7 细胞,调节细胞密度为1×105个/mL,取100 μL 接种于96 孔板中,每组设置5 个复孔。为防止边缘效应,在96 孔板最外圈每孔加入100 μL 的无菌(PBS)进行封边处理[18],于37 ℃、5% CO2孵箱中进行培养,24 h 后每孔均去上清液,空白对照组加入100 μL 的完全培养基(含有10 %胎牛血清的低糖DMEM 培养基),实验组加入100 μL 浓度为200 μg/mL 的样品溶液,继续培养24 h 后再加入10 μL CCK-8,再置于37 ℃、5% CO2细胞培养箱培养4 h 后,于酶标仪测定其在492 nm 处的吸光值,并根据公式(1)计算出小鼠巨噬细胞的相对增殖率。
式中:X 为细胞相对增殖率(%);A1为实验组在492 nm 的吸光值;A0为空白组在492 nm 处的吸光值。
1.2.7 氨基酸含量测定 样品中的氨基酸组成含量根据GB 5009.124-2016《食品安全国家标准 食品中氨基酸的测定》[19]的方法进行测定。
目前,在锅炉房和焦炉等项目中,一般都设计有砖烟囱。此类烟囱的高度往往不是很高,烟囱直径不是太大,总造价不是很高。如果施工方法过于复杂,会导致施工成本加大,增加企业的投入。本文以山西省孝义市某烟囱的施工为例,介绍一种简便、经济的施工方法。
1.2.8 分子量分布分析
1.2.8.1 测定条件 色谱柱为BioCore-SEC-15 凝胶柱(7.8×300 mm,0.5 μm)。流动相为150 mmol/mL磷酸盐缓冲溶液;检测波长为220 nm;进样量为20 μL;柱温为25 ℃,流速:0.6 mL/min。
1.2.8.2 分子量校正曲线 标准品为杆菌肽(M:1422)、牛血清白蛋白(M:66.200)、重组人胰岛素(M:5808)、溶菌酶(M:14400)溶解于流动相配制成0.5 mg/mL 过滤后进样,得到标准品色谱图。以标准品的lg Mw(y)与洗脱时间(x)所做出的标准曲线为(y=-2.134x2+47.754x-31.260,R2=0.903346)。
1.2.8.3 样品分子量的确定 将样品溶解于流动相中,配制浓度为0.5 mg/mL 后过滤进样,将色谱图中每个峰的保留时间代入标准曲线中计算出样品分子量大小与不同分子量所占的比例。
1.3 数据处理
所有实验至少平行3 次,采用IBM SPSS Statistics 25 对数据进行显著性分析,P<0.05 表示存在显著性差异,Design-Expert 10.0 软件进行响应面设计,Graphpad Prism 8 进行数据处理及绘图。
2 结果与分析
2.1 黄鳍金枪鱼鱼肉的营养成分
黄鳍金枪鱼鱼肉的一般营养成分结果为水分含量:72.3%±1.8%,灰分含量1.26%±0.05%,蛋白质含量:26.95%±0.9%,脂肪含量:0.049%±0.001%。该结果与洪鹏志等[20]对黄鳍金枪的营养成分的测定结果相似。黄鳍金枪鱼鱼肉蛋白质含量高,具有作为原料进行后续酶解制备免疫活性肽的价值。
2.2 最适蛋白酶筛选
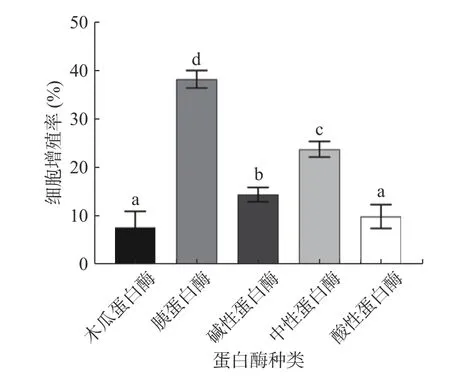
图1 不同蛋白酶对金枪鱼酶解产物对小鼠巨噬细胞相对增殖率的影响Fig.1 Effects of different proteases on the relative proliferation rate of mouse macrophages induced by tuna hydrolysate
2.3 单因素实验结果
2.3.1 酶解时间对小鼠巨噬细胞相对增殖率的影响
图2 表示酶解时间对酶解产物对小鼠巨噬细胞相对增殖率影响的结果。酶解时间从4 h 到5 h 时,酶解多肽的免疫活性逐渐升高,当酶解时间为5 h 时,小鼠巨噬细胞的相对增殖率达到了最高为47.14%;当酶解时间在5 h 后,小鼠巨噬细胞的相对增殖率逐渐下降。可能的原因是由于伴随酶解时间的延长,一些具有免疫活性的多肽链会被再次酶解,导致其丧失活性结构[22-23]。故选择酶解时间为4.5、5、5.5 h 进行后续响应面优化试验。
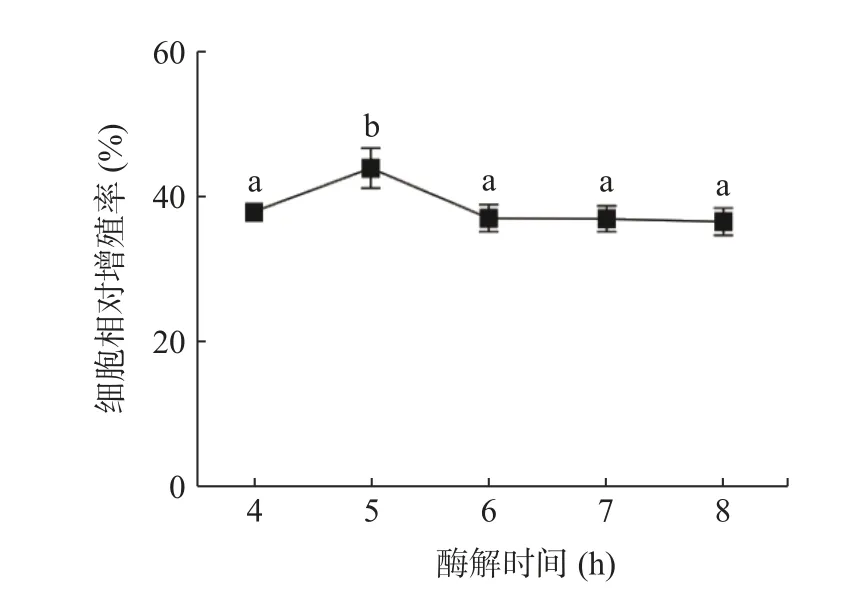
图2 酶解时间对金枪鱼鱼肉酶解产物对小鼠巨噬细胞相对增殖率的影响Fig.2 Effects of enzymolysis time on the relative proliferation rate of mouse macrophages induced by enzymolysis products of tuna fish
2.3.2 酶解温度对小鼠巨噬细胞相对增殖率的影响
图3 表示酶解温度对酶解产物对小鼠巨噬细胞相对增殖率的影响。酶解产物的免疫活性随温度升高呈现先上升后下降的趋势,当酶解温度在17~27 ℃时,细胞增殖率随着温度的上升而上升;当酶解温度为37 ℃时,其促进小鼠巨噬细胞增殖率达到了最高,为37.10%,原因是胰蛋白酶的最适合温度为37 ℃,蛋白鱼肉非共价键与二硫键逐渐断裂,使更多的酶切位点逐渐暴露[24],从而产生更多的免疫活性肽;当酶解温度继续升高时,过高的温度会导致蛋白质容易变性,使其酶活力下降从而不利于鱼肉糜的水解[22]。因此,选择酶解温度为32、37、42 ℃进行后续响应面优化试验。

图3 酶解温度对金枪鱼鱼肉酶解产物对小鼠巨噬细胞相对增殖率的影响Fig.3 Effects of enzymolysis temperature on the relative proliferation rate of mouse macrophages induced by enzymolysis products of tuna fish
2.3.3 超声时间对小鼠巨噬细胞相对增殖率的影响
如图4 表示不同超声时间下的酶解产物对小鼠巨噬细胞相对增殖率的影响。酶解产物的免疫活性在超声时间为10 min 时达到了最大值,为44.56%;在10 min 后迅速下降,之后趋于平缓,这与ŞENER 等[25]结果相似。超声时间会影响到超声空化效应的产生和持续,超声时间过长会抑制蛋白酶的活性[11]。故选择超声时间5、10、15 min 为后续实验条件。
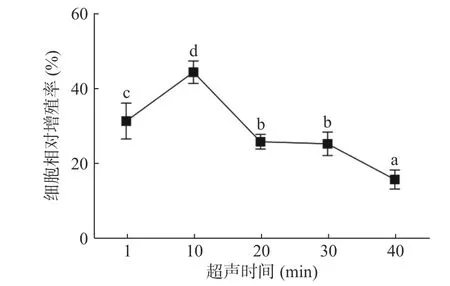
图4 超声时间对金枪鱼肉酶解产物对小鼠巨噬细胞相对增殖率的影响Fig.4 Effect of ultrasonic time on the relative proliferation rate of mouse macrophages induced by enzymolysis of tuna meat
2.4 响应面优化试验结果
2.4.1 响应面优化试验结果 利用Design-Expert 10.0 软件对表3 数据进行响应面试验,以小鼠巨噬细胞相对增殖率为响应值进行分析,得到结果如表3 所示,各因素经过多元二次回归拟合后,得到回归方程为:Y=41.20+4.45A+2.00B+1.28C+2.75AB-0.8875AC+2.57BC-11.94A2-5.87B2-6.21C2。
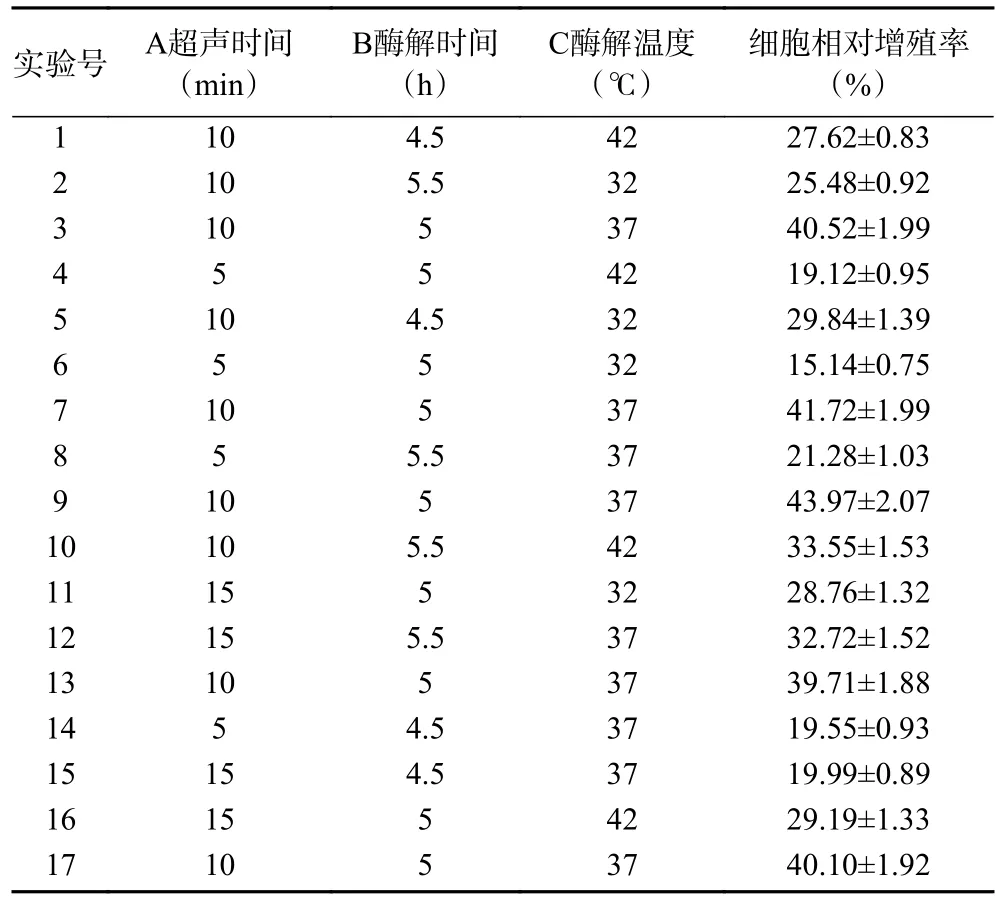
表3 响应面试验设计及结果Table 3 Respond surface experimental design and results
对模型进行显著性分析结果见表4,结果所示,模型P<0.01,表明该模型极显著。同时,该模型失拟项P=0.1514,表明失拟不显著,在试验中没有失拟因素;其决定系数R2=0.9594、R2Adj=0.9124,说明该模型可以充分拟合超声时间、酶解时间、酶解温度与小鼠巨噬细胞之间的相互关系,因此可以用该回归方程确定金枪鱼最佳酶解条件。
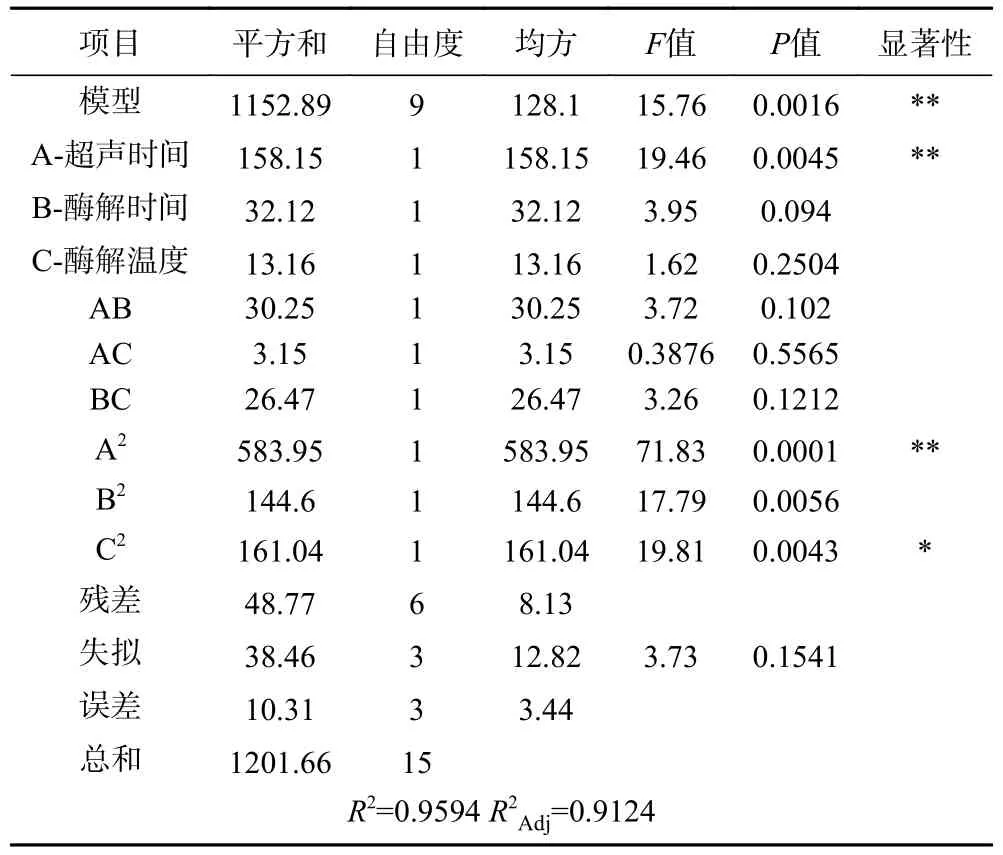
表4 回归模型方差分析Table 4 ANOVA of regression equation
2.4.2 响应面图交互作用分析 回归模型的响应面图如图5 所示,该曲线图较为直观的反映了回归模型中各参数之间交互作用对小鼠巨噬细胞相对增殖率的影响[26-28]。由图5A 曲线图的曲面坡度陡峭与等高线封闭情况可以看出,当酶解温度固定不变时,超声时间与酶解时间相互作用明显。当超声时间改变时,酶解时间对细胞相对增殖率的影响表现出不同程度的变化;当酶解时间改变时,超声时间对细胞相对增殖率的影响也表现出不同程度的变化。图5B所示,当酶解时间固定不变时,超声时间与酶解温度相互作用明显,其中超声时间对细胞增殖率的影响高于酶解温度。由图5C 可以看出,当超声时间固定不变时,酶解温度与酶解时间两参数之间的交互作用不显著。
由回归模型分析得到的最佳酶解条件为超声时间11.051 min、酶解时间5.125 h、酶解温度37.697 ℃。在此条件下,金枪鱼肉多肽对小鼠巨噬细胞的相对增殖率的预测值为42.011%。并考虑到实际操作情况,对该工艺进行修正,最终确定工艺参数为:超声时间11 min、酶解时间为5 h、酶解温度为37 ℃,对此进行细胞实验最终测的细胞相对增殖率为43.039%±2.03%,与回归模型的预测值无显著差异(P>0.05)。证明通过响应面优化条件对提取金枪鱼肉免疫活性肽较为可靠。
2.5 氨基酸组成分析
酶解多肽的氨基酸组成如表5 所示。在检测的16 种氨基酸中,谷氨酸含量最高,占总氨基酸含量的17.91%±0.53%,组氨酸次之,占总氨基酸含量的13.29%±0.39%。此外酶解多肽中必需氨基酸占总氨基酸含量41.42%±1.24%,疏水氨基酸含量占总氨基酸的26.49%±0.79%。氨基酸与人体免疫系统的组织、器官等发育的基本物质,参与免疫与炎症反应。有研究指出不同的氨基酸具有不同调节能力,例如天冬氨酸与谷氨酸可为免疫细胞供能[29],组氨酸经过催化后生成的产物具有抗炎抗氧化作用[30]。贺屹潮[31]利用酸性蛋白酶制备大鲵肉酶解肽的进行氨基酸含量分析,结果显示其必须氨基酸含量为32.5%,由此可见金枪鱼免疫活性肽的氨基酸含量更丰富。

表5 金枪鱼免疫活性肽的氨基酸组成Table 5 Amino acid composition of immunoactive peptide in tuna
2.6 分子量分布分析
酶解产物分子量分布如图6 所示,金枪鱼免疫活性肽经过色谱柱的分离,得到了若干个色谱峰。第一个色谱峰在11~13 min 之间,结合标准品分子量的标准曲线分析其分子量>10 kDa,占比11.558%。所有色谱峰在22 min 之前均被完全洗脱。而其他色谱峰集中在13~15 min 被洗脱出来,分子量集中分布于4.7~6.5 kDa 中,占比85.063%,主要集中于5.359 kDa。剩余分子量均低于1 kDa,占比3.38%。有研究推测小分子肽段的免疫活性较好[32-34],例如侯银臣等[33]通过超滤技术对羊胎盘的发酵产物分离并进行免疫活性实验,结果表明不同分子量组分的免疫活性不同,3~10 kDa 组分的免疫活性最高;<3 kDa组分的抗氧化性最高。通过对金枪鱼免疫活性肽进行酶解工艺优化后测定其分子量可以看出,其免疫活性肽冻干粉主要是由小分子量肽段组成,并且主要集中分布于4.7~6.5 kDa,可以证明经过响应面工艺优化后的金枪鱼免疫活性肽具有较强的免疫活性。

图6 金枪鱼免疫活性肽分子量分布Fig.6 Molecular weight distribution of tuna immunoactive peptide
3 结论
综上所述,本研究确定制备黄鳍金枪鱼肉免疫活性肽最适蛋白酶为胰蛋白酶,在单因素实验基础上进行响应面优化试验,得到最佳的酶解条件为超声时间5 h、酶解温度37.6 ℃、酶解时间11 min,在该条件下测得的小鼠巨噬细胞的相对增殖率为43.039%±2.03%。对得到金枪鱼免疫活性肽进行氨基酸组成与分子量分析,结果显示必需氨基酸含量达41.42%±1.24%,疏水氨基酸含量达26.49%±0.79%;分子量集中分布在4.7~6.5 kDa,但在酶解过程中会产生大量分子量接近的肽段,后续需进一步分离纯化。
本文探讨了采用酶解法制备黄鳍金枪鱼免疫活性肽的加工工艺,虽然目前证明酶解法是较为安全可靠的,但是在酶解制备的免疫活性肽粗肽,含有其他复杂成分,后续需进一步分离纯化。并且本研究在结合超声波辅助时,仅研究了鱼肉与蛋白酶结合后超声再酶解对于免疫活性的影响,并未研究对鱼肉进行超声后再进行酶解后对于免疫活性的影响,本研究为黄鳍金枪鱼副产物的高值化奠定了基础,期待为后续对此进行更加深入研究提供理论与技术支持。

