钠-葡萄糖协同转运蛋白-2抑制剂对急性心肌梗死预后影响的Meta分析
摘要:目的 探究钠-葡萄糖协同转运蛋白-2(sodium-glucose co-transporter-2,SGTL-2)抑制剂对急性心肌梗死预后有利影响的可能性。方法 通过计算机检索PubMed、Cochrane Library、Embase、中国知网、万方数据库、维普期刊数据库,筛选出符合纳入标准的随机对照研究,检索时间为建库至2024年8月。结局指标包括心力衰竭住院、全因死亡、心血管死亡、MACE事件、SGLT-2抑制剂相关不良反应。结果 共6篇随机对照研究纳入Meta分析,研究对象共11 012例。结果显示,急性心肌梗死后在标准治疗基础上加用SGLT-2抑制剂可减少心力衰竭住院风险(RR=0.76, 95%CI= 0.62~0.93, P=0.01),然而在全因死亡风险(RR=1.00, 95%CI=0.83~1.21, P=0.97)、心血管死亡风险(RR=1.01, 95%CI=0.82~1.25, P=0.92)、MACE事件风险(RR=1.03, 95%CI=0.87~1.21, P=0.76)、SGLT-2抑制剂相关不良反应方面(RR=1.03, 95%CI=0.96~1.10, P=0.38)与安慰剂相比,差异无统计学意义。结论 急性心肌梗死后在标准治疗基础上加用SGLT-2抑制剂是安全的,可降低心力衰竭住院风险,但在全因死亡、心血管死亡以及MACE事件风险方面未显著增加或降低。
关键词:钠-葡萄糖协同转运蛋白-2抑制剂;急性心肌梗死;随机对照研究;Meta分析
DOI:10.3969/j.issn.1674490X.2024.06.003
中图分类号:R54"""""文献标志码:A"""""文章编号:1674490X(2024)06001610
Effects of sodium-glucose co-transporter-2 inhibitors on prognosis after acute myocardial infarction: a Meta-analysis
SONG Zhen,CHEN Ruixiao,WU Tingting,JIAO Shengjun,LU Lu,YAO Tianyu,TIAN Ye
(The Third Department of Cardiology, Cangzhou Hospital of Integrated Traditional Chinese and Western Medicine, Cangzhou 061000, China)
Abstract: Objective "To investigate the possibility of beneficial effects of sodium-glucose co-transporter-2 (SGTL-2) inhibitors on prognosis after acute myocardial infarction (AMI). Methods Randomized controlled trails meeting the inclusion criteria were selected through computer searches of PubMed, Cochrane Library, Embase, CNKI, Wanfang Database and VIP Journal database from the establishment of the database to August 2024. Outcome indicators included: hospitalization for heart failure; all-cause death; cardiovascular death; MACE events; SGLT-2 inhibitor related adverse effects. Results A total of 6 randomized controlled trails were included in the meta-analysis, with a total of 11 012 patients. The results showed that SGLT-2 inhibitors in addition to standard treatment after AMI reduced the risk of hospitalization for heart failure(RR=0.76, 95%CI=0.62~0.93, P=0.01). However, there was no significant difference in the risk of all-cause death (RR=1.00, 95%CI=0.83~1.21, P=0.97), cardiovascular death (RR=1.01, 95%CI=0.82~1.25, P=0.92),MACE events (RR=1.03, 95%CI=0.87~1.21, P=0.76), and SGLT-2 inhibitor related adverse effects (RR=1.03, 95%CI=0.96~1.10, P=0.38), compared with placebo. Conclusion The addition of SGLT-2 inhibitors to standard treatment after AMI is safe and can reduce the risk of hospitalization for heart failure after AMI, but the risks of all-cause death, cardiovascular death and MACE events are not significantly increased or decreased.
Key words: sodium-glucose co-transporter-2 inhibitor; acute myocardial infarction; randomized controlled trail; Meta-analysis
急性心肌梗死(acute myocardial infarction,AMI)患者随着指南指导的早期介入干预及规范化的药物治疗,降低了复发性缺血事件,延长了患者的生存期,但是心血管风险仍然很高[1-2]。一项研究[3]显示,在年龄≥65岁的心肌梗死患者中,出院时循证药物使用率高:阿司匹林95%,β受体阻滞剂94%,他汀类药物81%。尽管如此,病死率仍然很高:1年为24%,5年为51%,8年为65%。然而,随时间推移治疗方法和治疗结局的变化趋于稳定,新的治疗选择有限[4]。十几年前的一项研究[5]表明,依普利酮可改善AMI后左心室射血分数及减少心力衰竭住院风险。然而直到2021年报道的一项研究[6]表明,在AMI患者中,与雷米普利相比,沙库巴曲缬沙坦与心血管原因死亡或新发心力衰竭发生率降低无关。
钠-葡萄糖协同转运蛋白-2 (sodium-glucose co-transporter-2, SGLT-2)抑制剂已被证明对心血管死亡、心力衰竭住院以及身体质量减轻产生有利影响[7-8]。在有症状的慢性心力衰竭患者中无论是否合并糖尿病,甚至对于射血分数保留的心力衰竭,SGLT-2抑制剂依然表现出色[9-10]。目前尚不清楚SGLT-2抑制剂同样为AMI预后带来类似的获益,这也是临床上非常关心的问题。Butler等[11]研究表明,在AMI后心力衰竭风险增加的患者中,用恩格列净治疗并没有降低首次因心力衰竭住院或因任何原因死亡的风险。本文将通过SGLT-2抑制剂对AMI预后的有效性及安全性进行Meta分析。
1"资料与方法
1.1"研究类型
通过计算机检索PubMed、Cochrane Library、Embase、中国知网、万方数据库、维普期刊数据库,筛选出符合纳入标准的随机对照研究,检索时间范围为建库至2024年8月。英文检索词:Sodium Glucose Co-transporter 2 inhibitor、SGLT2i、Ertugliflozin、Bexagliflozin、Empagliflozin、Dapagliflozin、Sotagliflozin、Canagliflozin、myocardial infarction、STEMI、NSTEMI、acute coronary syndrome、ST-segment elevation myocardial infarction、Non-ST segment myocardial infarction、randomized controlled trial。中文检索词:SGLT-2抑制剂、达格列净、恩格列净、卡格列净、钠-葡萄糖协同转运蛋白-2抑制剂、急性ST段抬高心肌梗死、急性非ST段抬高心肌梗死、急性心肌梗死、急性冠脉综合征、随机对照研究。由2名研究者应用Endnote 21软件进行文献管理及筛选,遇到分歧讨论解决或第3名研究者参与解决。
1.2"纳入和排除标准
纳入标准:(1)≥18岁的AMI研究对象,AMI诊断标准符合《2018年ESC第四版心肌梗死通用定义》[12];(2)干预措施,实验组服用SGLT-2抑制剂,且为AMI后首次服用,对照组服用安慰剂;(3)随机对照研究。排除标准:(1)干预措施为非SGLT-2抑制剂与安慰剂对比;(2)观察结局指标不符;(3)研究类型不符;(4)综述、系统评价、动物实验、病例报告、数据描述不详;(5)相关研究重复发表。
1.3"结局指标
(1)心力衰竭住院;(2)全因死亡;(3)心血管死亡;(4)主要心血管不良事件(major adverse cardiovascular event,MACE);(5)SGLT-2抑制剂相关不良反应。
1.4"数据提取与风险偏倚评估
由2名研究者应用Excel表格按事先制定的方案进行数据提取,包括作者、发表时间、干预措施、年龄、性别、样本例数、随访时间、结局指标。相关疾病史及服药史包括高血压、糖尿病、抗血小板药物、他汀、ACEI/ARB/ANRI、β受体阻滞剂、盐皮质激素受体拮抗剂、利尿剂。针对纳入的随机对照研究是否存在风险偏倚,采用Cochrane风险偏倚评估工具[13]评估。
1.5"统计分析
应用RevMan 5.4、Stata 18统计软件进行分析。若连续变量符合正态分布,则采用均数±标准差(x±s)表示,否则采用四分位数M(P25,P75)表示;分类变量则采用百分比(%)表示;因所观察结局指标均符合二分类变量,故采用风险比RR及其95%可信区间(CI)表示;采用I2和Q检验评价研究间异质性,当I2<50%且Q检验P>0.10应用固定效应模型,否则应用随机效应模型,同时采用敏感性分析法进一步探究异质性来源;评价发表偏倚采用漏斗图对称性评估,如对称性欠佳则用减补法及Egger检验进一步评价,如纳入文献数量小于10篇,则用漏斗图表示。
2"结果
2.1"文献检索结果
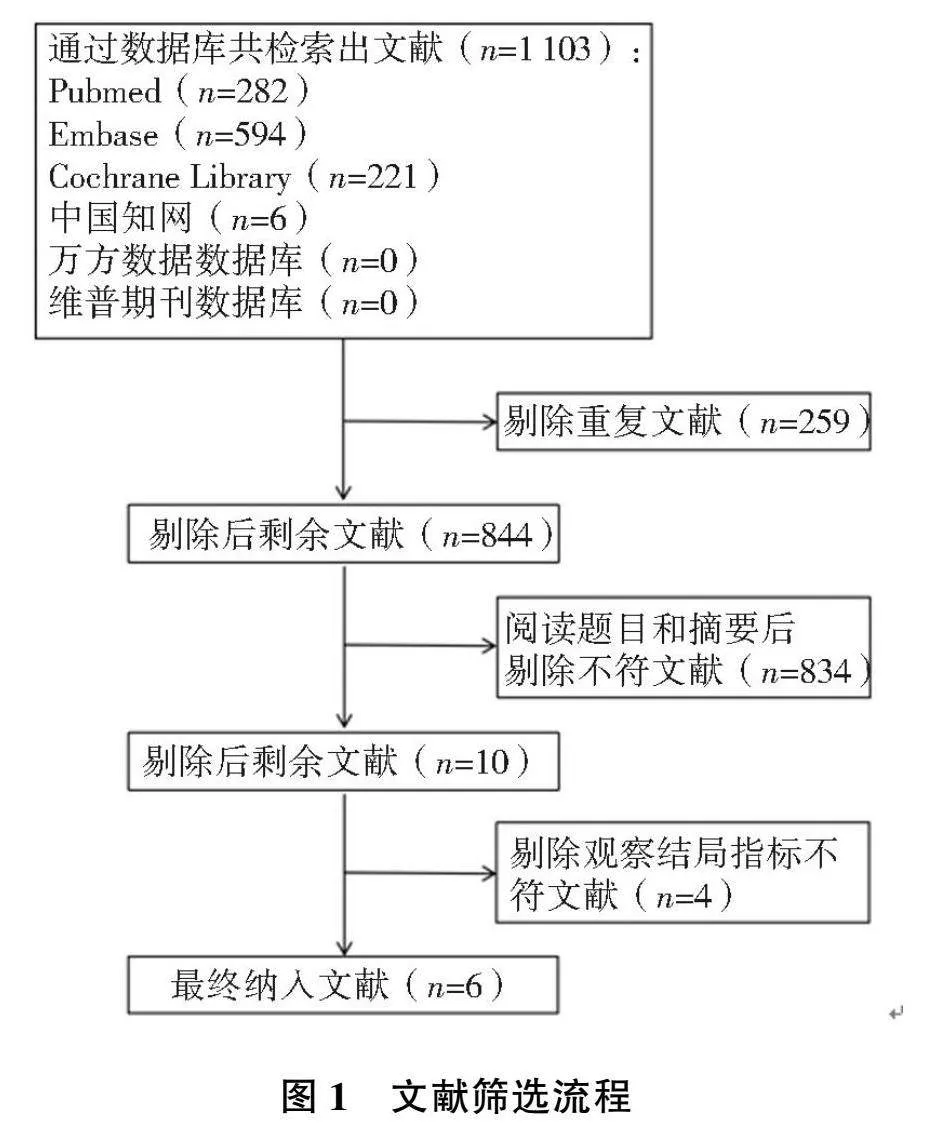
通过计算机检索:Pubmed(n=282)、Embase(n=594)、Cochrane Library(n=221)、中国知网(n=6)、万方数据数据库(n=0)、维普期刊数据库(n=0),共计得到文献1 103篇;应用EndNote 21软件剔除重复文献259篇,剩余844篇;通过阅读题目和摘要后剔除与本研究不符文献834篇,剩余10篇;通过仔细阅读全文剔除结局指标与本研究不符文献4篇;最终纳入研究6篇,文献筛选流程见图1。
2.2"纳入文献特征及风险偏倚评估
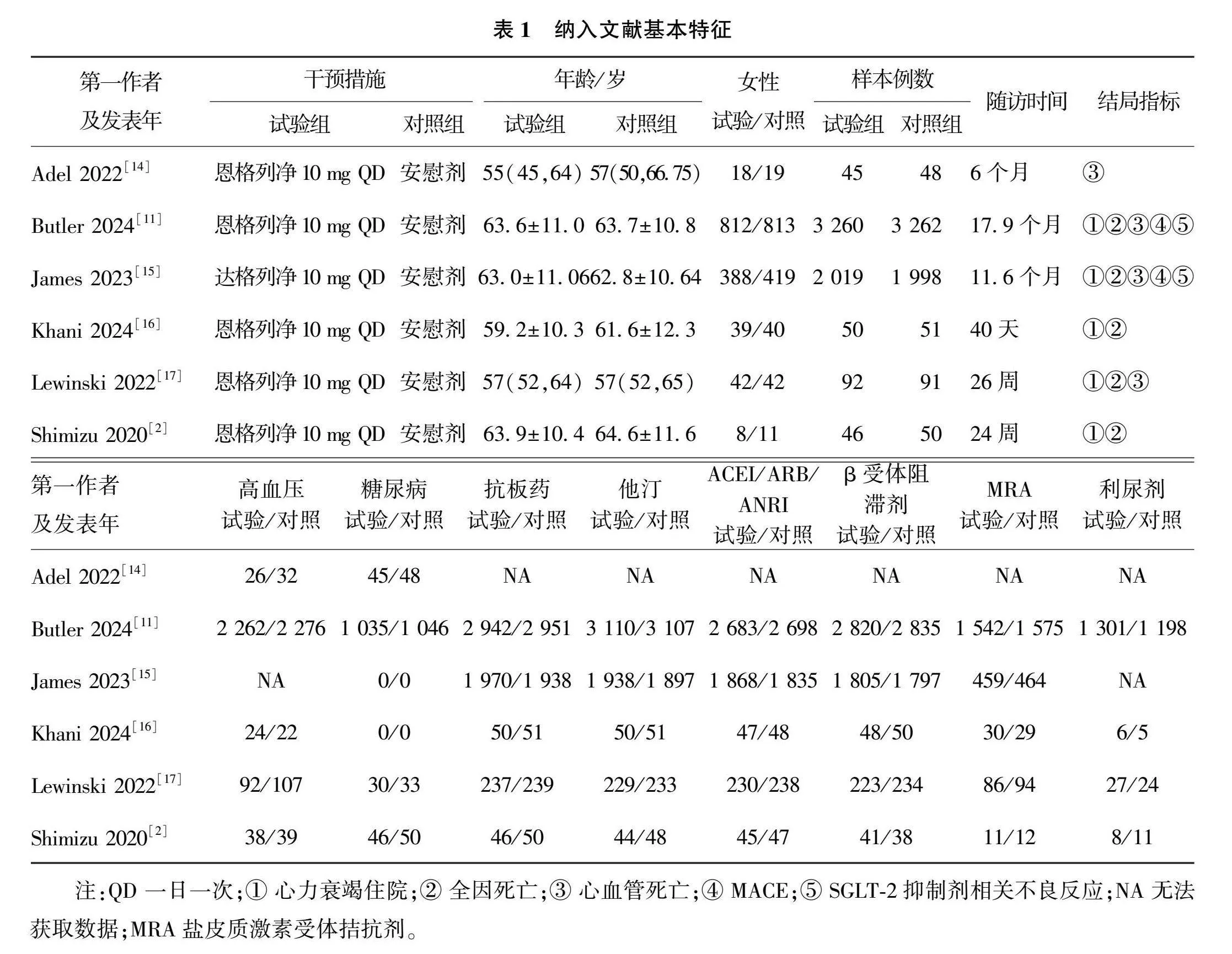
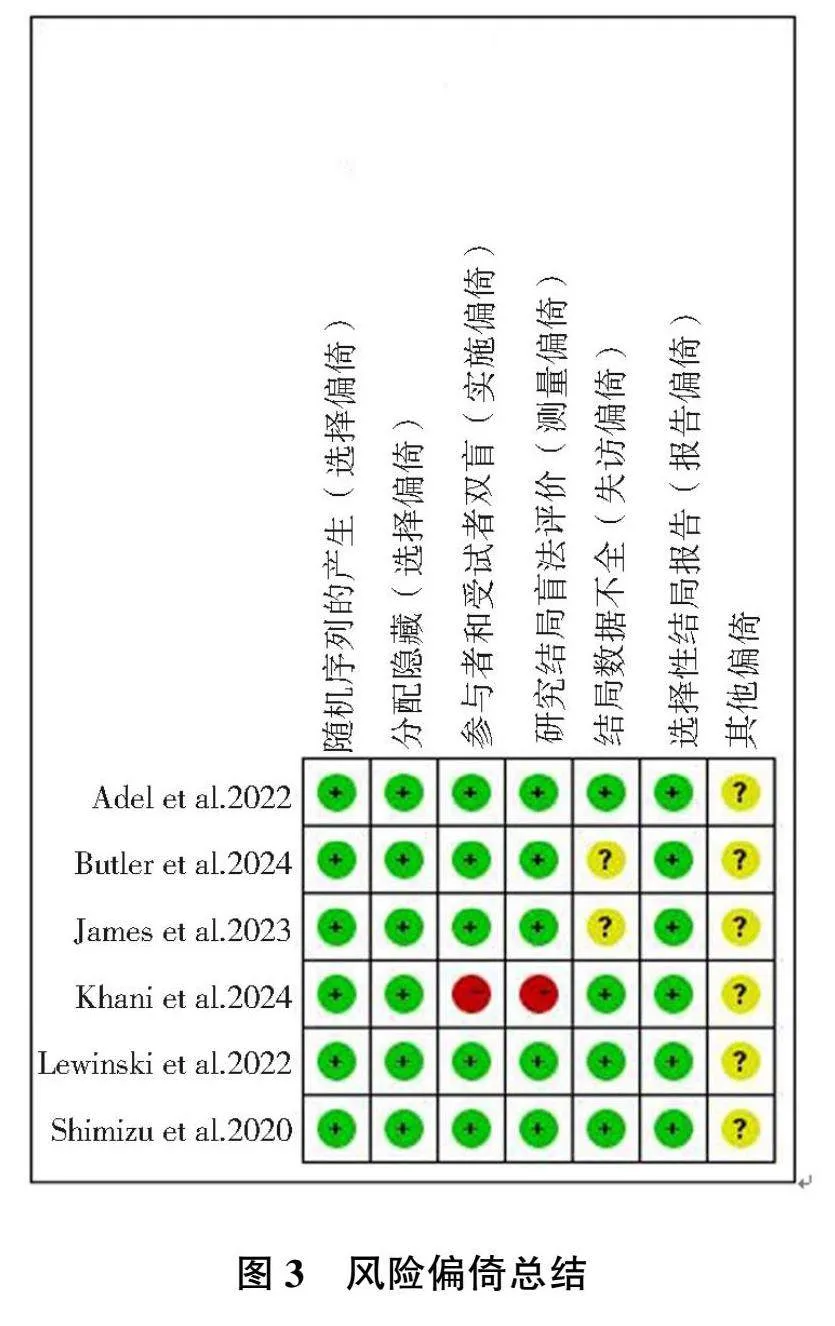
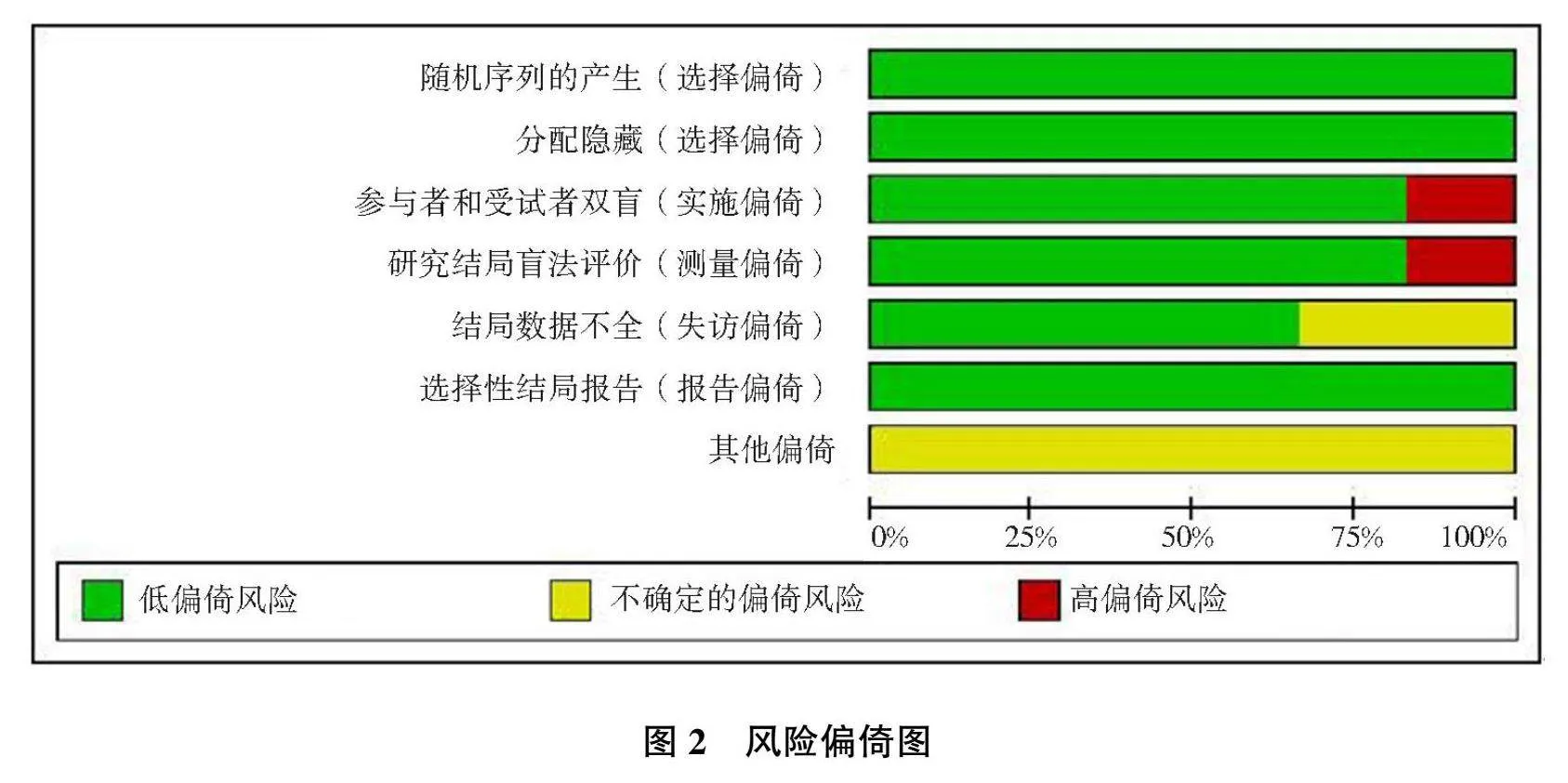
本研究共纳入6篇[2, 11, 14-17]随机对照研究,共涉及研究对象11 012例,其中SGLT-2抑制剂组5 512例,安慰剂组5 500例,纳入研究特征见表1。应用Cochrane风险偏倚评估工具对6篇随机对照研究进行风险偏倚评估,6篇随机对照研究质量较高,评价结果见图2—3。
2.3"Meta分析结果
2.3.1"心力衰竭住院风险
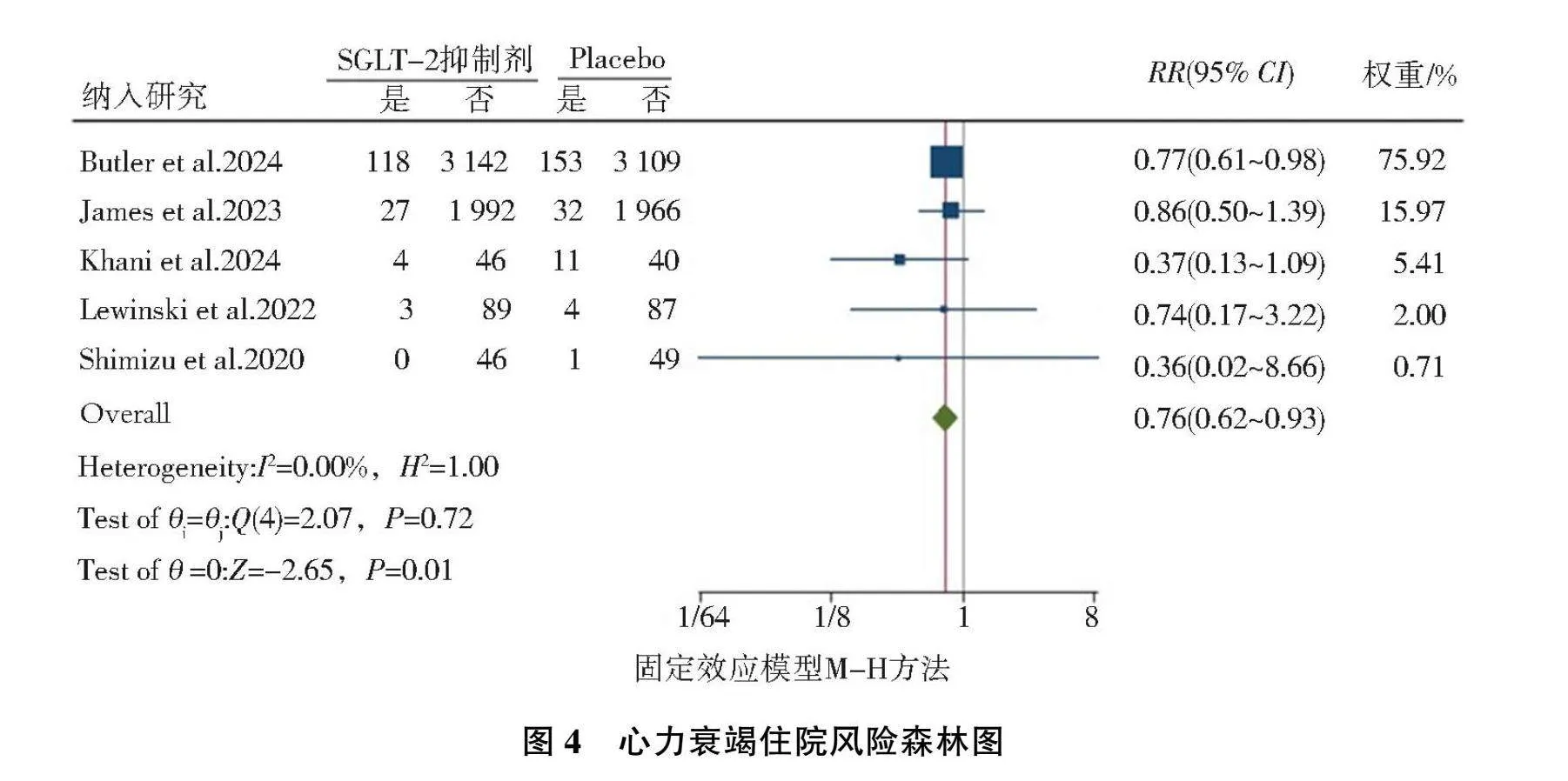
共纳入5篇[2, 11, 15-17]随机对照研究,异质性检验结果为(I2=0.00%, P=0.72),故选择固定效应模型,结果显示,AMI后标准治疗基础上加用SGLT-2抑制剂可减少心力衰竭住院风险(RR=0.76, 95%CI=0.62~0.93, P=0.01),见图4。
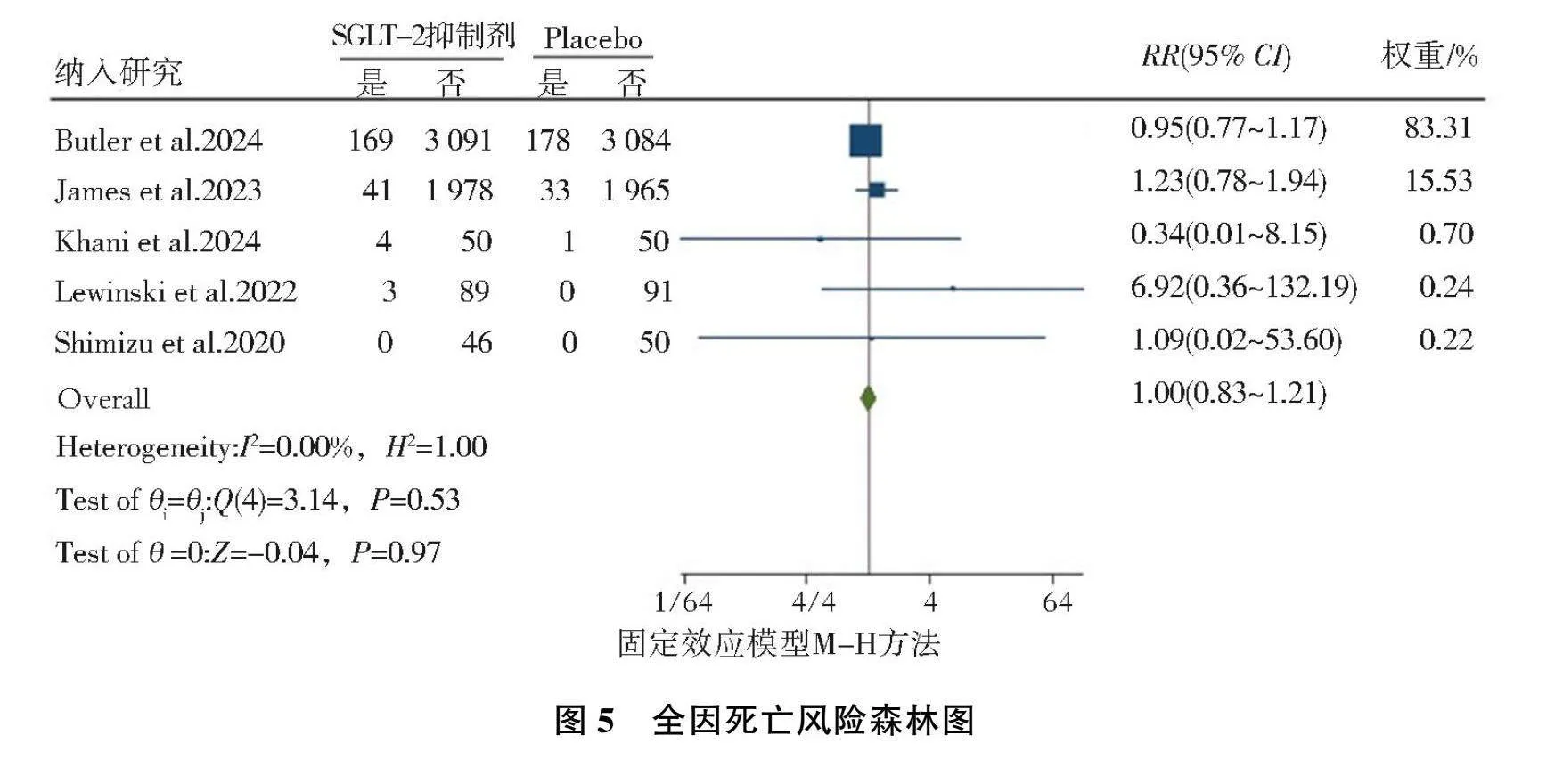
2.3.2"全因死亡风险
共纳入5篇[2, 11, 15-17]随机对照研究,异质性检验结果为(I"2=0.00%, P=0.53),故选择固定效应模型,结果显示,AMI后标准治疗基础上加用SGLT-2抑制剂后的全因死亡风险与安慰剂相比,差异无统计学意义(RR=1.00, 95%CI=0.83~1.21, P=0.97),见图5。
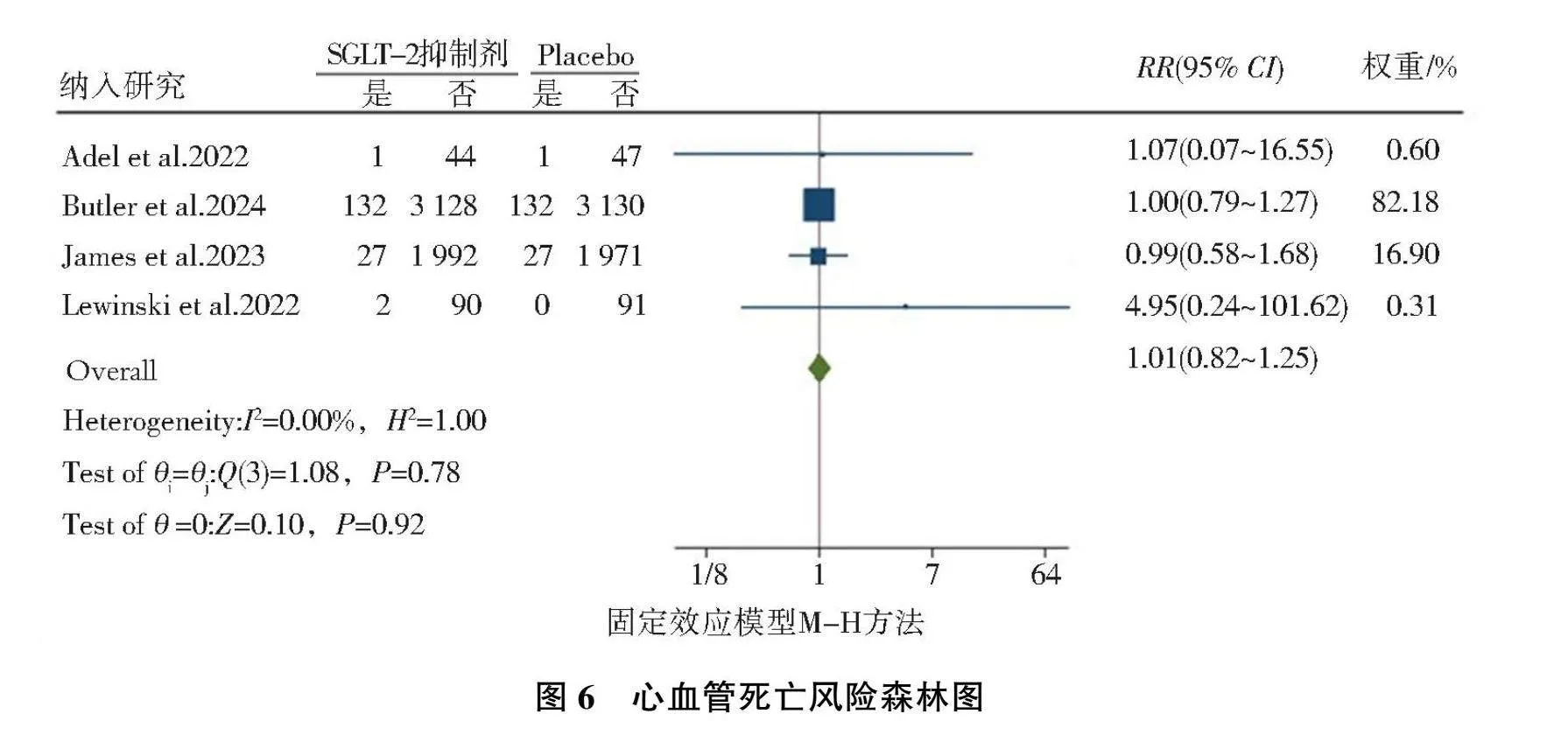
2.3.3"心血管死亡风险
共纳入4篇[11, 14-15, 17]随机对照研究,异质性检验结果为(I2=0.00%, P=0.78),故选择固定效应模型,结果显示,AMI后标准治疗基础上加用SGLT-2抑制剂后的心血管死亡风险与安慰剂相比,差异无统计学意义(RR=1.01, 95%CI=0.82~1.25, P=0.92),见图6。
2.3.4"MACE事件风险
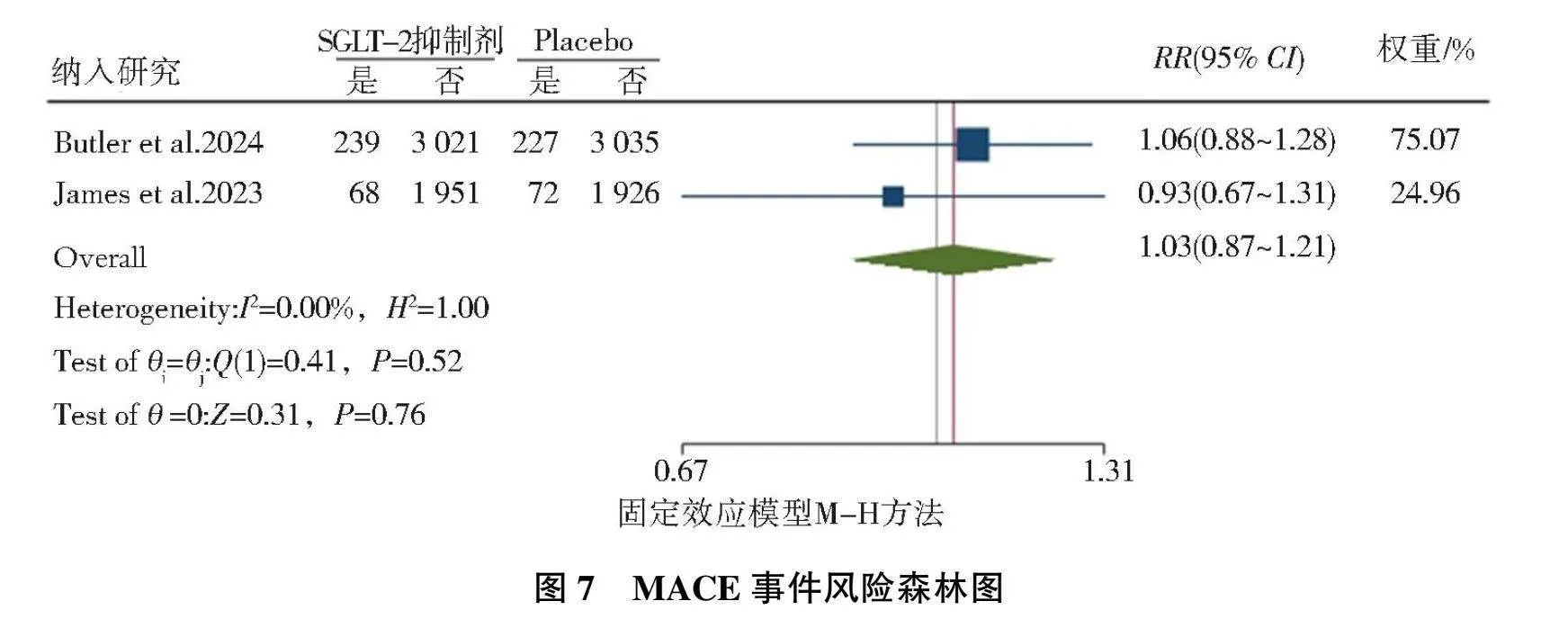
共纳入2篇[11, 15]相关随机对照研究,异质性检验结果为(I2=0.00%, P=0.52),故选择固定效应模型,结果显示,AMI标准治疗基础上加用SGLT-2抑制剂后的MACE事件风险与安慰剂相比,差异无统计学意义(RR=1.03, 95%CI=0.87~1.21, P=0.76),见图7。
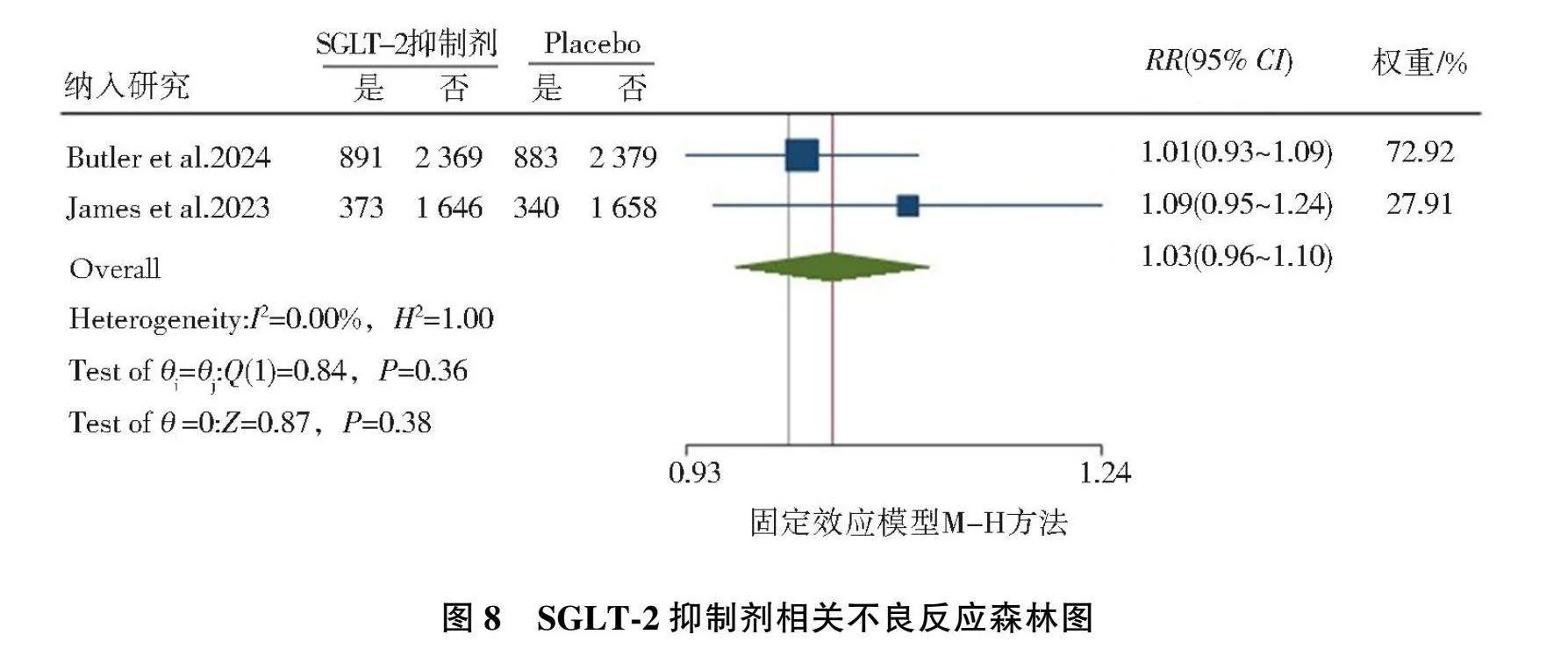
2.3.5"SGLT-2抑制剂相关不良反应
共纳入2篇[11, 15]相关随机对照研究,异质性检验结果为(I2=0.00%,P=0.36),故选择固定效应模型,结果显示,AMI后标准治疗基础上加用SGLT-2抑制剂后与安慰剂相比,SGLT-2抑制剂相关不良反应无显著增加(RR=1.03, 95%CI=0.96~1.10, P=0.38),见图8。
2.4"发表偏倚
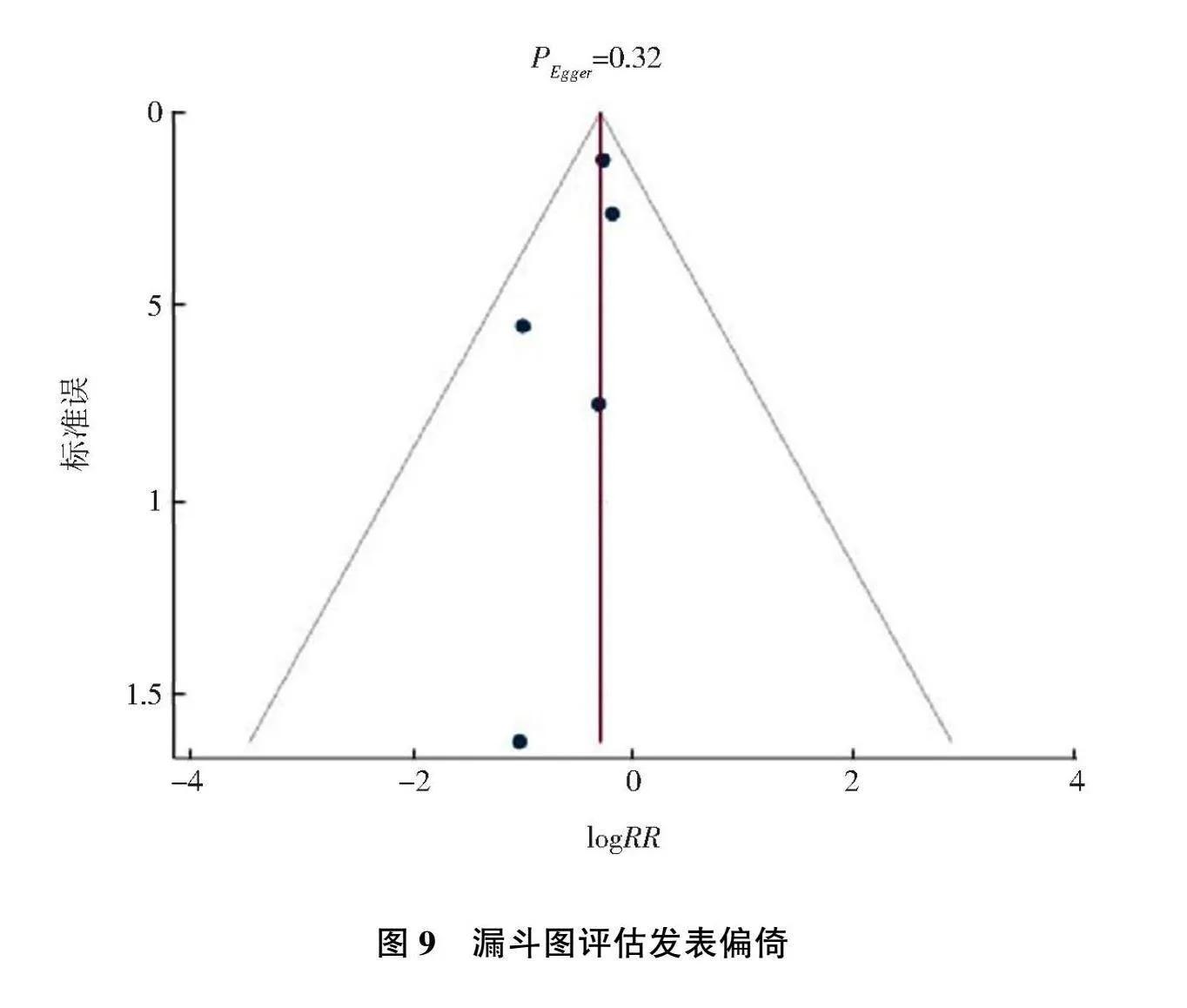
因纳入文献数量小于10篇,以心力衰竭住院风险纳入的5篇[2, 11, 15-17]文献通过漏斗图评估发现对称性欠佳,减补法发现填补后结果与填补前差异较小,提示结果稳健,Egger检验Pgt;0.05,表明存在发表偏倚的可能性较小,见图9。
3"讨论
即使采用了目前可用的治疗方案,AMI患者发生不良心血管事件的风险也很高[1-3]。本研究纳入了近5年发表的关于SGLT-2抑制剂对AMI预后影响的随机对照研究进行Meta分析,与安慰剂相比,AMI后,在标准治疗的基础上加用SGLT-2抑制剂是安全的,可降低AMI后心力衰竭住院风险,但全因死亡、心血管死亡以及MACE事件风险未显著增加或降低。
SGLT-2抑制剂可降低AMI后心力衰竭住院风险,这与目前相关研究结论[2, 11, 15, 17]不一致。探究SGLT-2抑制剂对AMI后影响,最早可追溯到Shimizu等[2]和von Lewinski等[17]研究。Shimizu等[2]研究分析了恩格列净治疗AMI后对拟交感神经活性的影响,并报告了恩格列净组和安慰剂组NT-proBNP浓度较基线下降,然而2组差异无统计学意义,随访期间没有观察到心力衰竭住院事件。von Lewinski等[17]研究显示,恩格列净降低了AMI后NT-proBNP水平并改善了心脏超声参数,但报告的因心力衰竭住院不良事件差异无统计学意义。值得注意的是,上述2个研究纳入的总人数较少,随访周期较短。James等[15]研究纳入了较多的病例,随访时间11.6个月,但对心力衰竭的综合发生率没有影响。Butler等[11]研究,随访17.9个月,得出相同的结论。但2个研究均受到新型冠状病毒大流行的影响,其中Butler等[11]部分研究地区处于战争状态,造成因心力衰竭住院率减少,这对研究结果造成的影响是不清楚的。但Butler 等研究对恩格列净组首次心力衰竭住院和心力衰竭住院总次数的探索性分析结果显示,恩格列净可降低心力衰竭住院风险。本Meta分析综合目前随机对照研究的结果显示,SGLT-2抑制剂减少了AMI后心力衰竭住院风险,这与目前已知的SGLT-2抑制剂改善心力衰竭和左心室功能降低患者的预后[7-10]结果一致。因此,可能有必要进一步研究SLGT-2抑制剂对AMI后高危患者心力衰竭结局的影响。
在全因死亡风险和心血管死亡风险以及MACE事件方面,SGLT-2抑制剂组与安慰剂组相比差异无统计学意义。Shimizu等[2]在随访期间未记录到死亡,这可能与纳入病例少,随访时间短有关。von Lewinski等[17]在随访期间发生了3例死亡,全部发生在恩格列净组。2例参与者在试验入组后5 d内死亡,继发于心肌梗死和随后的心源性休克。1例参与者在入组后149 d因肺癌死亡。在解盲之前,评审委员会认为这3例死亡与研究药物无关。James等[15]研究排除了糖尿病和慢性心力衰竭患者,与其他心肌梗死相关研究相比,入组人群心血管事件的风险较低且参加试验的患者几乎完全接受了目前指南[18-19]指导的药物和血运重建等治疗,这些因素降低了病死率及MACE事件。Butler等[11]在随机分组时,一些左心室受损的患者可能有可逆的顿抑心肌,在这些低风险人群中,血运重建术后顿抑心肌通常会逆转,不太可能进一步改善[20-22],这种情况在急性ST 段抬高型心肌梗死人群中非常明显。在Butler等[11]研究中,急性ST段抬高型心肌梗死患者占近75%,其中约90%患者接受了早期血运重建术,这很大程度降低了病死率及MACE事件。总的来说,AMI后早期的血运重建术及指南指导的药物治疗降低了SGLT-2抑制剂额外的获益。另一个原因是纳入研究的随访时间较短,这可能使观察到的病死率相对较低。先前对SGLT-2抑制剂的大型研究显示,3~4年随访后心血管事件减少[7-8],而本分析中纳入的研究随访时间最长不到2年。
在安全性方面,本分析得出,SGLT-2抑制剂并没有带来严重的不良反应[8,11],如酮症酸中毒、低血压、泌尿道感染、肾功能受损等。这进一步证明了SGLT-2抑制剂在各种心血管风险患者中的安全性,并为这些药物在住院患者中应用的安全性提供了依据。
本Meta分析结果进一步提高了AMI后在标准治疗的基础上加用SGLT-2抑制剂能否带来获益的认识。本Meta分析有一定局限性:(1)纳入总的随机对照研究数量较少;(2)其中部分随机对照研究纳入病例数相对较少;(3)纳入的所有随机对照研究随访时间均相对较短;(4)纳入病例数较多研究,如James等[15]和Butler等[11]研究,研究期间处于新型冠状病毒大流行期间,这可能使得研究结果产生一定偏倚。由于本研究存在局限性,期待开展更多相关的高质量随机对照研究加以验证。
参考文献:
[1]JERNBERG T, HASVOLD P, HENRIKSSON M, et al. Cardiovascular risk in post-myocardial infarction patients: nationwide real world data demonstrate the importance of a long-term perspective[J]. Eur Heart J, 2015, 36(19): 1163-1170. DOI: 10.1093/eurheartj/ehu505.
[2]SHIMIZU W, KUBOTA Y, HOSHIKA Y, et al. Effects of empagliflozin versus placebo on cardiac sympathetic activity in acute myocardial infarction patients with type 2 diabetes mellitus: the EMBODY trial[J]. Cardiovasc Diabetol, 2020, 19(1): 148. DOI: 10.1186/s12933-020-01127-z.
[3]KOCHAR A, CHEN A Y, SHARMA P P, et al. Long-term mortality of older patients with acute myocardial infarction treated in US clinical practice[J]. J Am Heart Assoc, 2018, 7(13): e007230. DOI: 10.1161/JAHA.117.007230.
[4]SZUMMER K, WALLENTIN L, LINDHAGEN L, et al. Improved outcomes in patients with ST-elevation myocardial infarction during the last 20 years are related to implementation of evidence-based treatments: experiences from the SWEDEHEART registry 1995-2014[J]. Eur Heart J, 2017, 38(41): 3056-3065. DOI: 10.1093/eurheartj/ehx515.
[5]PITT B, AHMED A, LOVE T E, et al. History of hypertension and eplerenone in patients with acute myocardial infarction complicated by heart failure[J]. Hypertension, 2008, 52(2): 271-278. DOI: 10.1161/HYPERTENSIONAHA.107.109314.
[6]PFEFFER M A, CLAGGETT B, LEWIS E F, et al. Angiotensin receptor-neprilysin inhibition in acute myocardial infarction[J]. N Engl J Med, 2021, 385(20): 1845-1855. DOI: 10.1056/NEJMoa2104508.
[7]WIVIOTT S D, RAZ I, BONACA M P, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes[J]. N Engl J Med, 2019, 380(4): 347-357. DOI: 10.1056/NEJMoa1812389.
[8]ZINMAN B, WANNER C, LACHIN J M, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes[J]. N Engl J Med, 2015, 373(22): 2117-2128. DOI: 10.1056/NEJMoa1504720.
[9]ANKER S D, BUTLER J, FILIPPATOS G, et al. Empagliflozin in heart failure with a preserved ejection fraction[J]. N Engl J Med, 2021, 385(16): 1451-1461. DOI: 10.1056/NEJMoa2107038.
[10]SOLOMON S D, MCMURRAY J J V, CLAGGETT B, et al. Dapagliflozin in heart failure with mildly reduced or preserved ejection fraction[J]. N Engl J Med, 2022, 387(12): 1089-1098. DOI: 10.1056/NEJMoa2206286.
[11]BUTLER J, JONES W S, UDELL J A, et al. Empagliflozin after acute myocardial infarction[J]. N Engl J Med, 2024, 390(16): 1455-1466. DOI: 10.1056/NEJMoa2314051.
[12]THYGESEN K, ALPERT J S, JAFFE A S, et al. Fourth universal definition of myocardial infarction (2018)[J]. Eur Heart J, 2019, 40(3): 237-269. DOI: 10.1093/eurheartj/ehy462.
[13]HIGGINS J P T, ALTMAN D G, GTZSCHE P C, et al. The Cochrane Collaboration,s tool for assessing risk of bias in randomised trials[J]. BMJ, 2011, 343: d5928. DOI: 10.1136/bmj.d5928.
[14]ADEL S M H, JORFI F, MOMBEINI H, et al. Effect of a low dose of empagliflozin on short-term outcomes in type 2 diabetics with acute coronary syndrome after percutaneous coronary intervention[J]. Saudi Med J, 2022, 43(5): 458-464. DOI: 10.15537/smj.2022.43.5.20220018.
[15]JAMES S, ERLINGE D, STOREY R F, et al. Dapagliflozin in myocardial infarction without diabetes or heart failure[J]. NEJM Evid, 2024, 3(2): EVIDoa2300286. DOI: 10.1056/EVIDoa2300286.
[16]KHANI E, ASLANABADI N, MEHRAVANI K, et al. Empagliflozin effects in patients with ST-elevation myocardial infarction undergoing primary PCI: the EMI-STEMI randomized clinical trial[J]. Am J Cardiovasc Drugs, 2024, 24(5): 673-684. DOI: 10.1007/s40256-024-00662-4.
[17]VON LEWINSKI D, KOLESNIK E, TRIPOLT N J, et al. Empagliflozin in acute myocardial infarction: the EMMY trial[J]. Eur Heart J, 2022, 43(41): 4421-4432. DOI: 10.1093/eurheartj/ehac494.
[18]IBANEZ B, JAMES S, AGEWALL S, et al. 2017 ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the task force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European society of cardiology (ESC)[J]. Eur Heart J, 2018, 39(2): 119-177. DOI: 10.1093/eurheartj/ehx393.
[19]BYRNE R A, ROSSELLO X, COUGHLAN J J, et al. 2023 ESC Guidelines for the management of acute coronary syndromes[J]. Eur Heart J Acute Cardiovasc Care, 2024, 13(1): 55-161. DOI: 10.1093/ehjacc/zuad107.
[20]FRANTZ S, HUNDERTMARK M J, SCHULZ-MENGER J, et al. Left ventricular remodelling post-myocardial infarction: pathophysiology, imaging, and novel therapies[J]. Eur Heart J, 2022, 43(27): 2549-2561. DOI: 10.1093/eurheartj/ehac223.
[21]SJBLOM J, MUHRBECK J, WITT N, et al. Evolution of left ventricular ejection fraction after acute myocardial infarction: implications for implantable cardioverter-defibrillator eligibility[J]. Circulation, 2014, 130(9): 743-748. DOI: 10.1161/CIRCULATIONAHA.114.009924.
[22]CHEW D S, HEIKKI H, SCHMIDT G, et al. Change in left ventricular ejection fraction following first myocardial infarction and outcome[J]. JACC Clin Electrophysiol, 2018, 4(5): 672-682. DOI: 10.1016/j.jacep.2017.12.015.
(责任编辑:高艳华)

