雷帕霉素减轻碘佛醇诱导的模型大鼠急性肾损伤
李庆菊,于 然,陈佳佳,陈皓瑜,宋 坚,王万鹏*
1.南京医科大学康达学院附属医院 涟水县人民医院,江苏 淮安 223400;2.扬州大学医学院 临床学院 江苏省中西医结合老年病防治重点实验室,江苏 扬州 225009;3.江苏护理职业学院,江苏 淮安 223400
造影剂肾病(contrast-induced nephropathy; CIN)属于含碘造影剂诱导的肾毒性急性肾损伤(acute kidney injury;AKI),是造成医源性肾功能衰竭的重要原因,目前仍缺乏有效的治疗手段[1-2]。自噬是一种溶酶体降解途径,可通过形成自噬小体和自噬溶酶体来降解损坏的细胞器。研究发现,自噬在AKI中具有重要作用,在AKI急性期,近端肾小管细胞通过诱导自噬启动内在保护机制[3]。近年来证实,组蛋白去乙酰化酶4(histone deacetylase 4;HDAC4)的上调可促进AKI的发生,可能与介导自噬相关[4]。但是在造影剂碘佛醇(ioversol)诱导的AKI中,自噬的激活及自噬对HDDC4的影响目前还不是很清晰。据此,本研究以造影剂诱导的AKI(contrast-induced acute kidney injury;CI-AKI)大鼠模型为研究对象,旨在探讨自噬对CI-AKI的调节作用及潜在的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性SD大鼠24只,质量200~220 g(上海必凯科翼生物科技有限公司[SCXK(沪)2018-0006])。
1.1.2 试剂:碘佛醇(恒瑞医药有限公司;320 mg 碘/mL);雷帕霉素(rapamycin;RAPA)和羟基氯喹(hydroxychloroquine;HCQ)(MCE生物技术有限公司);血清肌酐(serum creatinine; Scr)和血尿素氮(blood urea nitrogen; BUN)试剂盒(南京建成生物研究所);苏木精-伊红(Sigma-Aldrich公司);戊二醛(SPI-Chem公司);锇酸(Ted Pella公司);p62抗体和LC3抗体(武汉三鹰生物技术有限公司);HDAC4抗体(武汉爱博泰克生物技术有限公司);Triol试剂(Ambition公司);SYBR green染料(镇江爱必梦生物技术有限公司);引物合成(上海生工生物技术有限公司)。
1.2 方法
1.2.1 大鼠的分组及处理:将大鼠随机分为对照(control组;对应时间点注射等量0.9%氯化钠溶液);CI-AKI模型(model,腹腔注射呋塞米10 mL/kg,30 min后尾静脉注射碘佛醇10 mL/kg)组;雷帕霉素(RAPA;造模前灌胃注射RAPA 4.5 mg/kg)组和羟基氯喹(HCQ;造模前灌胃注射HCQ 20 mg/kg)组,每组均n=6,造模前每天给药持续3 d。碘佛醇注射24 h后收集血清和肾脏样本。Scr值在造影剂暴露后较基础值增加≥25%视为造模成功[5]。
1.2.2 肾功能指标的检测:根据试剂盒的说明,检测Scr及BUN的含量。
1.2.3 苏木精-伊红(HE)染色观察肾脏组织病理学变化: 将包埋肾脏组织的石蜡块切成4 μm的切片,经二甲苯和梯度乙醇脱水,HE染色,光学显微镜下(× 400)观察肾脏组织病理学变化。
1.2.4 透射电镜观察肾脏超微结构:切取1 mm3肾皮质新鲜组织小块,经常规固定和梯度乙醇脱水,环氧树脂梯度渗透后包埋,切成60 nm厚的超薄切片。切片用3%醋酸铀和2.7%柠檬酸铅双染,透射电镜观察自噬超微结构。
1.2.5 Western blot 检测蛋白质表达: 取冷冻肾脏组织,冰上裂解30 min,12 000 r/min离心15 min,BCA测定蛋白质浓度。煮沸变性后电泳分离、转膜、室温封闭4 h,加入稀释浓度1∶1 000的一抗LC3、p62、HDAC4及β-actin,4 ℃孵育过夜。隔天,二抗孵育,ECL发光液显影,采用Image J软件进行半定量分析。
1.2.6 RT-qPCR检测mRNA表达:用Trizol提取总RNA,按照cDNA合成试剂盒说明,将RNA反转录成cDNA。cDNA加入SYBR Green Master mix探针行RT-qPCR检测。采用2-ΔΔCt法计算目的基因相对于GAPDH的表达水平,实验重复3次。引物序列如下:HDAC4上游引物:5′-TTGGATGTCACAGACTCC GC-3′;HDAC4下游引物:5′-GATGGCGATGTGTAG AGGGG-3′。
1.3 统计学分析
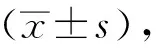
2 结果
2.1 大鼠血清中BUN及Scr含量的比较
与对照组相比,模型组中血血清BUN及血清Scr含量明显增加(P<0.01)。与模型组相比,RAPA组中BUN及Scr含量明显降低(P<0.01)(表1)。

表1 RAPA和HCQ对CI-AKI大鼠肾脏功能的影响Table 1 Effects of RAPA and HCQ on renal function
2.2 HE染色观察大鼠肾脏组织病理学变化
对照组大鼠无明显组织病理学变化,模型组大鼠表现为肾小管结构肿胀及排列紊乱,出现充血、空泡变性及炎性细胞浸润等病理学损伤;与模型组相比,RAPA组大鼠上述病理学损伤明显改善,而HCQ组无明显缓解(图1)。
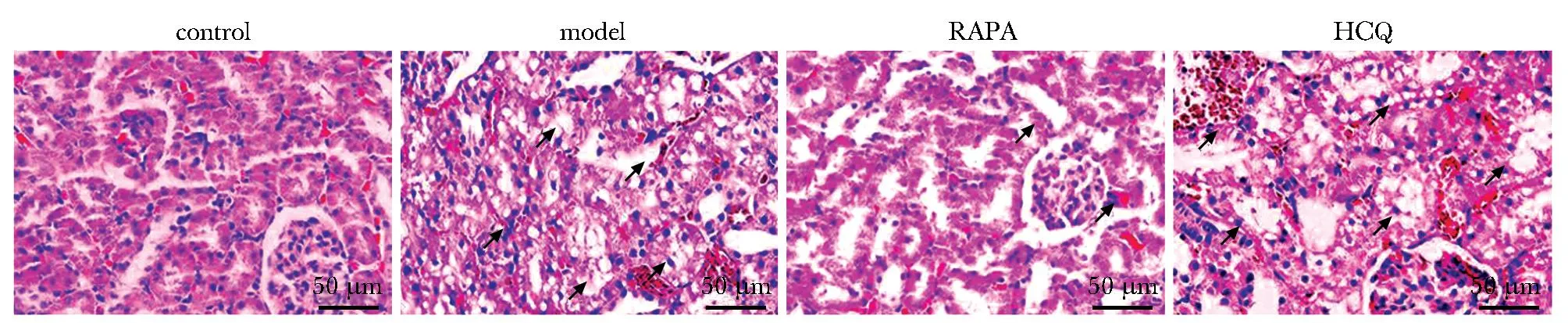
RAPA.rapamycin; HCQ, hydroxychloroquine; Black arrows indicates vacular degeneration, renal tubular swelling, congestion or inflammatory cell infiltration.图1 RAPA和HCQ对CI-AKI大鼠肾脏组织病理学的影响Fig 1 Effects of RAPA and HCQ on histopathology of kidney in CI-AKI rats(×400)
2.3 透射电镜观察大鼠自噬超微结构
对照组线粒体形态良好,无明显空泡,肾小管上皮细胞细胞核结构完好,几乎没有自噬小体或自噬溶酶体的出现。模型组出现部分线粒体及空泡化,可见部分自噬小体和自噬溶酶体。在RAPA组,自噬小体或自噬溶酶体的数量明显增加(P<0.01)。 HCQ组中自噬小体或自噬溶酶体的形成受到抑制(P<0.01)(图2)。
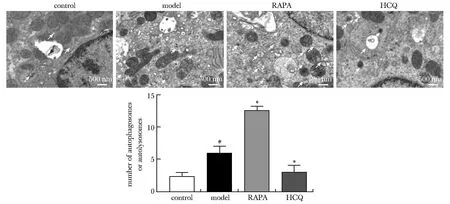
RAPA.rapamycin; HCQ.hydroxychloroquine; Red arrows indicated autophagosomes, autolysosomes or autophogic vacuoles;#P<0.01 compared with control group; *P<0.01 compared with model group.图2 RAPA和HCQ对大鼠组织自噬相关超微结构的影响Fig 2 Effects of RAPA and HCQ on autophagy-related ultrastructure in rat tissues (×10 000)
2.4 肾脏组织自噬蛋白表达水平
相比较于对照组,模型组LC3Ⅱ/LC3Ⅰ表达明显增加(P<0.05),p62表达降低(P<0.01)。相比较于模型组,RAPA组LC3Ⅱ/LC3Ⅰ表达增加(P<0.05),p62表达明显降低(P<0.01)。此外,HCQ进一步增加了LC3Ⅱ/LC3Ⅰ和p62的蛋白表达(P<0.01)(图3)。
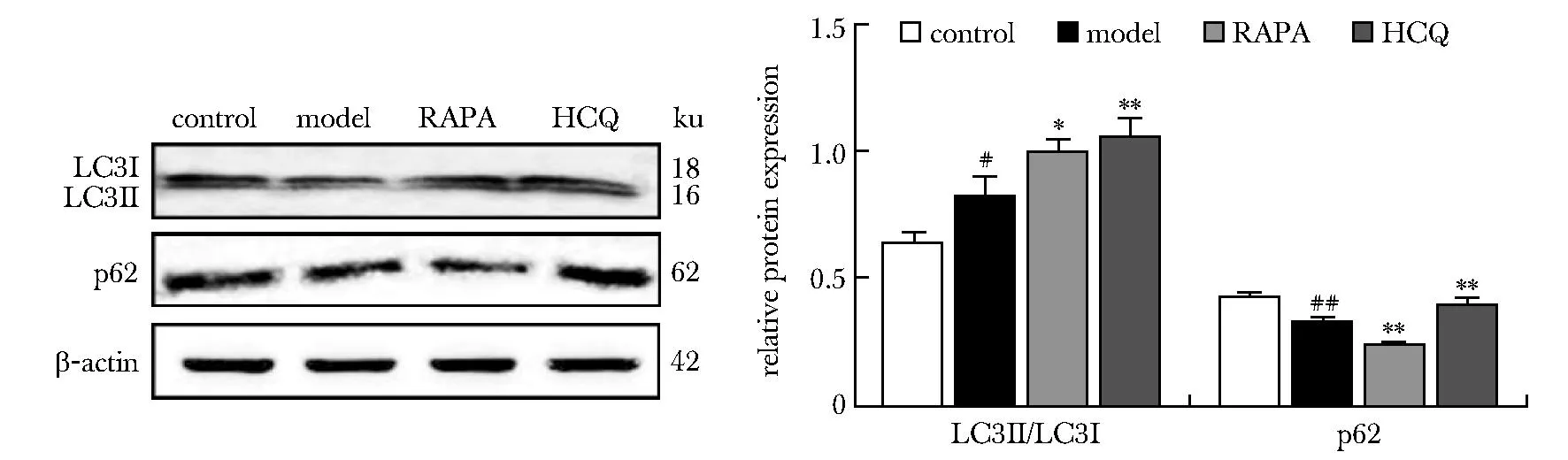
RAPA.rapamycin; HCQ.hydroxychloroquine; #P<0.05, ##P<0.01 compared with control group;*P<0.05, **P<0.01 compared with model group.图3 Western blot和RT-qPCR检测肾脏组织中LC3及p62的表达Fig 3 Expression of LC3 and pP62 in renal tissues was detected by Western blot and
2.5 肾脏组织HDAC4蛋白和mRNA表达水平比较
模型组和HCQ组HDAC4蛋白表达显著增加(P<0.01),而RAPA组HDAC4水平较模型组明显降低(P<0.01),同样地,与对照组相比,模型组及HCQ组中HDAC4 mRNA表达均有增加(P<0.01),RAPA组中HDAC4 mRNA表达明显降低(P<0.05)(图4)。

RAPA.rapamycin; HCQ.hydroxychloroquine; #P<0.01 compared with control group;*P<0.05, **P<0.01 compared with model group.图4 Western blot和RT-qPCR检测HDAC4蛋白和mRNA在肾脏组织中的表达Fig 4 Expression of HDAC4 protein and mRNA in renal tissues was detected by Western blot
3 讨论
静脉注射含碘造影剂(iodinated contrast media;CM)诱导的医源性AKI称之为CIN[6],它与住院患者死亡风险的增加及潜在的慢性肾病(chronic kidney disease;CKD)的加速进展密切相关[7]。本研究使用造影剂碘佛醇建立CI-AKI大鼠模型,结果显示造模后,血清中BUN、Scr的含量明显增加并观察到肾损伤(肾小管扩张、肿胀、坏死、管腔充血),提示造模成功。
自噬是真核细胞维持内稳态和更新的一种进化上保守的机制,参与了广泛的生理病理过程,在肾脏疾病中扮演着重要角色[8]。在CIN病理状态下,调节自噬被认为是一种有效的治疗策略[9]。有文献报道,CM诱导的应激条件可使肾脏自噬激活,αKlotho通过抑制AKT/mTOR信号通路进一步上调自噬水平可抑制NLRP3炎性小体介导的焦亡,改善大鼠肾功能[10]。自噬标记蛋白LC3是形成自噬小体的重要组成部分,无自噬时,LC3主要聚集于胞浆中,当启动自噬时, LC3Ⅰ转化为LC3Ⅱ定位于自噬体膜可与溶酶体结合,p62蛋白在自噬过程中先与泛素化蛋白结合,后与LC3Ⅱ蛋白形成复合物并被自噬溶酶体消除,通常p62蛋白水平增强表明自噬抑制。因此,本研究用LC3Ⅱ/LC3Ⅰ和p62活性衡量自噬水平。同报道一致,碘佛醇诱导的应激可使暖脏自噬激活。自噬调节剂RAPA(自噬激动剂)和HCQ(自噬抑制剂)被应用于干预CIN,在本研究中也发现RAPA通过进一步增强自噬可缓解CIN,而HCQ则加剧肾功能障碍和组织病理学损伤。上述研究表明,自噬在CI-AKI发生发展及治疗中起着至关重要的作用。
HDAC4是Ⅱa类HDAC家族的重要成员,可以参与肾脏疾病中自噬的调节[11]。在叶酸和缺血/再灌注诱导的AKI中HDAC4的表达明显增加,HDAC4选择性抑制剂TMP269能够有效促进细胞自噬,表现为自噬相关蛋白表达增加[4]。同报道一致,模型组的大鼠表现为HDAC4表达的上调。另外,RAPA属于一种特异性mTOR抑制剂。先前报道,α-酮戊二酸(alpha-ketoglutarate,AKG)可通过抑制mTOR通路增强自噬抑制HDAC4的表达来延缓衰老[12]。但也有报道自噬抑制剂氯喹(chloroguine,CQ)可抑制HDAC的活性[13]。本研究也发现RAPA可抑制HDAC4的表达,而HCQ组中HDAC4表达明显增加,表明在CI-AKI中自噬可调控HDAC4通路。
综上所述,CI-AKI可介导自噬激活,启动应激后内在保护机制。通过RAPA进一步激活自噬可有效减轻CI-AKI诱导的肾脏功能障碍,其机制可能与抑制mTOR后HDAC4的抑制相关。

