胸腔镜下解剖性肺段切除治疗早期肺部恶性肿瘤的疗效及影响因素分析
李存江,武文斌,张 辉
(徐州市中心医院胸外科,江苏 徐州 221000)
胸腔镜下解剖性肺段切除手术是一种常用于早期肺部恶性肿瘤治疗的微创手术技术[1]。随着医疗技术的不断进步,该手术在近年来得到了广泛应用,并取得了显著的疗效[2-3]。然而,肺部恶性肿瘤患者的预后仍存在一定差异,且术后并发症的发生率也不容忽视[4-5]。因此,对于影响手术疗效和并发症的因素进行分析具有重要的临床意义。本研究根据患者采用的手术方法将其分为A组43例、B组37例。A组采用胸腔镜下解剖性肺段切除术治疗,B组采用胸腔镜下解剖性肺叶切除术治疗。观察两组患者临床围术期指标、肺功能指标术后并发症及近期预后及疾病对影响预后的相关因素进行分析。对我院2021年1月至2022年1月收治的肺癌患者80例临床资料进行分析,现将结果报告如下。
1 资料与方法
1.1 一般资料 对2021年1月至2022年1月我院收治的肺癌患者80例临床资料进行分析。病例纳入标准:①患者经病理检测确诊为肺部恶性肿瘤;②临床资料完整无缺失;③TNM分期为ⅠA期;④经临床常规检查具备手术指征。排除标准:①非原发性肺部恶性肿瘤;②影像学检查显示病灶存在转移;③患有糖尿病、甲状腺疾病者;④肝肾功能不全或患有严重的其他系统的功能障碍;⑤存在交流沟通障碍,无法用言语准确表述所想、所言、所感,无法正确理解医务人员话语意思;⑥患有精神、心理疾病且长期服用此类治疗药物。根据患者采用的手术方法将其分为A组43例、B组37例。A组男25例,女18例;年龄35~78岁,平均(55.9±10.41)岁;组织学类型:腺癌41例,鳞癌2例;TNM分期:ⅠA1期15例,ⅠA2期20例,ⅠA3期8例。B组男24例,女13例;年龄36~76岁,平均(57.22±11.40)岁;组织学类型:腺癌36例,鳞癌1例;TNM分期:ⅠA1期16例,ⅠA2期15例,ⅠA3期6例。两组性别、年龄等一般资料比较差异无统计学意义(均P>0.05),具有可比性。本研究获得我院伦理委员批准通过。
1.2 治疗方法 所有患者均采用全身静脉麻醉、行双腔气管插管单肺通气。选择单操作孔手术法,于腋中线第7肋或第8肋间隙间切口1 cm,为探查孔。腋前-中线第4或第5肋间切开3~4 cm为操作孔。两组均采用超声刀或电凝法分离组织,采用术前CT引导下定位钩定位,或术前影像,或三维重建技术,或手指触摸法,定位肿块;利用切割缝合器切除病变肺段,注意与病灶保持2 cm距离。两组患者均行系统性肺门、纵隔淋巴结采样或清扫,术后将肿块与淋巴结送检,确定术后病理分期。
1.3 观察指标 ①两组围术期指标:手术时间、术中出血量、术后住院时间及术后引流量等情况进行记录。②肺功能指标:于术前、术后3个月采用肺功能仪检测肺活量(Vital capacity,VC)、第一秒用力呼气量(Forced expiratory volumein first second1,FEV1)、最大通气量(Maximal voluntary ventilation,MVV)水平。③术后并发症:记录术后肺感染、肺不张、肺漏气、心律失常、血胸/血肿等情况。④近期预后:对患者随访1年,根据患者肿瘤复发、转移情况进行分组,出现上述情况为发生组,否则为未发生组。

2 结 果
2.1 两组患者围术期指标比较 A组手术时间明显高于B组(P<0.05),术中出血量、术后引流量明显低于B组(均P<0.05),见表1。
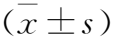
表1 两组患者围术期指标比较
2.2 两组患者术前、术后肺功能指标比较 A、B两组术后肺功能各指标明显低于术前(均P<0.05),其中A组术后各指标明显高于B组(均P<0.05),见表2。

表2 两组患者术前、术后肺功能指标比较(%)
2.3 两组患者术后不良反应发生情况 两组均出现肺感染、肺不张、肺漏气、心律失常、血胸/血肿等并发症,A组并发症发生率18.60%低于B组并发症发生率35.29%(P<0.05),见表3。

表3 两组患者术后不良反应发生情况[例(%)]
2.4 不同近期疗效患者单因素分析 根据单因素分析结果显示,组织学类型、TNM分期、手术方式、术前FEV1/MVV是影响近期预后的主要因素(均P<0.05),见表4。

表4 不同近期疗效患者单因素分析
2.5 影响近期预后的Logistic回归分析 进行Logistic回归分析需对数据进行赋值,其中疗效作为因变量,具有统计学意义指标为自变量,具体赋值情况见表5。根据Logistic回归分析显示,采用胸腔镜下解剖性肺段切除术、术前MVV、TNM分期为ⅠA3期是影响近期预后的主要影响因素(均P<0.05),见表6。

表5 Logistic回归分析变量赋值

表6 影响肺癌近期预后的因素Logistic回归分析
3 讨 论
肺癌是全球范围内最常见的癌症之一,与吸烟、家族遗传、暴露在有害化学物质或环境中等因素有关[6-7]。根据世界卫生组织的数据,每年肺癌的发病率约为200万人,占所有癌症发病人数的11.6%[8-9],每年约有157.3万人死于肺癌,占全球癌症死亡人数的18.4%[10]。胸腔镜肺切除手术是一种微创手术技术,通过在患者胸部进行小切口,将胸腔镜插入体内,利用摄像系统观察和操作器械进行肺切除手术[11]。近年来,研究证实,对于早期肺癌,解剖性肺段切除术能保留更多的肺功能,在部分早期肺癌中预后更优[12]。
本研究中,A组采用胸腔镜下解剖性肺段切除术治疗,B组采用胸腔镜下肺叶切除术治疗。结果发现B组手术时间明显高于A组,A组术中出血量、术后引流量明显低于B组,从解剖手术学上分析,由于每一肺段都有单独的支气管分支和血供循环体系,是相对独立的功能单位,即可进行解剖、分离肺段支气管、肺动脉,并对相应的肺组织进行切除,手术中还能处理肺段间可能出现转移的淋巴结,解剖方式较为复杂性,患者个体解剖结构也有所不同,对靶肺段血管、支气管、肺段界把控较难判断,因此与肺叶切除相比,其手术时间较长。此外,肺叶切除手术相对于肺段切除手术有更大的创伤范围和血管数目,因此术中出血量可能会更多。胸腔镜下解剖性肺段切除手术的切除范围较小,残余肺组织,术后膨胀,可以较快填充术后空腔,较快形成粘连,故术中出血量、术后引流量较少[13-14]。本研究中,A、B两组术后肺功均差于术前,A组肺功能好于B组,可见胸腔镜下解剖性肺段切除只切除受病变侵袭的特定肺段,保留了其他健康的肺组织,减少了整体肺功能的丧失[15-16]。而胸腔镜下解剖性肺叶切除会切除整个肺叶,对肺功能影响较大[17]。万晓旭等[18]研究证实,肺段切除组术后FVC、FEV1、MVV3项指标下降较肺叶切除组低。此外,本研究记录术后并发症情况,两组均出现肺感染、肺不张、肺漏气、心律失常、血胸/血肿等并发症,A组不良反应发生率20.00%低于B组并发症发生率35.29%,与赵晓龙等[19]研究中肺段和肺叶切除术患者均出现肺感染、肺漏气、肺不张、心律失常等并发症,肺叶切除组不良反应发生率高于肺段切除组结果一致。
进一步Logistic回归分析显示:胸腔镜下解剖性肺段切除术、术前MVV、FEV1、MVV、TNM分期为ⅠA3期是影响肺癌转移、复发的危险因素。TNM分期是一种用于评估肺癌发展程度和预后的系统分类系统,其中T代表肿瘤的大小和侵袭程度,N代表淋巴结的受累情况,M代表远处的转移情况[20]。TNM分期<ⅡA期患者肿瘤较小,一般不扩散到淋巴结和远处器官[21-23]。手术切除的治疗效果更好可有效清除肿瘤,提高患者的生存率。董颖[24]通过COX回顾性分析发现,年龄、肿瘤大小、切除淋巴结数量、手术方式是影响肺癌患者预后危险因素。宦佳乐等[25]通过多因素Logistic回归分析发现,高血压、吸烟史、分化程度、病理分期是影响肺叶切除患者预后的危险因素。本研究初步证明胸腔镜下解剖性肺段切除术与肺叶切除术均能有效治疗肺部早期肿瘤,相较于肺叶切除,肺段切除术近期预后较好,术后并发症发生风险较低。但胸腔镜下解剖性肺段切除术对术者要求极高,其难点和争议点在于如何准确迅速确定肺段间的边界,多数学者主要依据肺段间静脉或肺充气与萎陷界限来判断,而选择性节段性通气膨胀肺判断边界水平时,需主要控制膨胀肺部压力、容积,避免气体通过肺泡小孔后会使邻近肺段也膨起,造成切除范围不足够,影响手术效果。
综上所述,早期肺部恶性肿瘤患者采用胸腔镜下解剖性肺段切除术治疗近期预后较好,患者手术出血量、术后引流量、术后并发症少。手术方式、术前FEV1/MVV、TNM分期为ⅠA3期是影响近期预后的主要影响因素,临床中对于此类因素要予以关注,并进一步分析,为该病患者的临床康复预后提供更多元的帮助。

