全反式维甲酸联合小剂量阿糖胞苷对急性髓系白血病细胞磷脂酰肌醇3激酶/蛋白质丝氨酸苏氨酸激酶信号通路的作用机制研究
杨白梅,鲁 猛,骆思君,王志华,伍华英,王 芳,赵耀顺
(1.华北石油管理局总医院普通内科,河北 任丘 062550;2.廊坊市中医医院,河北 廊坊 065800;3.华北石油二部医院内科,河北 任丘 062552;4.华北石油中医医院内科,河北 任丘 062550;5.华北石油管理局总医院血液内科,河北 任丘 062550)
急性髓系白血病(Acute myeloid leukemia,AML)为一类与血液系统造血干细胞有关的恶性克隆性疾病,以干细胞增殖异常,分化受阻、积聚,机体正常造血功能受到抑制为主,其发生发展与遗传、生物等多种因素关系密切[1]。阿糖胞苷(Cytarabine,Ara-C)属于嘧啶类抗代谢药物,是治疗AML的主要药物之一[2]。临床中给予高剂量Ara-C强化疗法可使AML患者的总体生存率提高,复发率下降,但药物的副作用也随之增加[3]。全反式维甲酸(All-trans retinoic acid,ATRA)属于一组维生素A的衍生物,为临床中应用最为成功的分化诱导剂,对细胞增殖、分化、凋亡和胚胎发育中具有重要作用[4-5]。二者联合用药,可诱导幼稚细胞向成熟细胞分化并促进细胞凋亡,能降低脏器损害,抑制白血病细胞增殖,疗效更佳,安全性较好[6]。AML发生和发展过程中磷脂酰肌醇3激酶(Phosphatidylinositol3-kinases,PI3K)/蛋白质丝氨酸苏氨酸激酶 (Protein-serine-threonine kinase,AKT)信号通路常被激活,被认为是AML治疗的关键靶点之一[7-8]。基于此,本研究探讨ATRA联合小剂量Ara-C对AML细胞 HL-60增殖、凋亡的影响,并进一步分析其对PI3K/AKT信号通路的作用机制。
1 材料与方法
1.1 实验材料 人急性髓系白血病细胞HL-60(中科院上海细胞库);阿糖胞苷、ATRA(美国Sigma公司);细胞培养液PRMI-1640、胎牛血清 FBS、青霉素、链霉素(美国Gibco公司);Trizol试剂(美国Invitrogen公司);MTT试剂盒、人膜联蛋白 V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)凋亡检测试剂盒(美国BD公司);反转录、BCA蛋白定量试剂盒(美国Thermo公司);鼠抗人 PI3K、p-PI3K、AKT、p-AKT及鼠抗人GAPDH抗体(美国Abcam公司);FACScan流式细胞仪(美国 Beckman Coulte公司);实时荧光定量PCR仪、光学显微镜(日本 Olympus公司);Model 680 酶标仪、电泳仪(美国 Bio-Rad公司)。
1.2 实验方法
1.2.1 细胞培养和分组:将HL-60细胞培养于PRMI-1640培养液中(10%胎牛血清,100 U/ml链霉素和青霉素),培养条件:5%CO2、37 ℃,每2天对培养液进行依次更换,并进行传代,取对数生长期细胞用于并制备细胞混悬液,进行分组:空白对照组(未经任何处理的HL-60细胞)、Ara-C组(加入0.5 μmol/L Ara-C)、ATRA组(加入2 μmol/L ATRA)、ATRA+Ara-C组(加入2 μmol/L ATRA和0.5 μmol/L Ara-C)。
1.2.2 CCK8检测HL-60细胞活力:取经药物处理后的各组细胞混悬液,对细胞密度做调整(3.0×103个/ml)并在96孔板(100 μl/孔)上接种,各组均设置5个平行复孔,分别培养24、48、72 h,并在每孔中加入10 μl CCK-8溶液,孵育2 h,酶标仪检测450 nm波长的吸光度值,实验独立重复3次,计算细胞活力变化情况。细胞活力(%)=(A加药组-A空白组)/(A对照组-A空白组)×100%。
1.2.3 Annexin V双染法检测HL-60细胞凋亡:取经药物处理后的各组细胞悬液,将1 ml细胞悬浮液1000 r/min离心5 min,PBS 洗涤细胞2次,加入200 μl的缓冲液重悬细胞,依据试剂盒说明依次加入2 μl的Annexin V和1.5 μl PI,于室内避光下孵育15 min,以流式细胞仪对各组细胞凋亡率进行测定。
1.2.4 细胞形态学观察:取经药物处理后的各组细胞混悬液1 ml,行1500 r/min离心5 min,弃上清,混匀细胞,涂片,自然干燥后,用Wright Giemsa染色,在光学显微镜下观察细胞形态变化。
1.2.5 RT-qPCR检测PI3K、AKT mRNA表达:取经药物处理24 h后的各组细胞混悬液,用Trizol法提取总RNA,取2 μg RNA进行逆转录,引物序列:PI3K上游5’-CATCACTACGTGCTGCTCTAA-3’,下游5’-CAGTAGTTCCGATTGTTCATG-3’;PI3K上游5’-GCTGATGGCGCATGCTGACA-3’,下游5’-CGGTGCGTCAGCTCGATCAT-3’;内参GAPDH上游5’-GACCACTTTGTCAAGCTCTATTTCC-3’,下游5’-GTGAGGGTCTCTCTTCCTCTTGT-3’,逆转录后于常规反应条件下扩增,以40个循环为准,通过凝胶成像仪获取图像,2-ΔΔCt对样本基因进行表达差异相对定量分析。
1.2.6 Western blot检测PI3K/AKT信号通路相关蛋白表达:取经药物处理24 h后的各组细胞混悬液,提取总蛋白,蛋白上样20 μg,经电泳分离移至PVDF膜上,选择10%的山羊血清封闭2 h后,加入一抗4 ℃孵育过夜,再加二抗常温孵育2 h,洗膜共3次,内参为GAPDH,运用化学发光液使其显色,成像拍照后行灰度值统计分析。

2 结 果
2.1 CCK8检测HL-60细胞活力 CCK8检测结果显示,空白对照组HL-60细胞活力高于Ara-C+ATRA组、Ara-C组、ATRA组,Ara-C组,ATRA组HL-60细胞活力高于Ara-C+ATRA组(均P<0.05)。
2.2 Annexin V双染法检测HL-60细胞凋亡 Annexin V双染法检测结果显示,Ara-C+ATRA组HL-60细胞凋亡率高于Ara-C组、ATRA组,Ara-C组,ATRA组HL-60细胞凋亡率高于空白对照组(均P<0.05)。
2.3 各组细胞形态学观察 HL-60细胞胞体多呈圆形,可见瘤状突起,胞核多为类圆形。Ara-C组、ATRA组染色质凝聚,颜色变深,部分胞核变小,Ara-C+ATRA组染色质凝聚,颜色变深,可见核固缩、核碎裂。见图1。
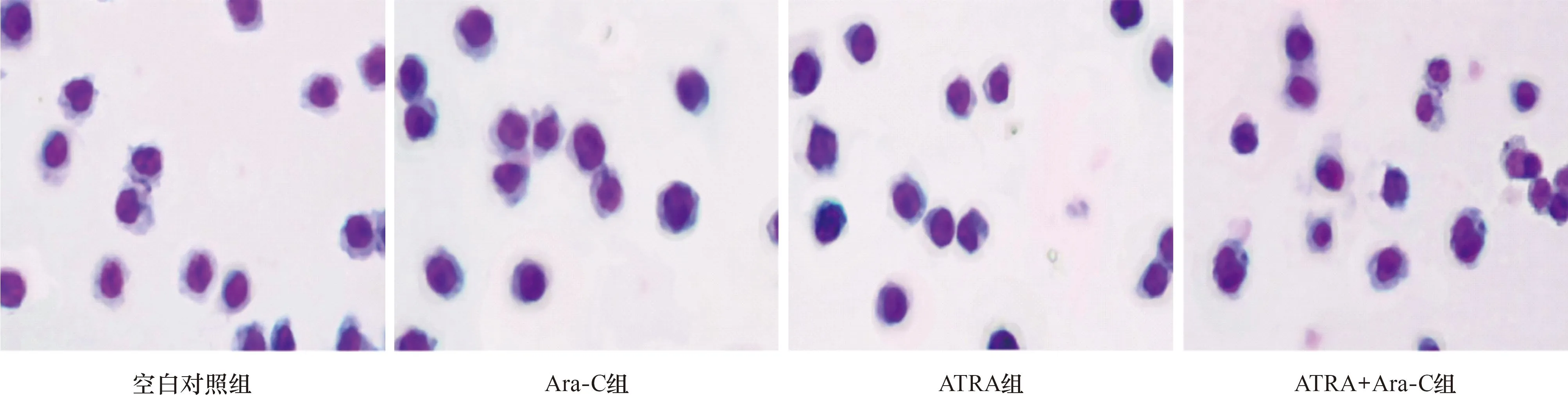
图1 各组细胞形态学观察 (Wright Giemsa染色,×200)
2.4 qRT-PCR检测PI3K、AKT mRNA表达 qRT-PCR检测结果显示,空白对照组HL-60细胞PI3K、AKT mRNA表达高于Ara-C组、ATRA组,Ara-C组,ATRA组HL-60细胞PI3K、AKT mRNA表达高于Ara-C+ATRA组(均P<0.05)。
2.5 Western blot检测PI3K/AKT信号通路相关蛋白表达 Western blot检测结果显示,空白对照组HL-60细胞P-PI3K、P-AKT 蛋白表达高于Ara-C组、ATRA组,Ara-C组、ATRA组HL-60细胞P-PI3K、P-AKT蛋白表达高于Ara-C+ATRA组(均P<0.05)。
3 讨 论
AML是一种常见血液系统恶性肿瘤,经治疗约80%患者病情有所改善,但多数整体预后不佳,5年总生存率在40%~50%[9-10]。Ara-C是一种嘧啶类抗代谢药物,进入人体后会转化成Ara-C三磷酸,通过抑制细胞DNA的合成,干扰细胞的增殖[11]。ATRA被认为是第一个肿瘤治疗的靶向药物,能与维甲酸受体,如维甲酸受体alpha(RARtα)等产生协同作用,抑制细胞周期蛋白依赖性激酶活化激酶(CAK)磷酸化RARα,诱导翻译后修饰RARα去磷酸化,使白血病细胞分化或凋亡[12-13]。ATRA联合低剂量Ara-C能发挥与强化疗法相同或者更好效果,可使化疗药物带来的脏器损害降低,优化治疗方案。肖蓉等[14]选择85例AML患者予以ATRA与小剂量阿糖胞苷联用治疗,证实小剂量Ara-C+ATRA治疗AML降低化疗风险,减少骨髓抑制毒性,早期病死率低于单独用药组。本研究发现,Ara-C+ATRA组HL-60细胞低于Ara-C组、ATRA组、空白对照组,Ara-C+ATRA组HL-60细胞凋亡率Ara-C组、ATRA组、空白对照组。HL-60细胞胞体多呈圆形、可见瘤状突起、胞核多为类圆形,Ara-C组、ATRA组染色质凝聚,颜色变深,部分胞核变小,Ara-C+ATRA组染色质凝聚,颜色变深,可见核固缩、核碎裂。这表明Ara-C+ATRA联合用药可明显抑制HL-60细胞的增殖,促其凋亡,细胞形态上也明显出现分化的特征。林晓媛等[15]发现,阿糖胞苷能通过上调miR-126抑制HL-60增殖及促进细胞凋亡。彭煜晖等[16]报道了,Ara-C能够诱导HL-60细胞凋亡,并伴c-Myc、B淋巴细胞瘤-2(BCL-2)基因的下调,并探索Ara-C诱导AML MV4-11细胞凋亡的分子机制,发现Ara-C能下调HMGB1/c-Myc的表达来抑制人AML细胞活力和诱导细胞凋亡。
PI3K-AKT是包括AML在内的癌症异常上调的细胞内通路之一,在AML中,PI3K-AKT通路对于疾病的发生和化疗敏感性非常重要,其过度激活与AML细胞的耐药和复发关系密切[17-19]。为了进一步探讨Ara-C+ATRA对HL-60细胞增殖及凋亡的作用机制,本研究选择Western blot法和qRT-PCR法测定PI3K/AKT信号通路相关蛋白和mRNA水平,结果表明,Ara-C+ATRA组HL-60细胞PI3K、AKT-mRNA及P-PI3K、P-AKT蛋白表达高于空白对照组、Ara-C组、ATRA组,分析原因可能与AML细胞系HL-60中PTEN基因有2~5外显子的缺失有关,PTEN是PI3K/AKT通路重要的负调控因子,可水解磷酸肌醇的3位磷酸,达到下调PI3K/AKT通路的信号转导功能的作用,PTEN基因突变引起了PTEN功能缺失,故PI3K、AKT蛋白磷酸化水平升高[20-22]。徐伟等[23]研究发现,FN-α、ATRA均能抑制PI3K /AKT信号通路激活,p-AKT蛋白表达降低后,对促凋亡蛋白Bad的抑制作用下降,总Bad蛋白升高,Bad蛋白通过与抗凋亡因子Bcl-2或Bcl-xL结合形成促凋亡复合体,引起一系列反应促进K562/ADM细胞凋亡。高莉等[24]证实了,AML细胞株K562和HL-60耐药株中通过siRNA敲低lncRNA CBR3-AS能降低改善AML Ara-C耐药,降低PI3K、AKT蛋白的磷酸化水平。但由于本研究为体外实验研究,后期还需进一步做动物体内实验分析Ara-C、ATRA杀伤白血病细胞的内在机制,为白血病治疗提供证据[25]。
综上所述,Ara-C、ATRA单独和联合应用均能通过抑制PI3K/AKT信号通路激活,促进HL-60细胞凋亡。

