右美托咪定通过沉默信息调节因子1/核转录因子信号通路调控脑梗死大鼠海马组织炎症机制研究
李显碧,刘尚升,肖 兵,廖 华,张 杨
(1.江油市人民医院麻醉科,四川 江油 621700;2.兴文县人民医院麻醉科,四川 兴文 644400)
脑卒中是指脑组织局部发生出血或缺血性病理改变而引起脑组织血液供给降低,继而引起严重神经功能缺损症状的神经系统疾病,是全球范围内引起人类死亡的主要原因,也是致残的第二大原因[1-2]。统计学结果表明,每年约有1500万以上新发卒中患者,其中病死人数可达三分之一。脑卒中可分为出血性卒中和缺血性卒中,其中后者又称为脑梗死,占脑卒中患者总数的85%[2]。目前临床中,针对缺血性脑卒中的主要治疗方法为手术治疗和抗血小板聚集、神经保护、溶栓等药物治疗。抗凝药对患者的副作用较多,溶栓药的治疗效果较好,但有效治疗时间窗狭窄和易引起颅内出血、致残率较高等因素导致其应用受限。因此,深入探究脑梗死的发病机制,寻求针对性的治疗药物或疗法,是临床中亟须解决的问题。
研究表明,脑梗死发生后,白细胞、星形胶质细胞等炎性细胞被激活,产生大量炎性因子[3-4],其中核转录因子κB(Nuclear factor κ gene binding,NK-κB)是炎性反应中的关键调节因子,可以通过调控肿瘤坏死因子-α(Tumor necrosis factor,TNF-α)和白细胞介素-6(Interleukin,IL-6)等促炎性因子的表达进而促进炎性反应的加重[4]。沉默信息调节因子1(Silent information regulation 1,SIRT1)是一组在脑、肝脏、脂肪等多种器官和组织中广泛分布的蛋白去乙酰化酶,主要表达于细胞核中,通过对组蛋白以及NK-κB的去乙酰化作用,参与体内细胞凋亡、氧化应激、炎性反应和增殖等生理活动,在维持生理功能和某些疾病发生发展过程中发挥重要作用,与脑梗死的发生发展密切相关[5]。
右美托咪定(Dexmedetomidine,Dex)是一种常用的α2-肾上腺素能受体激动剂,具有较好的抗炎、镇痛作用,常用于脑组织受损的疾病中发挥神经保护效用[6],但此药的详细作用机制尚未完全明晰,仍需进一步探究。因此,本研究拟采用Longa法制备脑梗死大鼠模型,探究Dex对脑梗死大鼠治疗作用及其可能的机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:选择SPF级SD雄性大鼠共60只,体重(200±20)g,实验动物购于北京维通利华实验动物技术公司[许可证编号SCCK(京)2016-0011]。所有大鼠均进行1周适应性饲养,自由饮食饮水,保持12 h/12 h光暗周期。
1.1.2 实验药品:盐酸右美托咪定注射液购(规格1ml:0.1mg,国药准字H20143195)。
1.1.3 实验仪器:大脑中动脉栓塞(MCAO)线栓(北京西浓科技),蛋白质电泳仪(美国Bio-Rad),Varioskan LUX多功能酶标仪、FRESCO 21高速低温离心机(美国Thermo Fisher),-80 ℃超低温冰箱(日本SANYO),光学显微镜(日本Nikon)。
1.1.4 主要实验试剂:水合氯醛、多聚甲醛(美国Sigma),放射免疫沉淀法(RIPA)裂解液、二喹啉甲酸 (BCA)蛋白定量试剂盒(上海碧云天),大鼠TNF-α、IL-6 ELISA试剂盒(武汉华美生物),SIRT1抗体、兔抗SIRT1抗体(美国Proteintech)。
1.2 实验方法 将60只大鼠随机分为对照组、假手术组、模型组、右美托咪定低剂量组、右美托咪定高剂量组,每组各12只。大鼠体重达到(270±20)g时造模干预处理。术前禁食12 h不禁水,使用10%水合氯醛,以0.5 ml/100 g剂量将对照组以外的大鼠进行麻醉。手术过程中及术后注意对大鼠进行保温,肛温在(37±1)℃。对照组常规饲养,不进行造模干预。假手术组:切开颈部正中处皮肤后,钝性分离皮下肌肉和主要血管,不进行模型制备,随后缝合皮肤。其余各组采用Longa线栓法制备大脑中动脉栓塞(Middle cerebral artery occlusion,MCAO)模型。
大鼠麻醉后仰卧位固定,术前对大鼠颈前部皮肤进行消毒,在颈正中线处做2 cm切口,钝性分离肌肉和筋膜,分离大鼠的右侧颈总动脉(CCA)、颈内动脉(ICA)和颈外动脉(ECA),在ECA、CCA近心端结扎,在CCA远心端处打活结,使用动脉夹暂时夹闭ICA,在CCA分叉5 mm处使用1 ml注射器针头扎一小孔,将线栓经此插入CCA后将远端活结拉紧以固定线栓,将线栓推入ICA后去除动脉夹,继续推送线栓至有阻力感时停止,提示线栓到达大脑中动脉(MCA)处,检查确认无活动性出血后,缝闭颈部皮肤,切口处消毒,大鼠单笼饲养。
血流栓塞共持续2 h,2 h后拔出线栓。在血流栓塞过程中,右美托咪定低剂量(25 μg/kg)、高剂量组(100 μg/kg)分别经腹腔注射右美托咪定,除对照组外,其余大鼠注射等量0.9%氯化钠溶液。
1.2.1 MACO大鼠模型制备成功判断标准:将大鼠尾部悬空提起,30 s内大鼠出现颈部转动>10°,左前肢肌张力下降、屈曲内收,或爬行时出现追尾现象,即可视为造模成功。造模不成功的大鼠予以剔除。
1.2.2 脑组织标本的收集:所有大鼠经10%水合氯醛,以0.3 ml/100 g剂量麻醉后,立即断头处死并剥离脑组织。在冰上将脑组织皮质缺血半暗带区域分离后,置于液氮中冷冻贮存备用。48 h后从液氮中取出样本,置于-80 ℃冰箱中。
1.2.3 RT-PCR法检测缺血脑组织SIRT1、NF-κB mRNA相对表达水平:使用Trizol法提取总RNA,称取0.01 g脑组织,剪碎后加入Trizol裂解液并研磨,使组织充分裂解。加入裂解液后于冰上裂解15 min,反复吹打使细胞脱落后,将裂解液转移至无酶EP管中。混匀静置后加入1/5体积氯仿,再次混匀后4 ℃、12000 r/min离心15 min。吸取上清,加入异丙醇混匀后室温静置10 min,随后于-20 ℃内静置1 h。弃去上清后加入75%乙醇,再次4 ℃、12000 r/min离心15 min后,除去乙醇。随后进行RNA定量,测定RNA浓度后进行逆转录合成cDNA。配置逆转录反应液,置于PCR仪中以37 ℃ 15 min -85 ~4 ℃ 10 min进行反应。随后进行PCR实验,95 ℃ 5 min,9 ℃ 30 s,60 ℃ 30 s,重复40次。以2-ΔΔCt法计算目的基因的表达量。引物设置如下:β-actin:上游:5’-CCCATCTATGAG-GGTTACGC-3’,下游:5’-TTTAATGTCACGCAC-GATTTC-3’;SIRT:上游:5’-TGTGTGTGGGTCTATG-CCTT-3’,下游:5’-CCTGCAATCCCAGGTACTTT-3’;NF-κB:上游:3’-CATCCACCATGGAAGACAAG-3’,下游:5’-CCAGCAGCATCTTCACATCT-3’。
1.2.4 Western blot法检测缺血脑组织SIRT1、NF-κB蛋白表达水平:取适量的脑组织剪碎后放入EP管,加入裂解液后于冰上进行匀浆,4 ℃、12000 r/min离心30 min,吸取上层清液后,依据BCA试剂盒操作说明进行蛋白浓度测定。将配置好的蛋白标准品和PBS加入细胞板并绘制标准曲线,使用PBS将待测蛋白样品稀释,与BCA工作溶液混合后37 ℃孵育30 min,酶标仪测定样品吸光度后绘制曲线测定蛋白浓度。蛋白变性后配置电泳凝胶,随后上样进行电泳,将3 μl预染蛋白Marker加入至孔道中,依次加入待测蛋白样本。待胶液面分离后调整电泳时间,直至marker分开。随后进行转膜,将目的蛋白转移至PVDF膜后,室温下使用5%脱脂奶粉封闭1.5~2.5 h。将PVDF膜在一抗抗体(1∶1000)及内参β-actin(1∶2000)抗体溶液中浸泡,4 ℃孵育过夜。次日TBST洗膜后将PVDF膜在二抗溶液中浸泡,室温下孵育1 h。TBST洗膜后,使用超敏发光液浸泡PVDF膜,使用化学发光成像系统进行显影,并计算目的蛋白的相对表达水平。
1.2.5 大鼠海马区炎性因子水平检测:选用酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)法测定大鼠海马组织中的TNF-α、IL-6水平。将大鼠脑组织中双侧海马仔细分离后,加入10倍的PBS溶液制成匀浆,4 ℃、5000 g离心5 min,取上层清液。将标准品加入96孔板前两列中,每孔100 μl。将其余各孔内加入100 μl待测样品,避光,37 ℃避光孵育90 min。加入100 μl抗体后,37 ℃孵育1 h,随后洗板3次,加入酶结合物100 μl,37 ℃孵育30 min,甩干后重复洗涤5次。加入90 μl显色底物,37 ℃孵育。加入终止液50 μl,使用酶标仪以波长450 nm处测量OD值,绘制标准曲线并计算测试样品中的TNF-α、IL-6水平。
1.2.6 缺血脑组织氧化应激水平检测:取各组大鼠缺血半暗带处脑组织制备匀浆,使用丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)试剂盒进行检测。依照操作说明书检测样本中SOD、MDA水平,使用酶标仪测定吸光度值后计算含量。
1.3 统计学方法 选择SPSS 25.0统计学软件对数据进行分析。计量资料以均数±标准差的形式表示,多组之间比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组大鼠缺血脑组织SIRT1、NF-κB mRNA 相对表达水平比较 结果表明,与对照组大鼠比较,Dex治疗组大鼠SIRT1 mRNA水平降低、NF-κB mRNA水平升高,经Dex治疗后两组大鼠的SIRT1 mRNA水平升高,且Dex高剂量组更高;同时NF-κB mRNA水平下降,且Dex高剂量组低于Dex低剂量组,差异具有统计学意义(均P<0.05)。见表1。
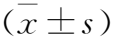
表1 各组大鼠缺血脑组织SIRT1、NF-κB mRNA 相对表达水平比较
2.2 各组大鼠缺血脑组织SIRT1、NF-κB 蛋白表达水平比较 结果表明,与对照组大鼠比较,Dex治疗组大鼠SIRT1 蛋白表达水平降低、NF-κB 蛋白水平升高,经Dex治疗后两组大鼠的SIRT1蛋白表达水平升高,且Dex高剂量组更高;同时NF-κB蛋白表达水平下降,且Dex高剂量组低于Dex低剂量组,差异具有统计学意义(均P<0.05)。见表2。
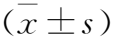
表2 各组大鼠缺血脑组织SIRT1、NF-κB蛋白相对表达水平比较
2.3 各组大鼠海马区炎性因子TNF-α、IL-6水平比较 结果表明,与对照组、假手术组大鼠比较,其余各组大鼠TNF-α、IL-6水平升高,经Dex治疗后两组大鼠的炎性因子水平降低,且Dex高剂量组TNF-α、IL-6水平低于Dex低剂量组,差异具有统计学意义(均P<0.05)。见表3。

表3 各组大鼠海马区炎性因子TNF-α、IL-6水平比较(pg/ml)
2.4 各组大鼠缺血脑组织MDA、SOD水平比较 结果表明,与对照组、假手术组大鼠比较,其余各组大鼠MDA水平升高、SOD水平下降,经Dex治疗后两组大鼠的MDA水平降低,Dex高剂量组更低,同时SOD水平升高,且Dex高剂量组更高,差异具有统计学意义(均P<0.05)。见表4。
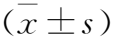
表4 各组大鼠缺血脑组织MDA、SOD水平比较
3 讨 论
脑卒中是引起患者死亡、致残的主要疾病之一,其中缺血性脑卒中的比例在八成以上[2,7-8]。脑缺血发生后,脑组织发生一系列复杂的炎性反应、氧化应激反应、细胞凋亡等,也是引起脑梗死患者运动、感觉、言语、认知等功能障碍的病理机制。右美托咪定作为常用的镇静剂,临床中常用于患者全麻插管时的麻醉及区域麻醉辅助镇静,能够有效安抚患者的焦虑情绪。近年研究发现,Dex对多种器官的缺血损伤均有较好的保护作用[9]。研究表明,Dex可以通过调控Nfr2/HO-1通路减轻心肌损伤[10-11],同时可以通过缓解线粒体功能障碍导致的氧化应激继而引起的脑组织受损。但针对Dex治疗脑梗死的机制尚未完全明确,仍需进一步探究。MCAO模型是常用的诱导脑组织缺血模型,其诱发脑梗死的成功率较高;还可以实现对脑内血流阻塞/再灌注的精准控制,且引起的脑组织梗塞的面积更大,病理改变更为明显[12]。但MCAO模型也有一定的局限性,插入的线栓仅能全部阻断或恢复脑组织血运,与真实的脑梗死患者复杂的脑损伤情况仍有差异。
脑缺血发生后,缺血缺氧损伤和再灌注损伤会引起一系列的炎性反应,炎性因子被释放至受损的脑组织部位,引起炎性浸润[13]。炎性因子的积累会进一步激活炎症相关通路,诱导更多炎性因子释放,进一步加重神经细胞凋亡[14]。因此,抑制炎性相关通路的激活可有效缓解脑梗死后的脑组织损伤程度。SIRT1/NF-κB是重要的炎性反应调控通路,SIRT1在脑组织中含量较高,对维持神经系统的生理功能和代谢发挥重要作用,且SIRT1具有较好的抗炎功能[15]。而NF-κB与细胞炎性损伤密切相关,它可以通过产生促炎性因子TNF-α、IL-6等,进而加重炎性反应水平[16-17]。TNF-α、IL-6作为人体常用的炎性反应标志物,其含量与炎性反应程度呈正相关[18-19]。研究证实,SIRT1对NF-κB为负性调节作用,当SIRT1水平升高时,可以有效抑制NF-κB的炎性作用,缓解神经细胞损伤程度。本研究中,经Dex治疗后,大鼠受损脑组织的SIRT1 mRNA和蛋白表达水平升高,NF-κB mRNA和蛋白表达水平以及海马区TNF-α、IL-6水平下降,提示Dex可有效的通过上调SIRT1、下调NF-κB水平及其下游炎性因子的表达,有效抑制炎性反应,继而发挥脑保护作用,且Dex高剂量组的治疗效果优于低剂量组。活性氧簇(Reactive oxygen species,ROS)是有氧代谢的产物,适量的ROS可以有效促进脑组织的功能发育,而过量的ROS堆积则会产生氧化应激损伤,与脑卒中和其他神经退行性疾病密切相关[20-22]。生理状态下,过量的ROS可被人体通过调节氧化还原和耗氧量而中和,当脑梗死发生后,ROS过量堆积无法清除,引起脂质和蛋白质过氧化,引起氧化应激反应,继而引起神经元凋亡和变性死亡,加重脑损伤。相关研究表明,SIRT1可以通过诱导NF-κB、FOX家族蛋白等途径,缓解衰老等疾病中的氧化应激反应水平,同时在动脉粥样硬化、痛风性骨关节炎等疾病中也可通过激活SIRT1相关通路继而缓解氧化应激[23-24]。SOD属于抗氧化酶系统,是缓解超氧化物引起的氧化应激反应的关键物质,MDA是脂质氧化的终产物,通过破坏细胞中的核酸、酶、细胞器或生物膜等引起氧化应激损伤,MDA的含量可以有效反映脑组织的脂质过氧化程度,间接提示了神经元损伤程度[25]。本研究中,经Dex治疗后,大鼠受损脑组织的SOD水平升高同时MDA水平下降,提示Dex可以有效改善受损脑组织的抗氧化应激能力,缓解氧化应激损伤,且Dex高剂量组的治疗效果优于低剂量组。
综上所述,右美托咪定可以有效缓解脑梗死发生后的脑组织损伤,发挥脑保护作用。其机制可能与激活SIRT1/NF-κB信号通路,进而减轻炎性反应、缓解氧化应激有关。

