川芎嗪调控Wnt/β-连环蛋白信号通路对冠心病大鼠心肌细胞凋亡的机制研究
朱 静,梁健球,刘宝骅
(佛山市第二人民医院心内科,广东 佛山 528000)
冠心病(Coronary heart disease,CHD)为一种临床常见心血管疾病,指冠状动脉狭窄、供血不足引起的心肌机能障碍和器质性病变,其发病机制较为复杂,临床症状主要表现为心绞痛、呼吸短促、胸部压迫等,近年来,CHD发病年龄趋于年轻化,发病率也呈明显上升趋势[1-2]。川芎嗪(Tetra methyl pyrazine,TMP)是一种提取自川芎的生物碱单体,化学结构为四甲基吡嗪,主要通过调节免疫/炎症反应、细胞凋亡信号通路调控、血液循环、细胞脂质代谢等途径发挥效用,临床用于心、脑血管等疾病的治疗已取得较好的疗效[3-5]。Wnt是富含半胱氨酸的糖基化蛋白,与细胞分化、增殖、胚胎发育及成体组织的自身稳定等有关,Wnt通路配体和相应的细胞膜受体相互结合,可触发至少三个不同的细胞内信号转导级联,包括:Wnt/β-连环蛋白(Wnt/β-catenin)、平面细胞极性通路、Wnt/Ca2+信号通路等[6-7]。心肌缺血、缺氧过程中心肌细胞伴随着病理性凋亡和不可逆坏死,而Wnt/β-catenin 信号通路活性变化与心肌损伤的病因、发病基础紧密相关[8-10]。基于此,本研究通过建立CHD大鼠模型,探讨川芎嗪对细胞凋亡及Wnt/β-catenin信号通路的影响,现报告如下。
1 材料与方法
1.1 实验动物 雄性SD大鼠50只,SPF级,体重180~200 g,购于西安交通大学实验动物中心,动物饲养条件:温度设定为20~23 ℃,湿度设定为60%~70%,明暗各12 h,正常饮水和摄食。
1.2 主要试剂和仪器 川芎嗪(上海信裕生物科技有限公司,货号:XY21436);苏木素-伊红染色(HE)试剂盒、TUNEL细胞凋亡检测试剂盒(上海抚生实业有限公司,货号:FS-10-17869、FS-79507);乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB) ELISA试剂盒(上海酶研生物科技有限公司,货号:EK-R38005、EK-R38852、EK-R37496)、RIPA蛋白裂解液、总RNA提取、Trizol试剂、BCA蛋白浓度测定试剂盒(上海联迈生物工程有限公司,货号:LM3201-1、LM-21087R、LM0016、LM0012S);反转录试剂盒(雅吉生物,货号:D1801XL);超声成像系统(美国Beckman公司);实时荧光定量PCR仪、光学显微镜(日本 Olympus公司);Model 680 酶标仪、电泳仪(美国 Bio-Rad公司);多功能凝胶成像系统(美国Syngene公司)。
1.3 动物模型的制备及分组给药 将50只SD大鼠按随机数字表法分为五组,对照组和模型组以及川芎嗪低、中、高剂量组,各10只。对照组予以基础饲料喂养6周。模型组、川芎嗪低剂量组、川芎嗪中剂量组、川芎嗪高剂量组参考文献[7]制备冠心病大鼠模型,高脂饲料连续喂养6周,同时以10 ml/kg脂肪乳剂灌胃,6周测定大鼠心电图,超声提示T波高耸、心律不齐、ST段抬高>0.1 mV即为造模成功。建模成功后川芎嗪低、中、高剂量组大鼠依次腹腔注射50、100、200 mg/kg川芎嗪,其余两组大鼠腹腔注射等体积生理盐水,五组均连续注射3周。
1.4 实验方法
1.4.1 心功能检测: 各组大鼠干预后用心脏彩色多普勒超声检测大鼠左心室射血分数(LVEF)、左心室收缩末期内径(LVESD)、左心室舒张末期内径(LVEDD)。
1.4.2 血清指标检测: 各组大鼠给药3周后,禁食12 h,腹腔注射30 mg/kg戊巴比妥钠麻醉,开腹取大鼠腹主动脉血,血液标本静置1 h后,行3000 r/min离心10 min,收集上清液保存于-70 ℃待测,酶联免疫吸附法(ELISA)检测血清LDH、CK、CK-MB水平。
1.4.3 HE染色:麻醉处死大鼠,摘除心脏,以4%多聚甲醛对部分心肌组织固定,依次进行脱水、透明、浸蜡、包埋、切片、脱蜡等步骤,行苏木素-伊红染色再封片(中性树胶),放于光学显微镜下观察心肌组织结构变化。
1.4.4 TUNEL检测心肌细胞凋亡:将心肌组织石蜡切片先脱蜡和水化,再用PBS缓冲液冲洗2次,蛋白酶K处理15 min,2% H2O2处理5 min,经PBS冲洗2次,加TUNEL反应液37 ℃避光30 min,PBS清洗3次后,DAB显色,苏木精复染后封片干燥,每张切片随机取5个视野,荧光显微镜下观察,阳性细胞为绿色。
1.4.5 RT-qPCR检测Wnt3a、β-catenin mRNA表达:取大鼠剩余心肌组织,研磨破碎,总RNA以Trizol法提取,并取2 μg RNA行逆转录后并扩增,引物序列:Wnt3a上游5’-CGGGTTCTTCTCTGGTCCTTG-3’,下游5’-CTGACAGTGGTGCAGTTCCA-3’;β-catenin上游5’-AAGTTCTTGGCTATTACGACA-3’,下游5’-ACAGCACCTTCAGCACTCT-3’;内参GAPDH上游5’-GACCACTTTGTCAAGCTCTATTTCC-3’,下游5’-GTGAGGGTCTCTCTTCCTCTTGT-3’,扩增于常规条件下展开,经40个循环后,利用凝胶成像仪获取图片,2-ΔΔCt对样本基因进行表达差异相对定量分析。
1.4.6 Western blot检测各组大鼠心肌组织中Wnt3a、β-catenin蛋白表达:取大鼠剩余心肌组织,加入裂解液,12000 r/min离心10 min 后取上清液,BCA检测蛋白浓度,加蛋白缓冲液使其变性,上样10 μg电泳,将电泳分离得到的样本,移到PVDF膜上固定,并封闭2 h(10%山羊血清),先一抗孵育过夜(4 ℃)后,加二抗(常温)孵育2 h,选GAPDH为内参,经洗膜、显色后,成像拍照后做灰度值统计分析。

2 结 果
2.1 各组大鼠心功能比较 模型组大鼠LVEF%低于对照组和川芎嗪低、中、高剂量组,LVESD、LVEDD高于对照组和川芎嗪低、中、高剂量组,差异有统计学意义(均P<0.05),见表1。
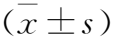
表1 各组大鼠心功能比较
2.2 各组大鼠血清LDH、CK、CK-MB水平比较 对照组血清LDH、CK、CK-MB水平低于模型组和川芎嗪低、中、高剂量组,模型组大鼠血清LDH、CK、CK-MB水平高于对照组和川芎嗪低、中、高剂量组,差异有统计学意义(均P<0.05),见表2。

表2 各组大鼠血清LDH、CK、CK-MB水平比较(U/L)
2.3 HE染色 对照组心肌细胞大小均等,心肌纤维无肿胀、排列紧密;模型组心肌纤维呈现明显肿胀、断裂,细胞排列无规则,并有大量炎症细胞浸润;川芎嗪低、中、高剂量组心肌损伤逐渐改善,细胞水肿变性减少,仅少量炎性细胞浸润。见图1。

图1 各组心肌细胞HE染色(HE染色,×400)
2.4 TUNEL检测心肌细胞凋亡 TUNEL检测结果显示,细胞凋亡显示绿色荧光,对照组心肌细胞凋亡较少,模型组心肌细胞凋亡率较川芎嗪低、中、高剂量组高,川芎嗪高剂量组细胞凋亡率低于模型组和低、中剂量组,差异有统计学意义(均P<0.05),见图2、3。
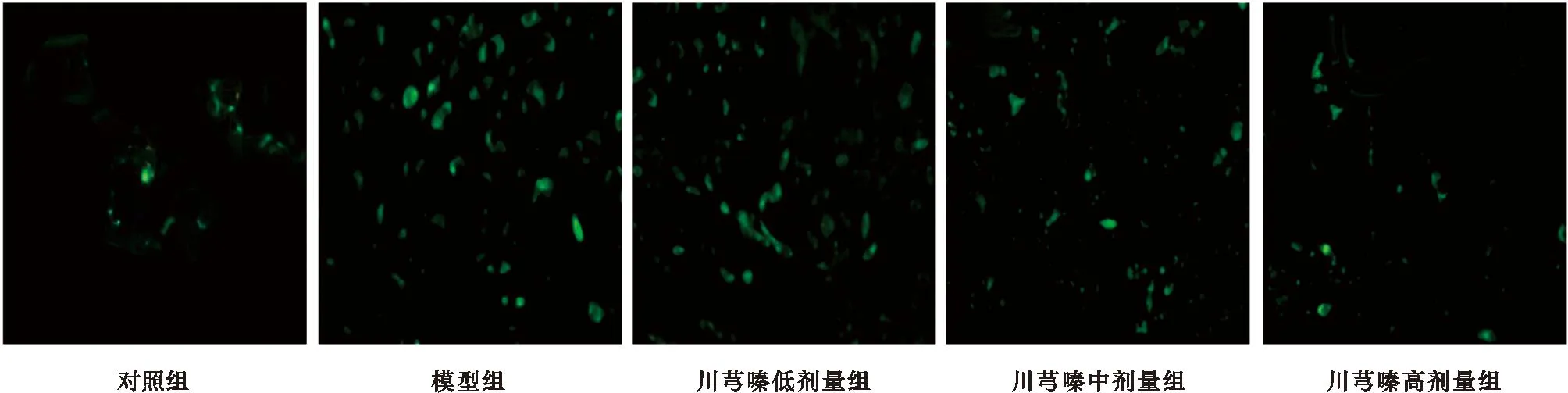
图2 各组心肌细胞凋亡检测结果(TUNEL染色,×400)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与川芎嗪低剂量组比较,△P<0.05;与川芎嗪中剂量组比较,▲P<0.05
2.5 RT-qPCR检测各组Wnt3a、β-catenin mRNA表达 qRT-PCR检测结果显示,模型组心肌组织中Wnt3a、β-catenin mRNA表达高于对照组,川芎嗪高剂量组心肌组织中Wnt3a、β-catenin mRNA表达低于低、中剂量组,比较差异有统计学意义(均P<0.05),见图4。
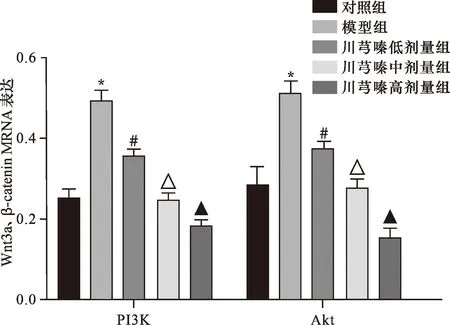
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与川芎嗪低剂量组比较,△P<0.05;与川芎嗪中剂量组比较,▲P<0.05
2.6 Western blot检测各组大鼠心肌组织中Wnt3a、β-catenin蛋白表达 Western blot检测结果显示,模型组心肌组织中Wnt3a、β-catenin 蛋白表达高于对照组,川芎嗪高组心肌组织中Wnt3a、β-catenin 蛋白表达低于低、中剂量组(均P<0.05),见图5。
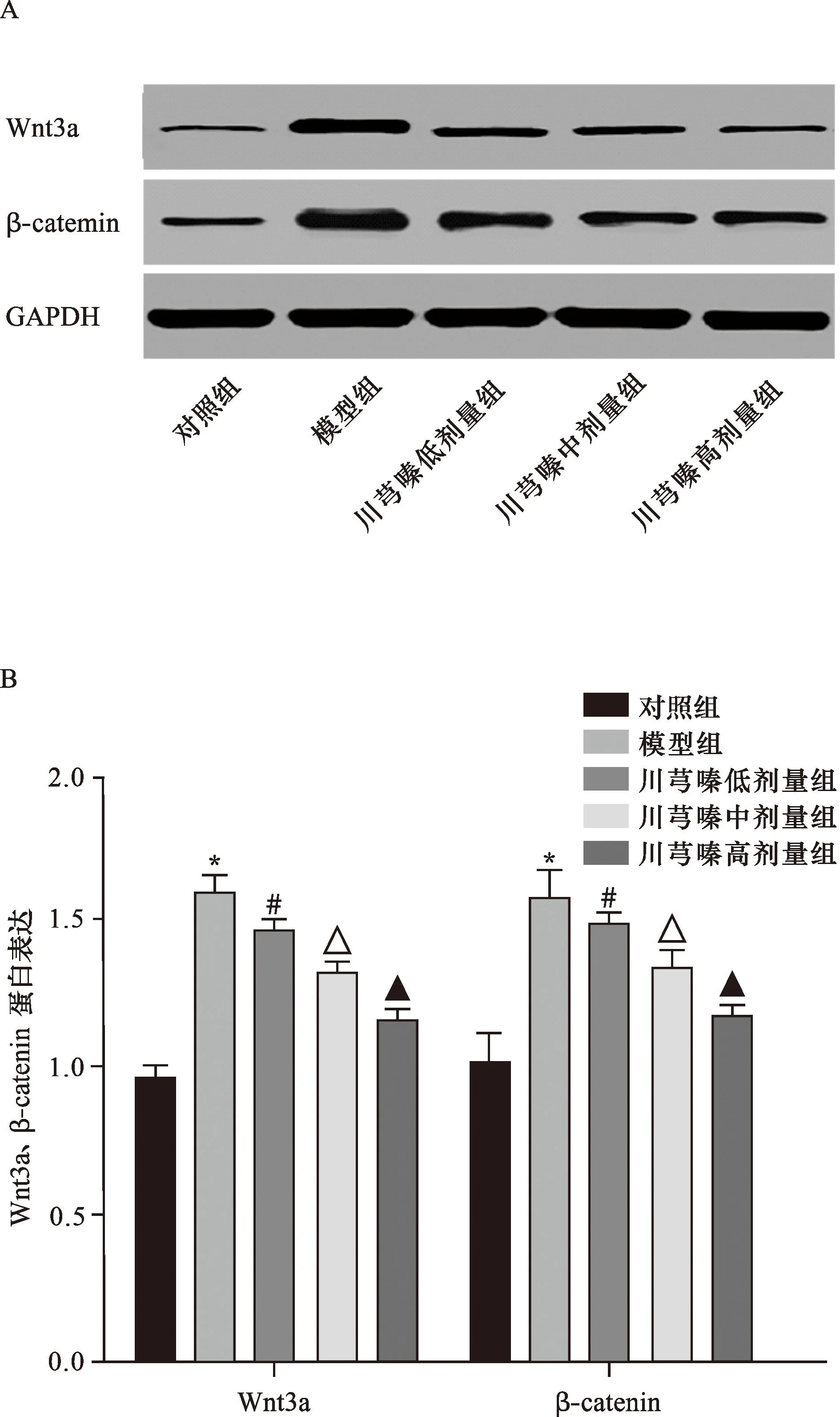
注:A图为心肌组织中Wnt3a、β-catenin蛋白表达;B图为心肌组织中Wnt3a、β-catenin蛋白表达比较与对照组比较,*P<0.05;与模型组比较,#P<0.05;与川芎嗪低剂量组比较,△P<0.05;与川芎嗪中剂量组比较,▲P<0.05
3 讨 论
冠心病为常见的缺血性心脏病,病理基础为动脉粥样硬化(AS),主要是血管内皮暴露在致病因素如高血糖、高血压、修饰脂蛋白等条件下,引起内皮细胞损伤和功能障碍、血管壁弹性减弱、炎症介质释放,血管平滑肌细胞增殖等情况,使得冠脉狭窄或阻塞,造成心肌缺血、缺氧或死亡,是造成心肌细胞死亡的主要形式之一[11-14]。
川芎嗪有广泛的药理活性,能通过减轻细胞内钙离子超载、解除血管平滑肌痉挛、清除氧自由基、促进心肌细胞能量代谢等途径扩张冠脉,增加冠脉血流量,改善心肌缺氧,保护心肌细胞及心肌缺血再灌注损伤,广泛应用于心脑血管疾病的治疗[15-17]。本研究通过高脂饮食联合脂肪乳剂灌胃建立CHD大鼠模型,并以川芎嗪干预发现,川芎嗪低、中、高剂量组治疗后大鼠心功能和心肌损伤均出现好转,川芎嗪低、中、高剂量组大鼠血清LDH、CK、CK-MB水平均下降,模型组大鼠LVEF%低于川芎嗪低、中、高剂量组,LVESD、LVEDD高于川芎嗪低、中、高剂量组,HE染色结果显示,心肌纤维呈现明显肿胀、断裂,细胞排列无规则,并有大量炎症细胞浸润,川芎嗪低、中、高剂量组心肌损伤逐渐改善,细胞水肿变性减少,仅少量炎性细胞浸润,川芎嗪高剂量组细胞凋亡率低于模型组和低、中剂量组,提示川芎嗪能缓解心肌损伤,改善心脏功能。心肌缺血及缺氧及坏死后,钙超载及自由基大量产生,引起了脂质过氧化反应,干扰多生物膜的结构及功能,使细胞内一系列酶与蛋白质进入全身血液循环中[18-20]。川芎嗪作用机理为川芎嗪能使内源性超氧化物歧化酶的活性提高,更为有效的清除氧自由基,减轻细胞内钙离子超载,缓解心肌细胞的损害,保证细胞膜的完整性,心肌细胞中酶分子的基处于还原状态,维持了酶的正常活性,LDH、CK、CK-MB水平下降[21-23]。刘英等[24]证实了,CHD大鼠经TMP和西药的灌胃后CK、CK-MB水平均下降。王显凤等[25]也发现,川芎嗪注射液通过激活Notch通路减少心肌细胞凋亡,并抑制氧化应激反应,改善心脏功能。
血管内皮的损伤和功能障碍是AS发生的始动环节,AS是CHD发生的病理基础,Wnt/β-catenin通路参与调控血管内皮细胞的功能发生和稳态维持[26-30]。在本研究中,模型组心肌组织中Wnt3a、β-catenin mRNA和蛋白表达低于正常组,川芎嗪高剂量组Wnt3a、β-catenin mRNA和蛋白表达高于低、中剂量组,初步说明川芎嗪可能通过抑制Wnt/β-catenin通路激活减轻心肌损伤,减少心肌细胞凋亡。谢骏等[31]证实,上调心肌缺血再灌注损伤模型大鼠CTRP9表达能进一步抑制心肌细胞的凋亡,使Wnt3a、β-catenin、p38MAPK下降,机制可能与调控Wnt/β-catenin通路有关。何佳等[32]发现,补肾活血复方组及赖诺普利组LVEDD、LVESD、Wnt3a、β-catenin蛋白及mRNA表达显著下调,可通过抑制Wnt信号通路抑制大鼠心肌损伤及细胞凋亡。马彦娟等[33]证实,miR-124-3p抑制剂可有效敲低模型心肌细胞中Wnt1与β-catenin的表达,减少心肌细胞的凋亡、细胞损伤及炎性因子的释放。以上结果说明Wnt/β-catenin信号通路参与CHD发生、发展[34-35]。
综上所述,川芎嗪能改善大鼠心肌细胞的凋亡,减轻细胞损伤,其机制可能与调节Wnt/β-catenin信号通路相关蛋白表达有关。

