肝脏原发及转移性神经内分泌肿瘤36例临床病理分析
黄 晶,付 莉,苗 娜
(新疆医科大学第一附属医院病理科,新疆 乌鲁木齐 830054)
肝脏神经内分泌肿瘤(Hepatic neuroendocrine neoplasm,HNEN)较为少见,多数患者因临床表现无特异性,仅在体检时发现,而导致就医较晚,其诊断须有助于组织形态学、免疫表型及临床相关影像学检查。因此正确地诊断本病尤为重要[1-2]。本文通总结新疆医科大学第一附属医院经手术切除、病理确诊的36例HNEN进行回顾性分析,并结合相关文献分析探讨该病变的病理诊断、免疫组化特征及其鉴别诊断。
1 资料与方法
1.1 一般资料 收集肝脏原发性(Primary hepatic neuroendocrine neoplasm,PHNEN)及转移性神经内分泌肿瘤(Metastatic hepatic neuroendocrine neoplasm,MHNEN)共36例,每一例均按消化系统肿瘤WHO分类(2019)神经内分泌肿瘤分级标准,分别由两位资深病理医师复检后确诊分为神经内分泌瘤(Neuroendocrine tumor,NET)G1、G2、G3和神经内分泌癌(Neuroendocrine carcinoma,NEC)。其中男26例,女10例;年龄40~70岁,平均(48.1±10.2)岁;汉族12例,少数民族24例。该病变临床表现无特异性,同肝脏部位其他肿瘤所致的一些占位性症状,如腹部不适、食欲减退、精神不振、体重下降等,通常为体检发现。血清中甲胎蛋白(AFP)、癌胚抗原(CEA)、细胞表面糖蛋白(CA199)等肿瘤标志物几乎无诊断价值。
1.2 研究方法 标本均经4%中性甲醛固定,石蜡包埋,3~5 μm厚切片,HE染色和免疫组化染色,免疫组化染色步骤严格按照试剂盒说明书执行。细胞角蛋白AE1/AE3(RM341)、嗜铬素A CgA(LK2H10)、突触素Syn(EP158)、神经细胞黏附分子CD56(UMAB83)、钙离子结合蛋白S-100(15E2E2)、细胞增殖核抗原Ki-67(UMAB107)、肝细胞特异性标志物Hepa(OCH1E5)、急性淋巴母细胞性白血病抗原CD10(UMAB83235)、生长刺激信号通路相关调节蛋白β-catenin(EP35)。
1.3 病理分级和分期及PHNEN纳入标准 通过分析核分裂数/2 mm2(相当于40倍放大或者直径为0.5mm视野的10个高倍视野),通过在50个0.2 mm2(即总面积为10 mm2)的视野中计数来确定;Ki-67增殖指数值通过在最高标记区域(热点区域)中计数至少500个细胞来确定,最终分级是根据两个指标中的任何一个将肿瘤置于更高级别的类别来进行分类(表1);PHNEN纳入标准:①术后病理诊断结果为NEN;②排除其他部位肿瘤转移;③除外原发性肝癌、混合型肝癌、肝门部胆管肿瘤;④具有完整的临床资料[3]。

表1 消化系统神经内分泌肿瘤分级及分期
2 结 果
2.1 影像学检查:超声、CT结果 分别行超声和或CT检查,显示肝脏体积增大,形态失常,包膜不光滑,有的肝内可见多个高低回声病灶,8例可见多个结节,界不清,不规则,回声不均匀,10例可见结节呈囊实性(图1)。
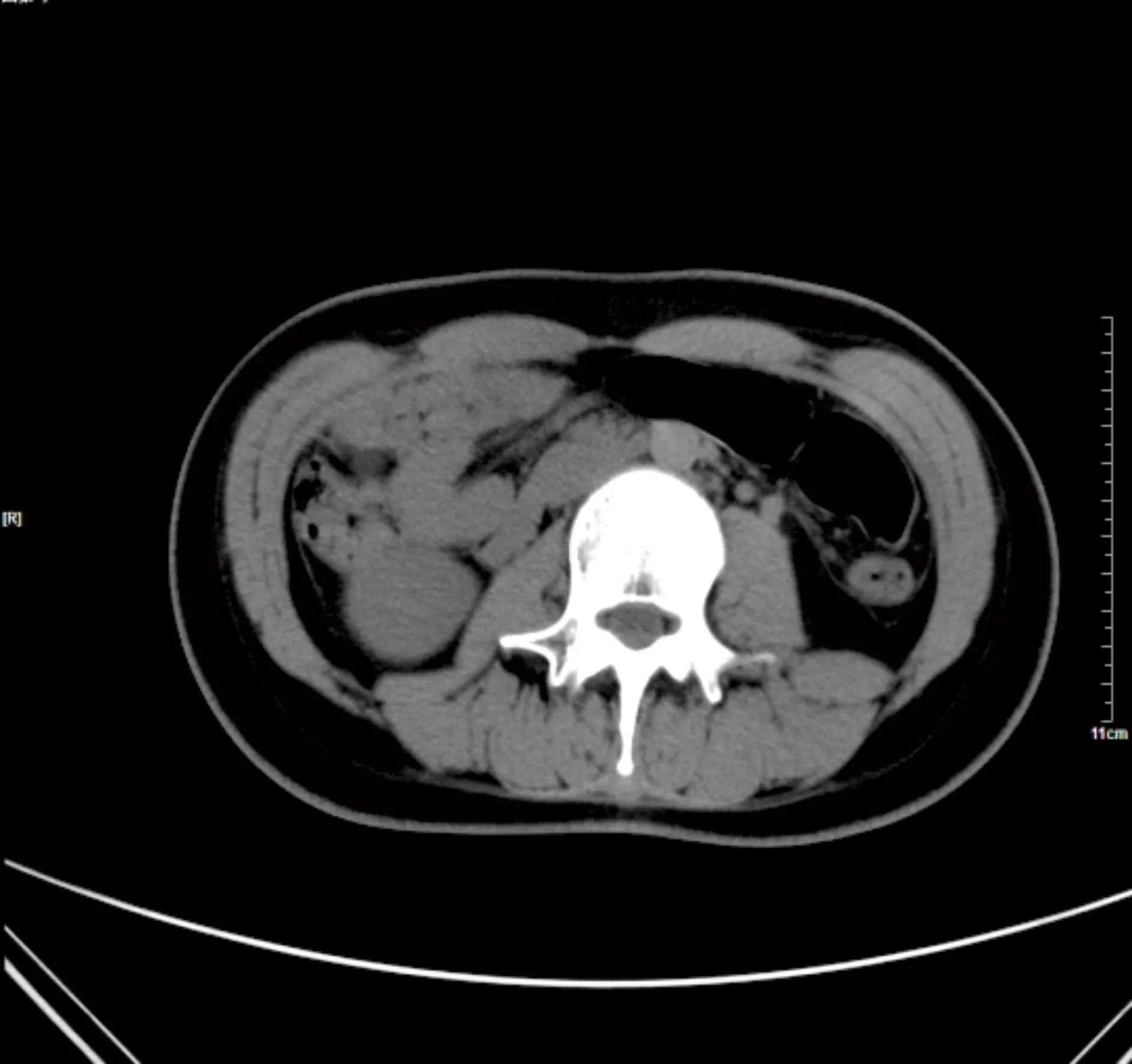
图1 增强扫描实性部分强化,病灶边界清楚
2.2 组织病理结果
2.2.1 手术及大体所见:手术及大体:其中20例位于肝右叶,16例位于肝左叶;多发肿瘤8例,均为多枚结节,分别位于肝左右叶,肿块直径1.7~13.0 cm,切面多为灰黄、灰褐、暗红色,质韧;肿物呈类圆形或不规则形,肝内病灶呈多灶点灶状分布,界不清。
2.2.2 镜检: 肿瘤细胞排列呈下述结构:27例病例中出现巢团状、岛屿状,小梁或条索状结构不等分布,9例呈腺泡状、器官样排列,肿瘤细胞巢中央细胞多形性,周围排列较规整,似有基底样细胞围绕,1例呈管状结构。肿瘤分化较差区域可为实性、片状、筛状生长,细胞多形性明显,核分裂像易见,细胞胞质较少,偏嗜碱,染色质较细腻,似椒盐样(图2)。
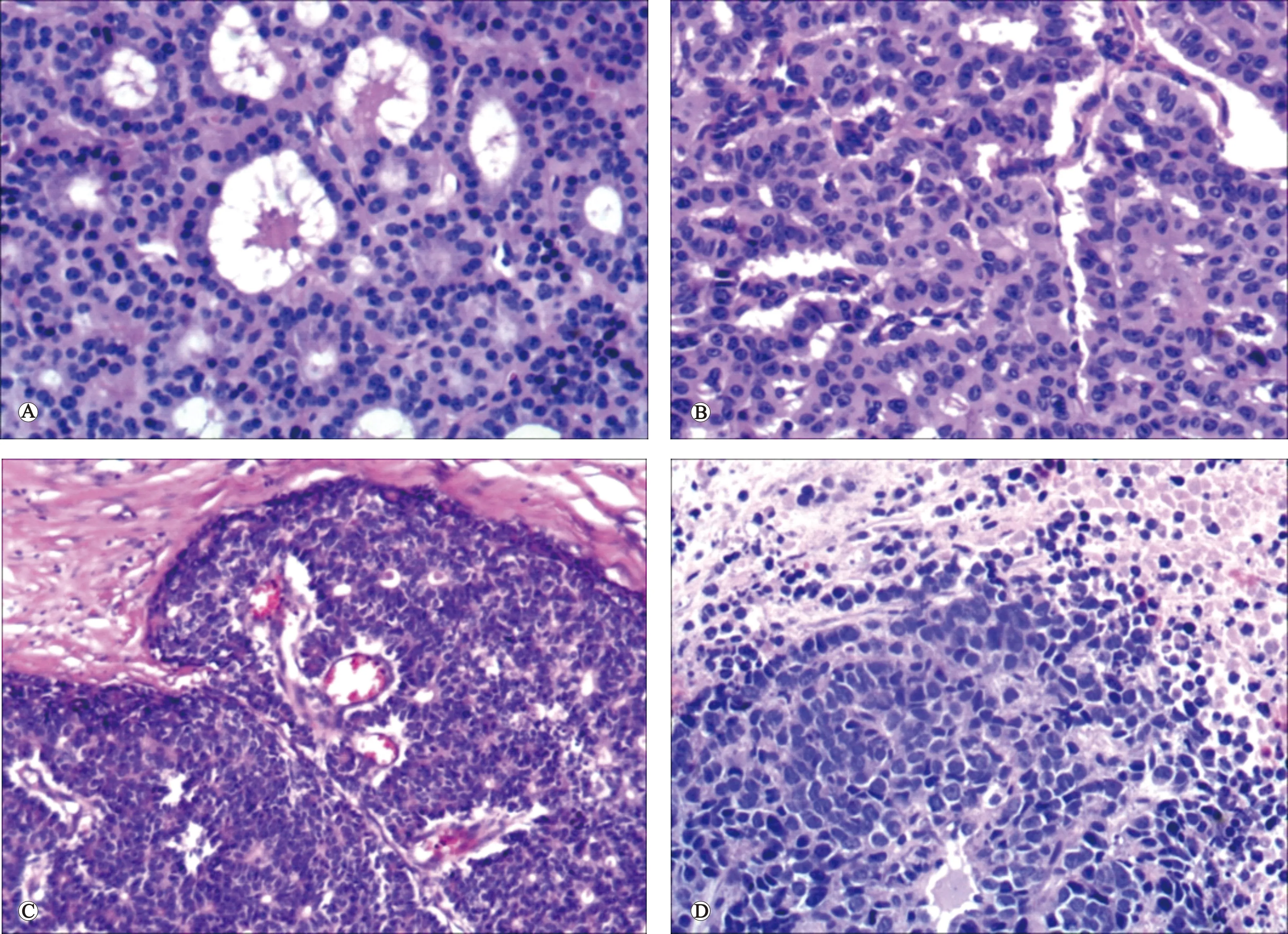
图2 G1(A)、G2(B)、G3(C)及NEC(D)肿瘤细胞巢团状、岛屿状器官样结构(HE染色,×400)
2.3 免疫组织化学结果 AE1/AE3阳性,肿瘤细胞强阳性表达CD56、Syn、CgA(点状+),周围基底样细胞S-100阳性、Ki-67依肿瘤分级不同(分布于2%~80%不等),Hepa、CD10、β-catenin均为阴性(图3、4)。
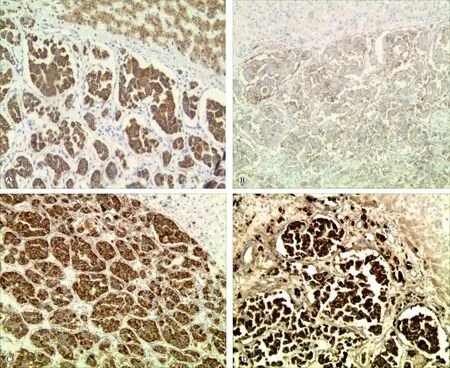
图3 G2肿瘤细胞AE1/AE3(A)、CD56(B)、 Syn(C)、CgA(D)阳性表达(SP染色,×400)

图4 G1(A)、G2(B)、G3(C)及NEC(D)对应Ki67表达(SP染色,×400)
2.4 治疗和随访 本组36例患者中,28例肿瘤全切,8例为肝脏活检穿刺术。25例获得随访结果,转移性肿瘤22 例,原发性3例,平均随访时间1~72个月。NET(G1,G2)组平均存活时间较NEC组显著延长。同时,PHNEN总体生存期较长,预后较好,1例G1患者随访期间预后良好,无复发倾向,22例MHNEN中死亡 10 例,生存12例,中位生存期 32个月;MHNEN中,起源于胃肠胰腺组织15例,支气管及肺组织6例,胆囊原发1例。
3 讨 论
神经内分泌肿瘤(Neuroendocrine neoplasm,NEN)包括一组异质性肿瘤,它们表现出不同的临床行为。这些肿瘤概括了各种神经内分泌细胞类型,并经常根据它们的起源位置,即前肠(支气管、胃、十二指肠、胰腺)、中肠(小肠、阑尾、结肠近端)或后肠(结肠远端和直肠远端)。最近对监测、流行病学和最终结果数据库的分析显示,NEN肝转移的患病率在27%~60%之间[4-9]。
按消化系统NEN WHO分类(2010) NEN分级标准,分为NET G1、NET G2及NEC。而按2019版消化系统NEN WHO分类解读:大多数分为4类组织学类别:低级别、高分化的NET(G1);中等级别、高分化程度的NET(G2);高级别、高分化程度的NET(G3);高级别、低分化的NEC。分级一般由有丝分裂计数和Ki-67指数来定义,如果存在不一致,则采用较高的分级来进行分类。大多数NETs是典型的G1或G2,而NET G3是罕见的,并表现为攻击性行为[10-12]。
神经内分泌细胞广泛分布于全身。NEN定义为具有主要神经内分泌分化作用的上皮肿瘤,可出现在大多数器官中。NEN是一种少见的肝脏肿瘤 ,中年人多见,平均年龄40岁左右,无明显性别差异,肝左右叶均可发病,左叶较多见,早期诊断临床症状无特异性,早期诊断困难。
PHNEN是一种罕见的肝脏肿瘤 ,本组病例中年人多见,平均年龄40岁左右,无明显性别差异,肝左右叶均可发病,左叶较多见,早期诊断临床症状无特异性,早期诊断较困难。最近对监测、流行病学和最终结果的分析数据库报道,NETS的发病率最高的是肺部,其次是小肠,直肠,胰腺。NET肝转移(Netlm)的患病率范围在27%~60%之间,约有12%~74%的患者表现为肝诊断时转移[13],因此对于PHNET我们需排除其他部位转移性肿瘤,排除肝脏原发肝细胞肝癌以及胆管细胞癌等之后,再结合肿瘤的组织学形态及相关免疫组化表达情况方可给予诊断,但仍需要结合临床相关信息,并对患者远期随访观察有无全是其他部位肿瘤原发可能。
HNEN应与以下肿瘤鉴别:①肝细胞肝癌:肝细胞癌是一种异质性肿瘤,在世界范围内发病率不断增加[14-16]。作为一种常见的恶性肿瘤,许多因素已被证实参与了其发展,如病毒感染和肝硬化[17]。癌细胞呈多角形,核大,核仁明显,胞质丰富,癌细胞也排列成小梁状、巢状、索状或假腺样,可表现为不同程度的异型性。但CK广泛存在于正常上皮细胞和上皮癌细胞中,癌巢之间有丰富的血窦,癌细胞有向血窦内生长趋势,免疫组化CD34染色可以显示肝板结构及肝窦毛细血管,S-100、Syn、NSE、CgA、CD56在肝癌中几乎不表达。②肝局灶性结节性增生 (Focal nodular hyperplasia,FNH): FNH是第二大肝脏常见的良性肿瘤,多见于30~40岁的。激素在FNH发育中的作用是由其高女性优势(女性与男性比例为9∶1)和口服避孕药的高流行率支持的。没有证据表明FNH,发生恶性转化。大多数FNH患者无症状。只有少数FNH较大的患者由于对邻近器官,的压力作用而出现腹痛或不适等症状。破裂、坏死或出血是特殊的[18-20]。FNH无特异性临床表现,影像学难以鉴别肝细胞肝癌和肝脏其他恶性肿瘤,但肝脏局灶性结节性增生AFP、CEA、CA199等肿瘤标志物及Syn、NSE、CgA、CD56均为阴性[21]。③肝脏其他转移性肿瘤:结直肠癌常转移至肝脏,形态学分化较差,有神经内分泌分化方向时需要鉴别,但转移性结直肠癌神经内分泌标记常不会弥漫阳性表达,常表达肠源性常见标记物,且血清CEA的检测在结直肠癌的肿瘤分期、肿瘤病理类型、有无肝转移以及预后的预测上有一定的临床意义[22]。
大量的NET患者发生肝转移,并显著恶化预后。目前的治疗算法包括各种手术和非手术方式。对于原发肿瘤的患者,根据肿瘤负荷、症状、患者共病和肿瘤分级,手术探查并切除并尝试将细胞降低到≥70%~90%是一种合理的方法。手术治疗可以根据疾病的分布包括主要的切除,但实质保留手术,如楔形切除、眼球摘除和消融正在获得青睐,并产生类似的结果。肝脏导向治疗在缓解症状和减缓病情进展方面也发挥着重要作用,特别是当肿瘤不能接受手术细胞减少时。全身治疗方案显示无进展生存期(PFS)有适度的改善,但总生存期(OS)没有改善。
到目前为止,手术切除仍然是主要的治疗方法,PHNEN被认为是一种缓慢生长的类型低恶性肿瘤。对于MHNEN,应尽可能寻找原发灶并切除能缓解症状。不可切除或复发患者,经导管动脉化疗栓塞(TACE)和全身化疗被认为是主要的治疗方法,但治疗效果有待进一步临床试验研究[23-25]。

