术前铁蛋白/白蛋白表达对胸段食管癌胸腔镜术后并发胃排空障碍的预测
吕明闯
(南阳市第二人民医院 胸外科,河南 南阳 473000)
目前,胸腔镜手术广泛应用于胸段食管癌患者中,具有创伤小、恢复快、视野清晰的特点,可彻底切除病灶,且对患者肺功能影响较小[1]。但仍有部分患者于术后早期并发胃排空障碍,导致大量胃内容物潴留,出现恶心、呕吐、胸闷等症状,影响患者术后生活质量,延长术后恢复时间,增加经济负担。因此,寻找可预测胸段食管癌患者胸腔镜术后并发胃排空障碍的指标并及时进行干预,对于改善患者预后情况具有重要意义。铁蛋白(ferritin,FERR)是维持机体健康必不可少的可溶组织蛋白,可为机体储存必需的铁元素。有研究指出,食管癌患者血清FERR水平高于健康人群,推测FERR参与了食管癌的进展,或可影响术后并发症的发生与发展[2]。白蛋白(albumin,ALB)由肝实质细胞合成,是一种重要的小分子蛋白,可维持机体营养和渗透压,其水平降低预示机体营养状态较差,或可影响胃肠功能,从而引起胃排空障碍[3]。而FERR/ALB的表达可综合评估胸段食管癌患者的病情及营养状态,推测其表达情况可预测术后胃排空障碍的发生。基于此,本研究分析了术前FERR/ALB表达对胸段食管癌胸腔镜术后并发胃排空障碍的预测价值。
1 资料与方法
1.1 一般资料
前瞻性纳入南阳市第二人民医院2020年11月至2022年11月收治的胸段食管癌患者,本研究方案经医院医学伦理委员会批准。(1)纳入标准:符合《内科学》[4]中相关食管癌诊断标准,肿瘤部位为胸段,且经影像学、病理学检查确诊;根据《实用肿瘤内科治疗》[5],食管癌TNM分期为Ⅰ期和Ⅱ期;符合胸腔镜手术适应证;患者对本研究内容知情并签署同意书。(2)排除标准:心、肺功能差;合并其他重要器官严重疾病;不能耐受手术;合并其他恶性肿瘤;合并严重精神疾病;合并严重感染。(3)剔除标准:研究过程中因各种原因转院;研究过程中失访;主动退出研究。纳入120例胸段食管癌患者,其中男73例,女47例;年龄43~69岁,平均(58.63±4.63)岁;TNM分期Ⅰ期52例,Ⅱ期68例;体重指数16.9~27.0 kg·m-2,平均(21.76±2.20)kg·m-2;病理分型鳞状细胞癌67例,腺癌42例,其他11例。
1.2 方法
1.2.1基线资料收集
设计基线资料调查表,于患者入院时对基线资料进行详细调查和统计,包括:性别(男、女)、年龄、体重指数、手术时间、TNM分期(Ⅰ期、Ⅱ期)、病理分型(鳞状细胞癌、腺癌、其他)、吸烟(是、否)、饮酒(是、否)、肿瘤家族病史(有、无)、合并糖尿病(是、否)。
1.2.2手术方法
所有患者均在胸腔镜下行根治术治疗,步骤如下:常规消毒铺巾,患者取左侧卧位,全身麻醉,双腔支气管插管;右胸做4~5个1.5 cm小切口,置入器械;充分显露后纵隔,游离食管下段,继续向上分离食管上段至胸廓入口;游离全胸段食管后,清扫各组淋巴结。
1.2.3检测FERR、ALB水平
于术前1 d,抽取患者空腹静脉血5 mL,离心处理10 min,离心半径10 cm,3 500 r·min-1,取上清液,采用荧光免疫层析法检测血清FERR水平,试剂盒购自湖南圣辉生物科技有限公司;采用免疫投射比浊法检测血清ALB水平,试剂盒购自潍坊三维生物工程集团有限公司,并计算FERR/ALB。
1.2.4胃排空障碍判定
记录术后14 d内胃排空障碍发生情况,根据术后停止胃肠减压、拔除胃管进流食或由流食改为半流食后逐渐出现腹胀症状,随之发生溢出性呕吐,置入胃管减压可吸出大量液体同时症状缓解;X线检查可发现胃饱满、扩张,无收缩和蠕动功能,胃黏膜粗大、水肿。将符合上述标准的患者判定为术后并发胃排空障碍,并纳入发生组,其余患者纳入未发生组。
1.3 统计学方法
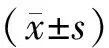
2 结果
2.1 术后并发胃排空障碍情况
胸腔镜术后14 d内,120例胸段食管癌患者中10例(8.33%)并发胃排空障碍,纳入发生组,其余纳入未发生组。
2.2 两组基线资料
发生组合并糖尿病占比高于未发生组(P<0.05),两组性别、年龄、体重指数、手术时长、TNM分期、病理分型、吸烟、饮酒、肿瘤家族病史比较,差异无统计学意义(P>0.05)。见表1。

表1 两组基线资料比较
2.3 FERR、ALB水平
发生组FERR水平、FERR/ALB高于未发生组,ALB水平低于未发生组,差异有统计学意义(P<0.05)。见表2。

表2 两组术前FERR、ALB水平比较
2.4 术前FERR、ALB及FERR/ALB表达对胸段食管癌胸腔镜术后并发胃排空障碍的预测价值
将胸段食管癌胸腔镜术后并发胃排空障碍情况作为状态变量(发生=1,未发生=0),将FERR、ALB及FERR/ALB表达作为检验变量;绘制ROC曲线,结果显示,FERR、ALB及FERR/ALB表达预测胸段食管癌胸腔镜术后并发胃排空障碍的AUC>0.70,具有一定预测价值。见表3。

表3 术前FERR、ALB及FERR/ALB表达对胸段食管癌胸腔镜术后并发胃排空障碍的预测价值
3 讨论
胸段食管癌胸腔镜术后并发胃排空障碍可加重患者心理负担,还可增加其他并发症的发生风险,影响患者病情康复。因此,寻找与胃排空障碍发生有关的指标对于临床及时预测并进行干预尤为重要。有研究指出,FERR表达升高与多种恶性肿瘤疾病有关,且其可一定程度反映机体炎症状态,而炎症反应可对胃肠功能产生影响[6]。由此,推测FERR可能与胃排空障碍有一定联系。ALB是反映机体营养状态的指标,且研究表明,营养不足可影响胃肠功能,ALB或可与胃排空障碍的发生相关[7]。但单项指标预测疾病的发生具有局限性,因此本研究分析FERR/ALB表达预测胸段食管癌胸腔镜术后并发胃排空障碍的预测价值。
本研究结果显示,FERR、ALB及FERR/ALB表达预测胸段食管癌胸腔镜术后并发胃排空障碍的AUC>0.70,表明FERR、ALB及FERR/ALB表达对术后并发胃排空障碍具有一定预测价值。分析原因,胸腔镜手术可破坏胸段食管癌患者的消化道内环境,使其发生改变、紊乱,导致胃蠕动节律失常,收缩能力减弱,引起胃排空障碍。FERR可反映机体炎症状态,术前FERR高表达提示患者机体可能存在炎症反应,而炎症反应可使手术对消化道内环境的影响加重,从而延缓胃排空时间,极大增加胃排空障碍的发生风险[8]。同时,FERR也可反映机体免疫状态,水平高提示患者免疫功能下降,从而影响胃肠功能,可能导致胃收缩、舒张功能发生障碍,进而增加并发胃排空障碍的发生风险[9]。术前ALB水平较低提示患者营养状态较差,而胃肠功能需要充足的营养支持才能正常运作,营养不足可影响乙酰胆碱的合成,使水解加速,进而影响神经传导,导致胃动力不足[10];且胸腔镜手术可通过多种途径激活交感神经系统,使患者胃肠交感神经抑制性活动增强,而此时患者营养状态不佳,大大增加了胃排空障碍的发生风险。同时,营养水平低可影响消化腺分泌消化酶,导致胸段食管癌胸腔镜术后肠壁韧带松弛,胃肠蠕动减慢,且可使胃肠细胞的更新速度减慢,从而影响胃动力,引发胃排空障碍[11]。此外,术前ALB水平较低可导致胸段食管癌患者术后吻合口愈合困难甚至发生水肿,极易引发胃肠运动功能障碍及麻痹,使胃排空延迟。FERR/ALB表达的升高提示患者FERR水平异常升高和(或)ALB水平异常降低,极易导致胃排空障碍的发生。因此,临床可通过术前检测FERR/ALB水平预测术后发生胃排空障碍的风险。
本研究还发现,糖尿病与胸段食管癌胸腔镜术后并发胃排空障碍有具有一定关系,分析原因在于,较高的血糖水平可影响胃抑制和胃兴奋性迷走神经回路中葡萄糖刺激或葡萄糖抑制的神经元,从而导致胃排空发生改变,引发胃排空障碍[12]。同时糖尿病患者幽门松弛和窦十二指肠的收缩力较弱,协调性较差,可引起胃动力不足,使胃的固体和液体排空速度减慢,从而引起胃排空障碍[13]。
4 结论
FERR、ALB及FERR/ALB表达对胸段食管癌胸腔镜术后并发胃排空障碍具有一定预测价值,FERR/ALB的预测价值最高,FERR/ALB表达越高,术后并发胃排空障碍的风险越大。

