西妥昔单抗联合FOLFIRI 方案对结肠癌患者炎性因子、免疫功能及预后的影响△
王高波,杨洋#,王佳,孙兴伟
1宝鸡市人民医院结直肠肛门外科,陕西宝鸡 721000
2西安市中医医院结直肠肛门外科,西安 710021
结肠癌是中老年人群较为常见的恶性肿瘤,早期患者无明显临床症状,部分患者进展至中晚期可出现不同程度的腹痛、腹泻、血便等症状[1-2]。虽然开腹手术是治疗结肠癌较为常用的治疗方法,但由于手术创伤较大,易出现疼痛诱发炎症反应及机体免疫功能损伤问题。此外,对于易转移的晚期结肠癌,单纯手术疗效不明显,治疗后生存率较低,预后不理想。伊立替康+亚叶酸钙+5-氟尿嘧啶(FOLFIRI)方案主要用于晚期结直肠癌患者,该方案是治疗晚期结直肠癌的标准化疗方案,但由于药物疗效的限制,难以进一步提高临床疗效[3-4]。近年来,靶向药物逐渐在晚期结直肠癌患者中应用,相关研究显示,西妥昔单抗能够作用于表皮生长因子,在缓解结肠癌患者相关症状及延缓肿瘤进展方面具有较高的优势,可以有效控制Kirsten鼠类肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)野生型患者的疾病进展,从而达到更好的治疗效果[5-6]。鉴于此,本研究探讨西妥昔单抗联合FOLFIRI 方案对结肠癌患者炎性因子、免疫功能及预后的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2018 年3 月至2020 年3 月宝鸡市人民医院收治的结肠癌患者。纳入标准:①经病理检查确诊为结肠癌,且KRAS基因为野生型;②对治疗药物无过敏;③无化疗禁忌证;④肝肾功能正常。排除标准:①既往接受手术治疗;②临床资料、实验室资料、随访资料不完整;③存在免疫缺陷。依据纳入和排除标准,本研究共纳入84 例结肠癌患者,根据化疗方案的不同分为对照组(n=41)和观察组(n=43),对照组患者给予FOLFIRI 方案化疗,观察组患者给予西妥昔单抗联合FOLFIRI 方案治疗。对照组中,男22 例,女19 例;年龄58~79 岁,平均(64.28±3.57)岁。观察组中,男23 例,女20 例;年龄57~79 岁,平均(64.39±3.59)岁。两组患者性别、年龄比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 治疗方法
对照组患者给予FOLFIRI 方案化疗,用药前30 min 常规给予硫酸阿托品0.5 mg 皮下注射,第1天,伊立替康180 mg/m2静脉滴注100 min,亚叶酸钙200 mg/m2静脉滴注2 h,5-氟尿嘧啶400 mg/m2静脉滴注,若无不适症状,46 h 内给予5-氟尿嘧啶2400 mg/m2泵注,14 天为1 个治疗周期。
观察组患者给予西妥昔单抗联合FOLFIRI 方案化疗,西妥昔单抗在FOLFIRI 方案化疗前给药,给药前30 min 常规给予西咪替丁0.4 g 静脉滴注、苯海拉明20 mg肌内注射、地塞米松5~10 mg静脉滴注。西妥昔单抗500 mg/m2持续静脉滴注120 min,间隔2 h 后给予FOLFIRI 方案化疗,FOLFIRI 用药方案与对照组一致。
1.3 观察指标
①治疗前后,抽取两组患者晨起空腹外周静脉血8 ml置于干燥的抗凝管中,3000 r/min离心10 min后,收集上层血清,采用酶联免疫吸附法检测两组患者的炎性因子水平,包括白细胞介素(interleukin,IL)-4、IL-8、C 反应蛋白(C-reactive protein,CRP)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)。②血清制备方法同①,采用流式细胞仪检测两组患者的外周血T 淋巴细胞亚群水平,包括CD3+、CD4+、CD8+,计算CD4+/CD8+。③比较两组患者治疗期间的不良反应发生情况,包括神经毒性、白细胞减少、恶心呕吐、手足综合征、肝功能损伤。④采用电话随访或门诊复查的方法对两组患者进行为期2 年的随访,随访时间截至2022 年3月,比较两组患者的生存率。
1.4 统计学方法
采用SPSS 21.0 软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 炎性因子水平的比较
治疗前,两组患者IL-4、IL-8、CRP、TNF-α水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者IL-4、IL-8、CRP、TNF-α水平均低于本组治疗前,且观察组患者IL-4、IL-8、CRP、TNF-α水平均低于对照组,差异均有统计学意义(P<0.05)。(表1)
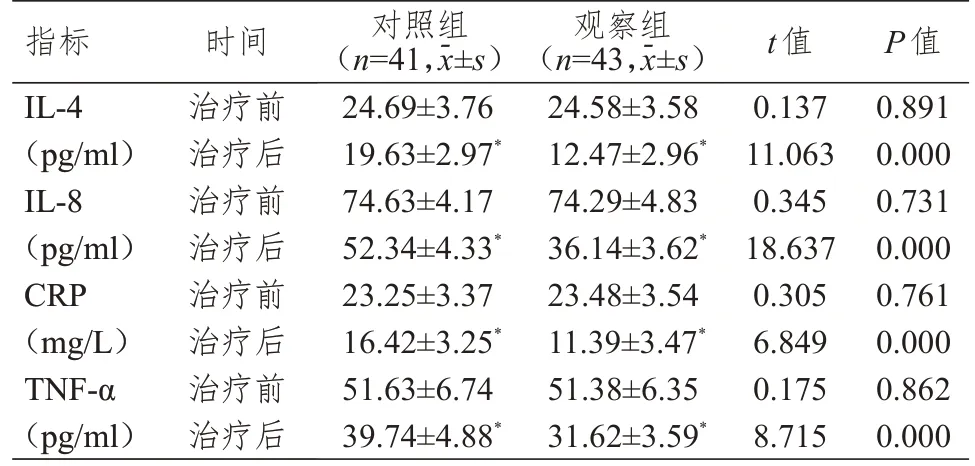
表1 治疗前后两组患者细胞因子水平的比较
2.2 T 淋巴细胞亚群水平的比较
治疗前,两组患者CD3+、CD4+、CD8+水平和CD4+/CD8+比较,差异均无统计学意义(P>0.05)。治疗后,两组患者CD3+、CD4+水平和CD4+/CD8+均高于本组治疗前,CD8+水平均低于本组治疗前,且观察组患者CD3+、CD4+水平和CD4+/CD8+均高于对照组,CD8+水平低于对照组,差异均有统计学意义(P<0.05)。(表2)
2.3 不良反应发生情况的比较
对照组患者的不良反应总发生率为63.41%(26/41),与观察组患者的69.77%(30/43)比较,差异无统计学意义(χ2=0.381,P=0.537)。(表3)
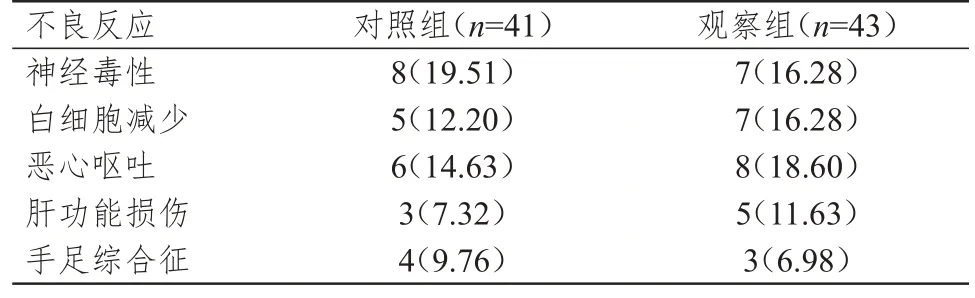
表3 两组患者治疗期间的不良反应发生情况[n(%)]
2.4 预后情况的比较
观察组患者1、2 年生存率均高于对照组,差异均有统计学意义(P<0.05)。(表4)
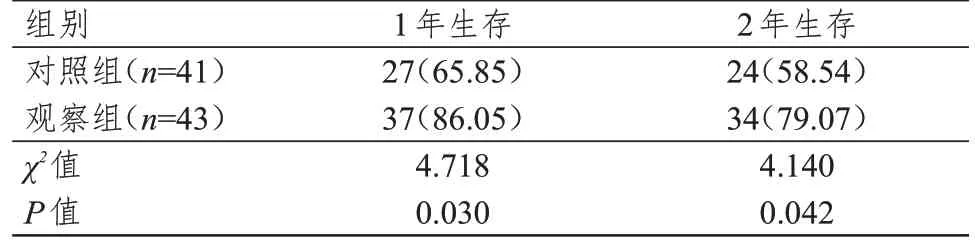
表4 两组患者生存情况的比较[n(%)]
3 讨论
随着人们生活作息及饮食习惯的改变,结肠癌的发病率逐渐升高,且呈年轻化趋势,不利于患者的生命健康[7-8]。研究发现,FOLFIRI 化疗方案是晚期结肠癌的标准化疗方案,西妥昔单抗可以增强伊立替康、亚叶酸钙及5-氟尿嘧啶等抗肿瘤药物对KRAS基因野生型结肠癌患者的疗效[9-10]。此外,西妥昔单抗还可以通过阻断受体相关激酶的磷酸化来抑制结肠癌细胞的增殖、侵袭、转移和新生血管生成,诱导抗体对细胞的细胞毒作用,进而杀死肿瘤细胞[11-13]。
由于结肠癌细胞的刺激,患者自身会释放炎性因子,促进肿瘤的发生发展,并参与肿瘤细胞生长和转移过程[14-16]。血清TNF-α可以直接杀伤肿瘤细胞,在一定情况下,其可以直接诱导肿瘤细胞发生凋亡或坏死,杀死肿瘤细胞,其水平高低可以直接反映炎症的严重程度[17]。血清IL-4、IL-8 作为白细胞介素,能够改变肿瘤微环境中血管内皮细胞的生长状态,还可以改变毛细血管的通透性,导致肿瘤细胞转移和新生血管生成。血清CRP 能够释放炎症介质,当肿瘤发生组织浸润和淋巴结转移时,可以刺激机体产生血小板活化因子,目前,CRP 被认为是炎症反应与组织损伤的敏感指标[18]。本研究结果显示,西妥昔单抗联合FOLFIRI 方案治疗结肠癌患者,其炎性因子水平均低于单纯接受FOLFIRI 方案化疗的对照组,表明炎性因子在结肠癌发生发展过程中有重要作用,其水平变化直接关系疾病进展,而西妥昔单抗与伊立替康、亚叶酸钙以及5-氟尿嘧啶联合应用能够协同增强抗肿瘤活性,抑制机体炎症反应、细胞分化和增殖,促进肿瘤细胞凋亡,进一步控制结肠癌患者的病情。
王峰和徐静[19]研究发现,细胞免疫作为免疫系统的重要组成部分,在肿瘤防御机制中发挥着重要作用,患者自身细胞免疫功能的强弱可以决定患者的复发率及生存时间。T 淋巴细胞能直接反映化疗药物对机体免疫功能的影响,其中CD3+能识别抗原,CD4+、CD8+能够抑制和协助淋巴细胞增强抗体的作用,其水平稳定对于患者免疫应答有重要意义,而CD4+/CD8+可较好地反映患者的免疫功能,其水平异常提示免疫功能紊乱[20-21]。本研究结果显示,化疗后,接受西妥昔单抗联合FOLFIRI方案治疗的观察组结肠癌患者的T 淋巴细胞改善程度优于对照组,且神经毒性、白细胞减少、恶心呕吐、手足综合征、肝功能损伤等不良反应无明显增加,表明西妥昔单抗能够增强结肠癌患者的免疫功能,提高机体耐受性,安全可靠。本研究结果显示,肿瘤进展是造成患者死亡的主要原因,采用西妥昔单抗联合FOLFIRI 方案治疗的观察组结肠癌患者的1、2 年生存率均高于对照组,这可能是因为西妥昔单抗能够抑制辅助性T 淋巴细胞趋于恶化,抑制肿瘤细胞的进展及转移,增强成熟T 淋巴细胞的功能,从而提高机体免疫功能,进而提高患者的生存率。
综上所述,西妥昔单抗联合FOLFIRI 化疗方案能够改善KRAS基因野生型结肠癌患者的炎性因子及T 淋巴细胞亚群水平,提高患者的生存率,安全性较高。

