高危型人乳头瘤病毒多重感染与宫颈癌患者临床特征的关系△
杨然,董莉丽,汪爱兵,冯磊,张清伟
1南阳市中心医院妇科,河南南阳 473009
2漯河市第一人民医院妇科,河南漯河 462000
宫颈癌是女性常见的恶性肿瘤之一,高危型人乳头瘤病毒(high-risk human papilloma virus,HRHPV)感染是宫颈癌的主要致病因素[1]。目前,预防、监测HR-HPV 感染是宫颈癌防控的主要措施之一,人乳头瘤病毒(human papilloma virus,HPV)疫苗的应用效果已得到广泛认可[2]。近年来,有关HR-HPV 多重感染的报道增多,多重感染可促进HPV 重组,产生致癌能力更高的HPV,使宫颈癌发病风险及恶性程度升高[3]。在不同国家、地区和地理环境中,HR-HPV 各亚型分布存在一定差异[4]。本研究探讨HR-HPV 多重感染与宫颈癌患者临床特征的关系,现报道如下。
1 资料与方法
1.1 一般资料
收集2017 年1 月至2019 年12 月南阳市中心医院收治的HR-HPV 感染宫颈癌患者的病历资料。纳入标准:①经病理检查确诊为宫颈癌;②经宫颈液基细胞学检查HR-HPV 阳性;③年龄≥22 岁;④临床资料完整。排除标准:①无性生活史;②检查前3 天内阴道冲洗或药物治疗史;③检查前1 天性生活史;④既往放化疗治疗史;⑤妊娠期或哺乳期女性。依据纳入和排除标准,本研究共纳入158 例患者,年龄<65 岁123 例,≥65 岁35 例;病理类型:鳞状细胞癌144 例,腺癌8 例,其他6 例;临床分期:Ⅰ期36 例,Ⅱ期58 例,Ⅲ期62 例,Ⅳ期2 例;分化程度:低分化39 例,中高分化119 例;有淋巴结转移52 例,无淋巴结转移106 例。根据HR-HPV 感染情况的不同将患者分为单一感染组和多重感染组。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 检测方法
使用窥阴器暴露宫颈,利用HPV 取样刷在宫颈鳞柱交界处采集宫颈上皮脱落细胞,并在1~2 周内采用基因扩增技术及HPV 基因分型检测试剂盒检测HR-HPV 亚型,可检测16、18、31、33、35、39、45、51、52、56、58、59 及68 共13 种HR-HPV 亚型。
1.3 观察指标
记录两组患者的HR-HPV 亚型分布情况,比较两组患者的临床特征,分析比较HR-HPV 二重感染、三重感染、四重感染宫颈癌患者的临床特征。
1.4 统计学方法
采用SPSS 21.0 软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Logistic 回归模型对宫颈癌患者合并HR-HPV多重感染的影响因素进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 HR-HPV 亚型分布情况
158 例患者中,单一感染组119 例(75.32%),多重感染组39 例(24.68%)。单一感染组HR-HPV 亚型以16 型(94.96%)、18 型(2.52%)居多;多重感染组以二重感染(82.05%)为主,三重感染(12.82%)、四重感染(5.13%)较少,其中二重感染HR-HPV 亚型以16+18 型(38.46%)、16+33 型(12.82%)、16+59型(10.26%)居多。(表1、表2)
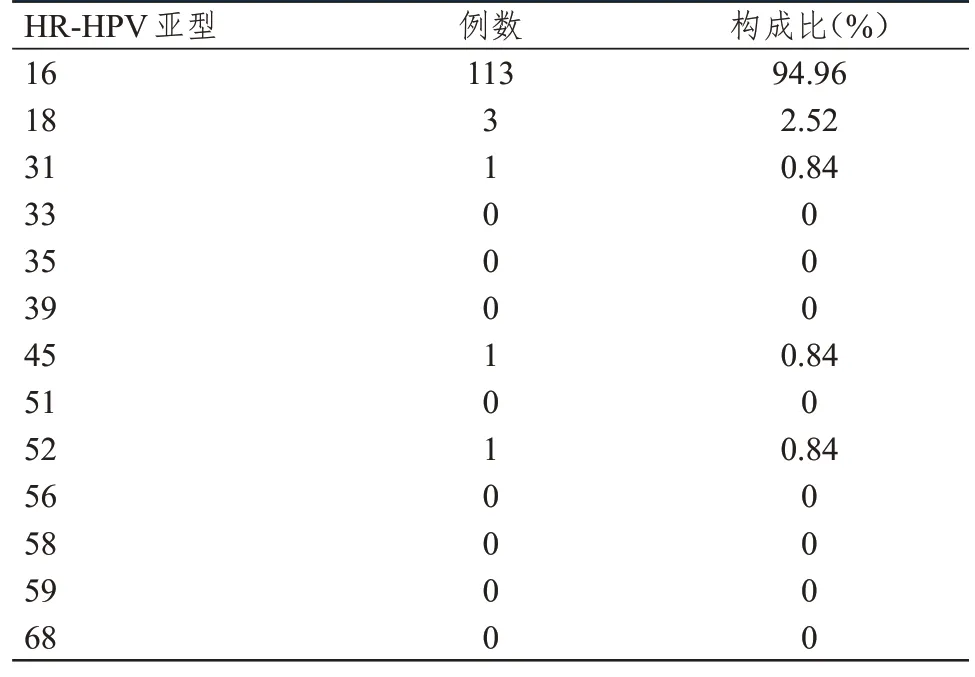
表1 单一感染组宫颈癌患者HR-HPV 亚型分布情况(n=119)
2.2 多重感染组和单一感染组宫颈癌患者临床特征的比较
多重感染组和单一感染组患者的病理类型和临床分期比较,差异均无统计学意义(P>0.05);多重感染组中年龄≥65 岁、低分化、有淋巴结转移的患者比例均高于单一感染组,差异均有统计学意义(P<0.05)。(表3)
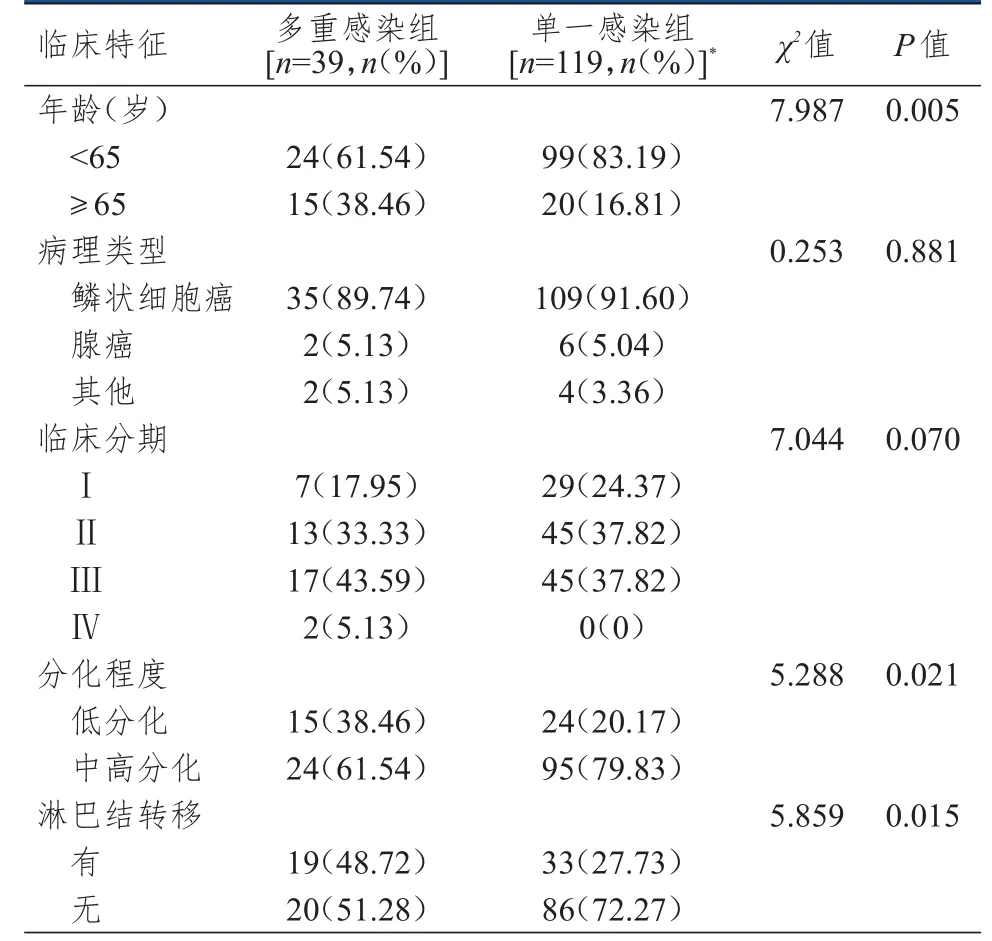
表3 多重感染组和单一感染组宫颈癌患者临床特征的比较
2.3 宫颈癌患者合并HR-HPV多重感染影响因素的多因素分析
以年龄、分化程度、淋巴结转移情况为自变量,宫颈癌患者合并HR-HPV 多重感染为因变量,进行多因素Logistic回归分析,结果显示,年龄≥65岁、低分化、淋巴结转移均是宫颈癌患者合并HR-HPV 多重感染的独立危险因素(P<0.05)。(表4)
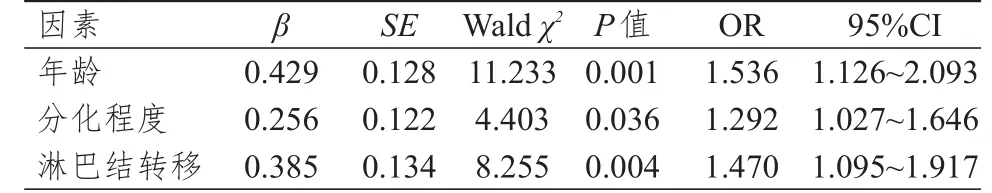
表4 宫颈癌患者合并HR-HPV 多重感染影响因素的多因素Logistic 回归分析
2.4 不同HR-HPV多重感染宫颈癌患者临床特征的比较
HR-HPV 二重感染、三重感染、四重感染宫颈癌患者的年龄、病理类型、临床分期、分化程度、淋巴结转移情况比较,差异均无统计学意义(P>0.05)。(表5)
3 讨论
Hooi 等[5]研究发现,HR-HPV 各亚型间可能存在相互竞争及型别替代现象,二价HPV 疫苗不仅能预防16、18 型HPV,对31、45、52 型HPV 也具有交叉预防作用。中国学者报道16+31 型、16+52 型HPV 多重感染率均较高[6],与外国学者的研究结果有所不同[5]。另有学者指出,HR-HPV52/58 亚型不易单独感染,更易与其他亚型HR-HPV 共同感染[7]。研究表明,HPV 感染亚型分布存在较大的地区、种族差异[8]。因此,调查分析本地区HR-HPV感染亚型分布情况,对指导本地区宫颈癌防控具有重要作用。
本研究中,158 例HR-HPV 阳性宫颈癌患者的多重感染率为24.68%,与解松刚和张玲[9]的研究结果一致;单一感染组HR-HPV 亚型以16 型为主,18型其次,与继往研究结论相同[10-11]。此外,多重感染组以二重感染(82.05%)为主,二重感染中16+18型(38.46%)、16+33 型(12.82%)、16+59 型(10.26%)居多,HR-HPV 多重感染中16 型也较多,说明本地区宫颈癌HR-HPV 单一感染及多重感染均以16 型为主。
文献报道,宫颈癌是由宫颈上皮内瘤变发展至浸润癌的连续过程,其病程发展缓慢,宫颈癌临床分期较高者的HR-HPV 单一感染率较低[12]。本研究结果显示,多重感染组和单一感染组患者的病理类型和临床分期比较,差异均无统计学意义(P>0.05)。提示病理类型、临床分期可能与宫颈癌患者HR-HPV 多重感染并无明显关联,与上述报道不一致。考虑造成该结果的原因有两个方面,一方面,本研究纳入的样本量有限,检验效能较低[13];另一方面,患者生活水平、体检频率、种族及长期居住地不同,导致检查结果存在偏倚[14]。本研究结果还显示,多重感染组中年龄≥65 岁的患者比例高于单一感染组,且年龄≥65 岁是宫颈癌患者合并HR-HPV 多重感染的独立危险因素。究其原因可能是,随着年龄增长,机体免疫功能下降,激素水平发生变化,导致潜伏期病毒复活[15]。不仅如此,多重感染组中低分化、有淋巴结转移的患者比例均高于单一感染组,且低分化、淋巴结转移均是宫颈癌患者合并HR-HPV 多重感染的独立危险因素。分析其原因可能是,低分化、淋巴结转移的宫颈癌恶性程度较高,对机体免疫功能的破坏性更大,HR-HPV 多重感染风险增加;且HR-HPV 多重感染更易形成HPV 持续感染机制,导致致病能力增强,肿瘤恶性程度加深,形成恶性循环[16]。因此,年龄较大、恶性程度较高的宫颈癌患者合并HRHPV 多重感染的风险较高,HR-HPV 多重感染可能使宫颈癌进展加速,不利于患者的预后。
此外,本研究还对HR-HPV 多重感染宫颈癌患者的临床特征进行进一步分析,结果发现,HR-HPV二重感染、三重感染、四重感染患者的年龄、病理类型、临床分期、分化程度、淋巴结转移情况比较,差异均无统计学意义(P>0.05)。说明HR-HPV 多重感染亚型种类数量与宫颈癌患者的临床特征无关。然而,本研究纳入的样本量有限,HR-HPV 多重感染者较少,三重感染、四重感染者仅有5 例、2例,可能造成结果偏倚。因此,后续还需要扩大样本量进一步分析。
综上所述,宫颈癌HR-HPV 感染以16 型为主,宫颈癌患者合并HR-HPV 多重感染与年龄较大、低分化、淋巴结转移有关,HR-HPV 多重感染可能参与宫颈癌进展,及时治疗HR-HPV 多重感染有利于宫颈癌防控。

