巨噬细胞抑制因子-1、胰岛素样生长因子结合蛋白3、糖类抗原19-9 检测对胰腺癌患者预后的预测价值△
李倩,刘娜,鲁洁
延安大学附属医院检验科,陕西延安 716000
胰腺癌是由于胰腺细胞生长失去控制所导致的恶性肿瘤,该病在中国的发病率居恶性肿瘤第7位,且目前仍在不断上升[1]。胰腺癌起病隐匿,早期症状不典型,易发生远处转移,具有生存期短、病死率高等特点[2]。胰腺癌患者确诊时常已处于中晚期而错过最佳治疗时期,导致预后较差。因此,针对早期胰腺癌患者进行准确有效的诊断是改善患者预后、降低其病死率的关键[3]。糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)在临床诊断中对了解组织发生、分化、细胞功能等方面具有重要意义,成为当前临床诊断胰腺癌的标志物之一;胰岛素样生长因子结合蛋白3(insulin like growth factor binding protein 3,IGFBP3)是评估肿瘤发生风险的重要因子,具有潜在的应用价值;巨噬细胞抑制因子-1(macrophage inhibitory cytokine-1,MIC-1)作为肿瘤标志物,为胰腺癌早期诊断提供重要信息[4]。基于此,本研究探讨MIC-1、IGFBP3、CA19-9 检测对胰腺癌患者预后的预测价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2018 年4 月至2021 年7 月延安大学附属医院收治的胰腺癌患者的病历资料。纳入标准:①进行胰腺癌手术治疗;②经病理检查确诊为胰腺癌;③病历资料完整。排除标准:①心理障碍或精神疾病;②合并其他器官并发症。根据纳入、排除标准,共纳入82 例胰腺癌患者,作为观察组,其中,男51 例,女31 例;年龄38~73 岁,平均(58.59±10.18)岁。另选取81 例同期在延安大学附属医院进行健康体检的志愿者作为对照组,其中,男59例,女22 例;年龄34~72 岁,平均(59.13±10.26)岁。两组受试者年龄、性别比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 检测方法
两组受试者均采集晨起空腹上臂静脉血5 ml,静置30 min,使用离心机3000 r/min(5 min)取上清液进行检测。采用夹心酶联免疫吸附法检测IGFBP3 水平,采用CI1000 全自动化学发光免疫分析仪检测CA19-9 水平,采用ELX800 通用酶标仪检测MIC-1 水平。
1.3 随访及预后评估
积极对患者进行随访(门诊随访及电话随访),每3 个月一次,随访6 个月,随访时间截至2022 年1 月。患者均进行化疗、放疗等综合治疗,根据临床转归情况分为好转组和预后不良组(死亡、病情发展)。收集患者临床特征,包括年龄、性别、肿瘤大小、肿瘤部位、分化程度、临床分期、远处转移情况、淋巴结转移情况等。
1.4 观察指标
对比两组受试者MIC-1、IGFBP3、CA19-9水平。分析胰腺癌患者预后的影响因素。分析MIC-1、IGFBP3、CA19-9 对胰腺癌患者预后的预测价值。
1.5 统计学方法
采用SPSS 20.0 软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验;采用多元Logistic 回归分析对胰腺癌患者预后的影响因素进行分析;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,分析MIC-1、IGFBP3、CA19-9 对胰腺癌患者预后的预测价值,并计算曲线下面积(area under the curve,AUC);以P<0.05 为差异有统计学意义。
2 结果
2.1 MIC-1、IGFBP3、CA19-9 水平的比较
观察组患者MIC-1、IGFBP3、CA19-9 水平均明显高于对照组,差异均有统计学意义(P<0.01)。(表1)
表1 两组受试者MIC-1、IGFBP3、CA19-9水平的比较(±s)
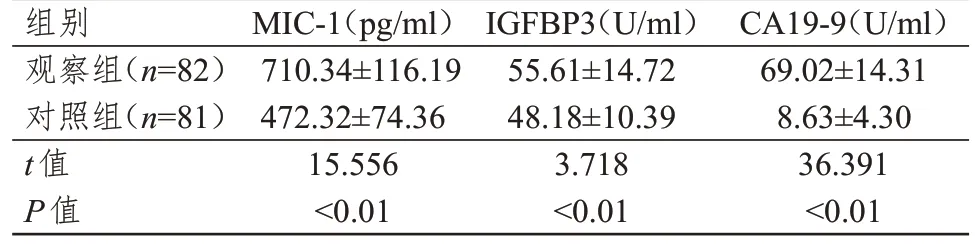
表1 两组受试者MIC-1、IGFBP3、CA19-9水平的比较(±s)
组别观察组(n=82)对照组(n=81)t值P值MIC-1(pg/ml)710.34±116.19 472.32±74.36 15.556<0.01 IGFBP3(U/ml)55.61±14.72 48.18±10.39 3.718<0.01 CA19-9(U/ml)69.02±14.31 8.63±4.30 36.391<0.01
2.2 胰腺癌患者预后影响因素的单因素分析
82 例胰腺癌患者根据预后情况分为好转组61例(74.39%)与预后不良组21 例(25.61%)。好转组与预后不良组患者性别、年龄、肿瘤大小、肿瘤部位、远处转移情况比较,差异均无统计学意义(P>0.05);好转组与预后不良组患者分化程度、临床分期、淋巴结转移情况及MIC-1、IGFBP3、CA19-9 水平比较,差异均有统计学意义(P<0.05)。(表2)
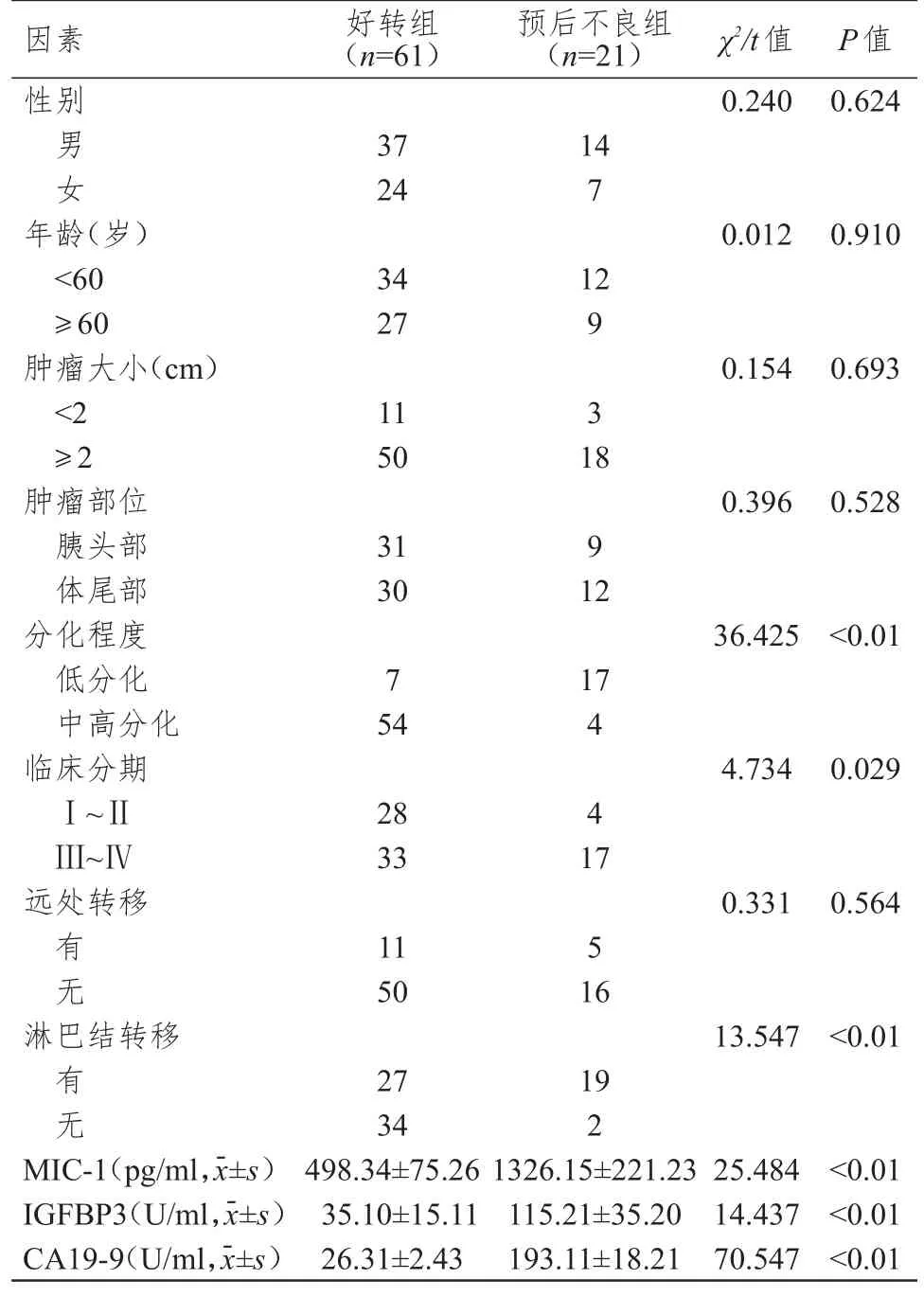
表2 胰腺癌患者预后影响因素的单因素分析
2.3 胰腺癌患者预后影响因素的多因素分析
以原始数据所得中位数为分界点,将连续型变量转化为二分类变量,将表2 中差异有统计学意义的因素纳入多元Logistic 回归模型分析,结果显示,分化程度为低分化、临床分期为Ⅲ~Ⅳ期、有淋巴结转移、MIC-1≥500 pg/ml、IGFBP3≥40 U/ml、CA19-9≥40 U/ml 均为胰腺癌患者预后不良的独立危险因素(P<0.05)。(表3)
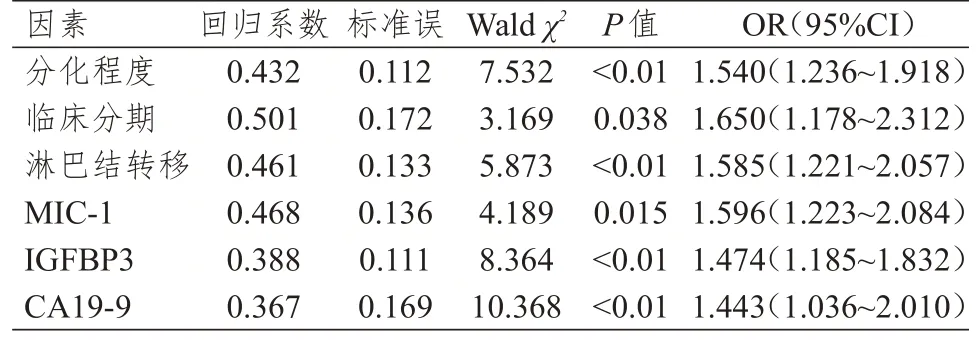
表3 胰腺癌患者预后影响因素的多因素分析
2.4 MIC-1、IGFBP3、CA19-9 单独及联合检测对胰腺癌患者预后的预测价值
根据ROC 曲线可知,MIC-1、IGFBP3、CA19-9联合检测预测胰腺癌患者预后的灵敏度和特异度分别为87.4%、71.9%,AUC 为0.816(95%CI:0.715~0.917),高于MIC-1、IGFBP3、CA19-9 单独检测。(表4、图1)
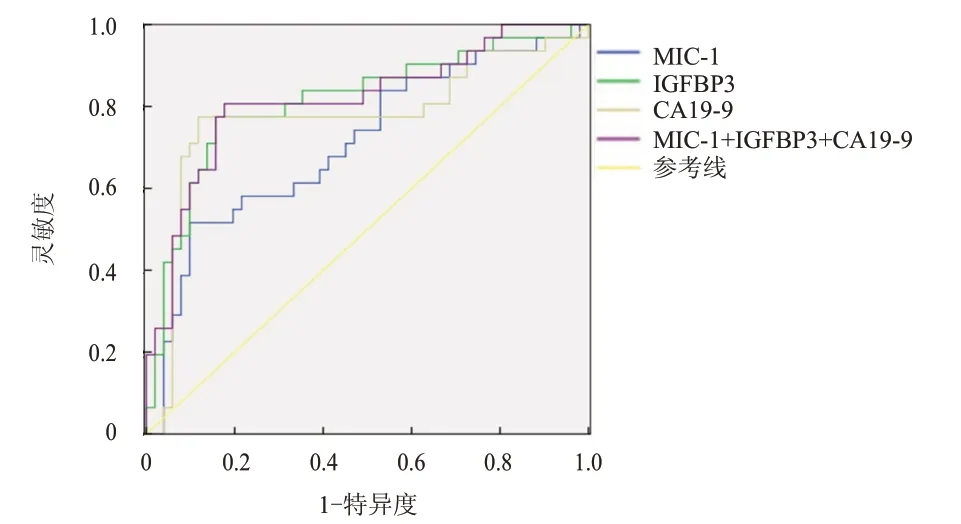
图1 MIC-1、IGFBP3、CA19-9单独及联合检测预测胰腺癌患者预后的ROC曲线
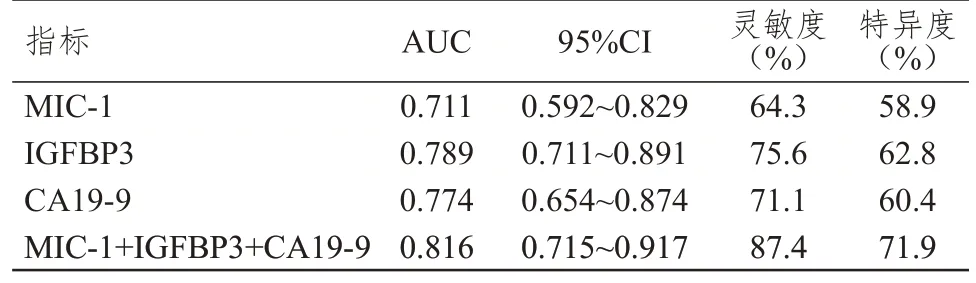
表4 MIC-1、IGFBP3、CA19-9 单独及联合检测对胰腺癌患者预后的预测价值
3 讨论
IGFBP3 作为一种多功能蛋白,通过诱导细胞凋亡抑制细胞增殖。此外,IGFBP3 在胰岛素样生长因子1(insulin like growth factor 1,IGF1)非依赖的情况下参与多条细胞信号通路调控肿瘤的发生发展、转移及复发[5]。在临床中IGFBP3 是胰腺癌预后预测的重要参考指标,IGFBP3基因启动子的甲基化及其引起基因转录沉默在肿瘤细胞中可见,抑制胰腺癌的淋巴结转移,为胰腺癌患者的预后提供重要信息[6-7]。在本研究中,观察组患者IGFBP3 水平明显高于对照组,且是患者预后的独立影响因素,说明IGFBP3基因启动子的甲基化状态有可能作为胰腺癌患者治疗方法选择的一个参考因素,与患者预后不良有密切联系[8]。
胰腺癌是常见的消化系统肿瘤之一,发生位置隐匿,恶性程度高,早期无明显症状,易漏诊或误诊。研究显示,胰腺癌患者5 年生存率低于10%,是预后最差的恶性肿瘤[9]。MIC-1、CA19-9 作为两种不同的肿瘤标志物,均在胰腺癌诊断、预后预测中有重要的临床价值[10]。以往研究显示,胰腺癌患者血液中MIC-1 水平明显高于健康者,提示MIC-1可能参与胰腺癌的发生发展,促进肿瘤细胞的转移与侵袭,在调节肿瘤细胞生长中发挥重要作用[11]。研究报道,胰腺癌病程发展与CA19-9水平升高有密切联系,认为CA19-9 检测可提示肿瘤切除是否充分,判断肿瘤是否存在复发、转移,且对胰腺癌预后预测有重大的临床应用价值[12]。本研究中,观察组患者MIC-1、CA19-9 水平均明显高于对照组,与以往研究相符[13]。说明MIC-1、CA19-9 作为肿瘤标志物,与胰腺癌关系密切;MIC-1、CA19-9水平升高提示患者预后不良,为临床预后提供重要参考。预后不良组患者MIC-1、CA19-9 水平明显高于好转组,且两者均为胰腺癌患者预后不良的独立危险因素,说明预后不佳者其肿瘤细胞转移速度更快,更直观反映肿瘤的存在,为预后判断提供基础。
由于单项肿瘤标志物检测的作用具有局限性,临床为提高肿瘤标志物的辅助诊断价值常采用联合检测方式,获得更好诊断效果[14-15]。本研究中,MIC-1、IGFBP3、CA19-9 对胰腺癌患者预后均有一定的预测价值,其中IGFBP3 对胰腺癌患者预后的预测能力稍高于MIC-1、CA19-9,三者联合检测有效提高预测胰腺癌患者预后的灵敏度和特异度。
综上所述,MIC-1、IGFBP3、CA19-9 升高均与胰腺癌患者预后密切相关,三者对胰腺癌患者预后有较高的预测价值,但目前而言,影响胰腺癌患者预后的因素较多,提高胰腺癌预后的准确性有待临床进一步验证。

