肝激酶B1 在小细胞肺癌中的表达及与患者临床特征的关系△
张利娟,孟庆印,庄莉,龚泉,李雪芹,李仕娟,周春艳
昆明医科大学第三附属医院/云南省肿瘤医院1康复与姑息医学科,2病理科,昆明 650118
肺癌是世界范围内发病率和病死率均较高的恶性肿瘤,严重威胁人类生命健康。其中,小细胞肺癌(small cell lung cancer,SCLC)的发病率约占全部肺癌类型的15%[1]。与非小细胞肺癌(non-small cell lung cancer,NSCLC)相比,SCLC 具有分化程度低、恶性程度高、早期易发生淋巴结转移和血行转移的特点,只有少数患者有手术切除的机会[2]。既往,靶向治疗为NSCLC 的治疗带来了显著进展,但SCLC的治疗方法却鲜有突破,对于大部分SCLC患者,目前主要的治疗手段仍然是化疗联合放疗[3]。尽管大多数SCLC 患者初始对化疗及放疗较为敏感,治疗效果较好,但很快就会产生耐药性或复发,限制了SCLC患者的总生存率,与NSCLC相比,SCLC患者的预后较差,是目前恶性肿瘤治疗的难点[4]。肝激酶B1(liver kinase B1,LKB1)是1998 年被芬兰及德国学者在黑色素斑-胃肠道多发性息肉综合征(Peutz-Jeghers syndrome,PJS)患者中鉴定出来的抑癌基因[5]。LKB1 已被证实与多种恶性肿瘤的发生发展密切相关,但目前其与SCLC 关系的研究较少。本研究探讨LKB1 在SCLC 组织中的表达及与患者临床特征的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2015 年5 月至2021 年12 月昆明医科大学第三附属医院/云南省肿瘤医院收治的SCLC 患者。纳入标准:经术后(包括根治性手术及姑息性手术)病理学检查确诊为SCLC,均为首次接受治疗;年龄18~80 岁;TNM 分期为Ⅰ~Ⅳ期。排除标准:既往接受过抗肿瘤治疗;含有混合性病理成分;病历资料不完整。依据纳入和排除标准,本研究共纳入45 例SCLC 患者,其中男37 例,女8 例;年龄30~73 岁,中位年龄60 岁;TNM 分期:Ⅰ~Ⅱ期29 例,Ⅲ~Ⅳ期16 例;淋巴结转移18 例,无淋巴结转移27 例。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 免疫组化法检测LKB1 蛋白的表达情况
取45 例SCLC 患者的SCLC 组织及距肿瘤组织5 cm 以上的癌旁组织,连续4 μm 切片,采用链霉抗生物素蛋白-过氧化物酶(streptavidin-peroxidase,SP)免疫组化染色检测LKB1 蛋白的表达情况。一抗采用鼠抗人LKB1 单克隆抗体,二抗采用辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)单克隆抗体。采用二氨基联苯胺(diaminobenzidine,DAB)显色,以已知阳性切片作为阳性对照,以磷酸盐缓冲液(phosphate buffered solution,PBS)作为阴性对照。
结果判定:采用双盲法对免疫组化结果进行判定,LKB1 蛋白主要定位于细胞质和细胞核,细胞质或细胞核呈棕黄色颗粒判定为阳性细胞,以染色强度和阳性细胞所占比例进行评分。阳性细胞所占比例≤10%计0 分,阳性细胞所占比例11%~30%计1 分,阳性细胞所占比例31%~60%计2 分,阳性细胞所占比例>60%计3 分;基本不染色计0 分,淡染色计1 分,棕黄色染色计2 分,棕黑色染色计3 分。将阳性细胞所占比例评分和染色强度评分相乘,0~1 分为阴性(-),2~3 分为弱阳性(+),其中4~6 分为中等阳性(++),>6 分为强阳性(+++)。
1.3 统计学方法
采用SPSS 20.0 软件对所有数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 LKB1 蛋白表达情况的比较
SCLC 组织中LKB1 蛋白阳性表达率为71.1%(32/45),明显低于癌旁组织的95.6%(43/45),差异有统计学意义(χ2=8.000,P<0.01)。(图1)
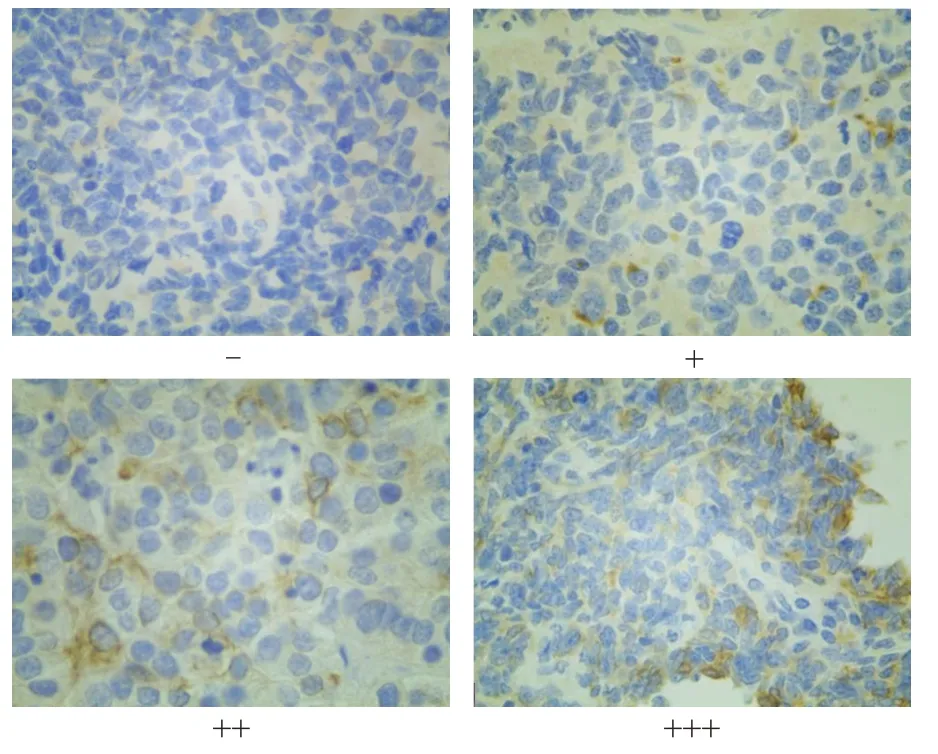
图1 LKB1蛋白在SCLC组织中的表达情况(SP染色,×400)
2.2 不同临床特征SCLC 患者SCLC 组织中LKB1蛋白表达情况的比较
不同性别、吸烟史SCLC 患者SCLC 组织中LKB1 蛋白阳性表达率比较,差异均无统计学意义(P>0.05);有淋巴结转移、TNM 分期为Ⅲ~Ⅳ期SCLC 患者SCLC 组织中LKB1 蛋白阳性表达率分别低于无淋巴结转移、TNM 分期为Ⅰ~Ⅱ期的患者,差异均有统计学意义(P<0.05)。(表1)
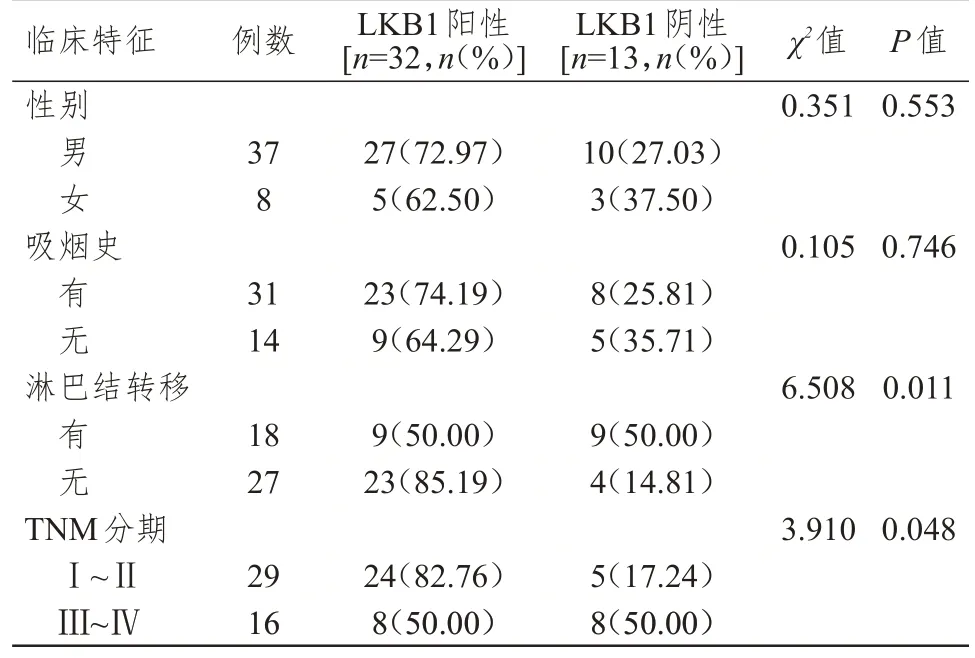
表1 不同临床特征SCLC 患者SCLC 组织中LKB1 蛋白表达情况的比较
3 讨论
SCLC 是最具侵袭性的肺癌,5 年生存率仅为6%[6],SCLC 具有生长迅速和快速转移的特点,对多种治疗方法明显耐药[7]。目前,SCLC患者尚不能从靶向治疗中获益,即使是加入了免疫检查点抑制剂(immune checkpoint inhibitor,ICI),SCLC 整体疗效的改善也并不理想[8-9]。SCLC的这一现状与NSCLC形成了鲜明的对比,在NSCLC 中,ICI 治疗和靶向治疗彻底改变了NSCLC 患者的生存结局[10]。因此,深入探讨SCLC 的发生、发展机制,寻找新的诊断及治疗靶点对SCLC 的防治有重要意义。抑癌基因LKB1已被证实在胃癌、肠癌、乳腺癌等多种恶性肿瘤中存在异常表达[11]。LKB1失活已被证明可以促进肿瘤的发展和转移,并改变对ICI 治疗的反应[12-16]。在NSCLC 样大细胞神经内分泌癌(large-cell neuroendocrine carcinoma,LCNEC)的一个亚群中也发现了复发的丝氨酸/苏氨酸激酶11(serine/threonine kinase 11,STK11)突变[17]。相比之下,LKB1突变在SCLC 中尚未被确定为复发性事件,且对SCLC 中的LKB1 知之甚少[18]。有研究认为,SCLC 中不存在LKB1突变[19],但亦有研究证实,SCLC 中存在LKB1突变[20],因此,LKB1 与SCLC 之间的关系亟待进一步验证。目前关于SCLC 与LKB1 的国内外相关研究报道较少。本研究探讨LKB1 在SCLC 中的表达及与患者临床特征的关系。
本研究结果显示,SCLC 组织中LKB1 蛋白的阳性表达率为71.1%,明显低于癌旁组织的95.6%,差异有统计学意义(P<0.01)。表明SCLC 癌旁正常肺组织中LKB1 蛋白表达较高,LKB1 蛋白在SCLC 中可能具有一定程度的抑癌作用。进一步对临床特征的分析显示,不同性别、吸烟史SCLC患者SCLC 组织中LKB1 蛋白阳性表达率比较,差异均无统计学意义(P>0.05);有淋巴结转移SCLC患者SCLC 组织中LKB1 蛋白阳性表达率低于无淋巴结转移的患者,差异有统计学意义(P<0.05)。表明在SCLC 中,LKB1 蛋白的表达可能与淋巴结转移有关,LKB1 蛋白阳性表达率较低的患者淋巴结转移率较高,LKB1 蛋白可能在一定程度上抑制了SCLC 的淋巴结转移。本研究结果显示,TNM分期为Ⅲ~Ⅳ期SCLC 患者SCLC 组织中LKB1 蛋白阳性表达率低于TNM 分期为Ⅰ~Ⅱ期的患者,差异有统计学意义(P<0.05)。表明LKB1 蛋白的表达与SCLC 发展进程有关。
本研究结果证实了LKB1 蛋白在SCLC 发生发展中的重要作用,这与Sivakumar 等[21]的研究结果相符,该研究对3600 例SCLC 患者多达324 个肿瘤相关基因的外显子进行深度测序,发现了其中62例患者存在LKB1基因突变,占整个研究人群的1.7%,降低了这些患者的生存率。因此,有研究将LKB1突变作为SCLC 的一种新的基因亚型,更令人惊讶的是,有研究分析256 例非洲SCLC 患者的病历资料分析发现,这些患者多数为RB1、肿瘤蛋白p53(tumor protein p53,TP53)野生型和LKB突变型,表明LKB突变型可能与不同种族有关。本研究结果显示,SCLC 组织中LKB1 蛋白的阳性表达率为71.1%,LKB1 蛋白表达情况与SCLC 患者淋巴结转移及TNM 分期有关,提示LKB1 可能作为SCLC 的潜在诊断、治疗和预后评估靶点,有望为SCLC 患者带来新的治疗希望。LKB1 蛋白在SCLC 组织中低表达的原因尚不能完全明确,除基因突变外是否还有其他机制,LKB1 低表达在SCLC 中发生发展过程中所发挥的作用及相关信号通路尚未完全阐明,中国人群中LKB1突变情况如何等问题也有待进一步研究。
综上所述,LKB1 蛋白在SCLC 中低表达,其表达与淋巴结转移和TNM 分期有关,有望作为SCLC 患者潜在的治疗靶点和预后评估指标。

