胆瘀方药液对大鼠主动脉内皮细胞脂质泡沫化的抑制作用及其机制
宋晓龙,潘仁友,涂冬云,顾月星,宋峻,伍德明,倪其猛
南京中医药大学附属盐城中医院 盐城市中医院心内科,江苏盐城 224001
冠心病(CHD)最核心的发病机制就是动脉粥样硬化(AS),本质上是一种大、中动脉内膜慢性持续进展的炎症性血管病变[1-2]。在AS 早期即可出现内皮细胞损伤,造成巨噬细胞在血管内皮细胞聚集,低密度脂蛋白(LDL)开始沉积,内皮细胞被氧化低密度脂蛋白(Ox-LDL)激活,吸引吞噬细胞向内膜中积聚,大量释放促炎细胞因子,导致更多炎症细胞浸润和平滑肌增生,从而加速AS 的启动[3]。胆瘀方是我科室团队基于胸痹心痛病的中医理论研究所创立,由温胆汤和丹参饮加减而成,具有健脾化痰降浊、益气活血化瘀等功能,常用于治疗冠心病心绞痛,临床疗效显著[4]。2022 年8 月—2023 年5 月,本研究以Ox-LDL 刺激大鼠主动脉内皮细胞(RAECs)脂质泡沫化模拟AS的内皮细胞,探讨胆瘀方药液对内皮细胞脂质泡沫化的抑制作用及其机制。现报告如下。
1 材料与方法
1.1 材料 细胞:RAECs 购自美国Cell 公司,使用含有10%胎牛血清、100 µg/mL青霉素和0.1 mg/mL链霉素的DMEM 完全培养基,在37 ℃、5% CO2培养箱中培养。胆瘀方:丹参20 g、水蛭3 g、半夏12 g、竹茹12 g、陈皮6 g、黄芪20 g、茯苓10 g、檀香3 g、砂仁3 g、枳实12 g、桔梗6 g、炙甘草3 g;加入2 L 水浸泡1 h 后煎煮1 h,过滤后再加入2 L 水煎煮50 min,再次过滤;将两次煎煮的滤液继续煎煮浓缩至浓度2 g/mL的药液。主要试剂:肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、丙二醛(MDA)、超氧化物歧化酶(SOD)ELISA 检测试剂盒及蛋白质酪氨酸激酶2(JAK2)、信号转导与转录激活因子3(STAT3)、p-JAK2、p-STAT3 抗体均购自北京碧云天生物技术有限公司,活性氧(ROS)检测试剂盒购自中国北京百奥莱博科技有限公司,JAK2、STAT3 引物序列均由上海生工生物工程有限公司设计合成。
1.2 Ox-LDL 作用浓度确定 选择对数生长期的RAECs,以1 × 104/孔接种于96 孔板中,使用DMEM培养基,在37 ℃、5% CO2培养箱中培养。①细胞增殖能力检测:取RAECs,分别加入不同浓度(0、50、100、150、200 µg/mL)Ox-LDL 作用24、48、72 h,使用CCK-8 试剂盒检测细胞活力,上酶标仪检测450 nm波长处的OD 值,实验重复3 次取平均值。结果显示:与0 µg/mL Ox-LDL 作用相同时间点比较,150、200 µg/mL Ox-LDL 作用48、72 h 的OD 值均降低(P均<0.01),以200 µg/mL Ox-LDL 作用72 h 的OD值降低幅度最大。见表1。②细胞脂质泡沫化情况观察:取RAECs,分别加入不同浓度(0、50、100、150、200 µg/mL)Ox-LDL 作用72 h。将油红O 粉末溶解在异丙醇中,用蒸馏水将油红O 原液稀释至0.3%,并通过0.22 µm 过滤器过滤。室温下4%多聚甲醛固定1 h,油红O 溶液进行染色,5 min 后显微镜下观察,含有油红O 阳性脂肪滴的细胞为泡沫细胞。结果显示,200 µg/mL Ox-LDL 作用72 h 的RAECs脂质泡沫化程度最高。见OSID码图1。
表1 RAECs经不同浓度Ox-LDL作用不同时间后的细胞增殖能力比较()

表1 RAECs经不同浓度Ox-LDL作用不同时间后的细胞增殖能力比较()
注:与0 µg/mL Ox-LDL作用相同时间比较,*P<0.05,#P<0.01。
?
1.3 细胞分组及不同剂量胆瘀方处理 选择对数生长期的RAECs,以1 × 104/孔接种于96 孔板中,使用DMEM 培养基,在37 ℃、5% CO2培养箱中培养。将RAECs 随机分为六组,即对照组、模型组、胆瘀方低剂量组、胆瘀方中剂量组、胆瘀方高剂量组及阿托伐他汀组。除对照组外,其余五组均给予200 µg/mL的Ox-LDL灌胃作用72 h,胆瘀方低、中、高剂量组及阿托伐他汀组分别给予50、100、200 µg/L 胆瘀方药液及阿托伐他汀300 µg/L灌胃。
1.4 细胞增殖能力检测 参照“1.2”,采用CCK-8法检测各组分组处理后24、48、72 h 的OD 值,以此表示细胞增殖能力。
1.5 细胞脂质泡沫化情况观察 取分组处理后72 h 的各组细胞,采用油红O 染色观察各组细胞脂质泡沫化情况。
1.6 细胞TNF-α、IL-6 蛋白检测 采用ELISA 法。取分组处理72 h 的各组细胞,使用ELISA 检测试剂盒检测TNF-α、IL-6 表达,严格按照试剂盒说明书进行操作。
1.7 细胞ROS 含量检测 采用二羟甲基荧光素(DCFH-DA)氧化荧光反应。取分组处理后72 h 的各组细胞,以5 × 104/mL 接种在6 孔板中,除去培养基。加入DCFH-DA 荧光探针1.5 mL,37 ℃条件下作用25 min。200 倍荧光显微镜下观察细胞荧光情况,以此表示ROS含量。
1.8 细胞上清液MDA和SOD水平检测 采用ELISA法。取分组处理72 h 的各组细胞,置于冷生理盐水中,匀浆机匀浆,3 000 r/min离心15 min,分离细胞上清液。使用ELISA试剂盒检测细胞上清液MDA、SOD表达,严格按照试剂盒说明书操作。
1.9 细胞JAK2、STAT3 mRNA 检测 采用实时荧光定量PCR 法。取分组处理72 h 的各组细胞,使用TRIzol 试剂提取总RNA,逆转录试剂盒合成cDNA。JAK2 引物序列:上游引物5′-AAGCTTTCTCACAAGCATTTGGTTT-3′,下游引物5′-AGAAAGGCATTAGAAAGCCTGTAGTT-3′;STAT3引物序列:上游引物5′-ACCAGCAGTATAGCCGCTTC-3′,下游引物5′-GCCACAATCCGGGCAATCT-3′;内参GAPDH引物序列:上游引物5′-GGTTTGAGCAGGTTTTT-3′,下游引物5′-GATGCCTGCTTCACCACC-3′。在MyiQ2 PCR 热循环仪上进行PCR 反应,2-ΔΔCt法计算JAK2、STAT3 mRNA相对表达量。
1.10 细胞JAK2、STAT3 蛋白及p-JAK2/JAK2、p-STAT3/STAT3 检测 采用Westen blotting 法。取分组处理72 h的各组细胞,加入RIPA缓冲液裂解细胞,检测总蛋白浓度合格。10%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转移到聚偏二氟乙烯(PVDF)膜上。加入含有0.05%吐温20的Tris缓冲盐水(TBS)稀释的奶粉,阻断非特异性位点。加入JAK2、p-JAK2、STAT3、p-STAT3 及内参GAPDH 的兔单克隆一抗(稀释比例均为1∶1 000),4 ℃条件下孵育过夜,TBST洗涤3次;加入山羊抗兔IgG二抗(稀释比例均为1∶ 2 000),37 ℃条件下孵育1 h。采用增强化学发光法评价印迹,Quantity One软件分析条带灰度值,计算JAK2、STAT3蛋白相对表达量及p-JAK2/JAK2、p-STAT3/STAT3。
1.11 统计学方法 采用SPSS19.0 统计软件。计量资料采用Cramer-von Mises test(CVM 检验)正态性检验,呈正态分布以表示,多组间比较采用方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,两组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖能力比较 与对照组作用相同时间点比较,模型组OD 值均降低(P均<0.05);与模型组作用相同时间点比较,胆瘀方高剂量组及阿托伐他汀组OD 值均升高,胆瘀方中剂量组作用48、72 h的OD值均升高(P均<0.05)。见表2。
表2 各组不同时间点细胞增殖能力比较()

表2 各组不同时间点细胞增殖能力比较()
注:与对照组作用相同时间比较,*P<0.05;与模型组作用相同时间比较,#P<0.05;与阿托伐他汀组作用相同时间比较,△P<0.05。
?
2.2 各组细胞脂质泡沫化情况比较 对照组细胞无脂质泡沫化情况,模型组细胞脂质泡沫化明显;与模型组比较,阿托伐他汀组及胆瘀方高、中、低剂量组细胞脂质泡沫化均得到改善,胆瘀方高剂量组和阿托伐他汀组细胞脂质泡沫化缓解最明显,几乎趋近于对照组。见OSID码图2。
2.3 各组细胞TNF-α、IL-6、ROS 及上清液MDA、SOD 表达比较 与对照组比较,模型组细胞TNF-α、IL-6、ROS 及上清液MDA 表达均升高,上清液SOD表达降低(P均<0.05)。与模型组比较,阿托伐他汀组及胆瘀方高、中、低剂量组细胞TNF-α、IL-6、ROS及上清液MDA 表达均降低,上清液SOD 表达均升高,以阿托伐他汀组及胆瘀方高剂量组变化更明显(P均<0.05)。见表3。
表3 各组细胞TNF-α、IL-6、ROS及上清液MDA、SOD表达比较()
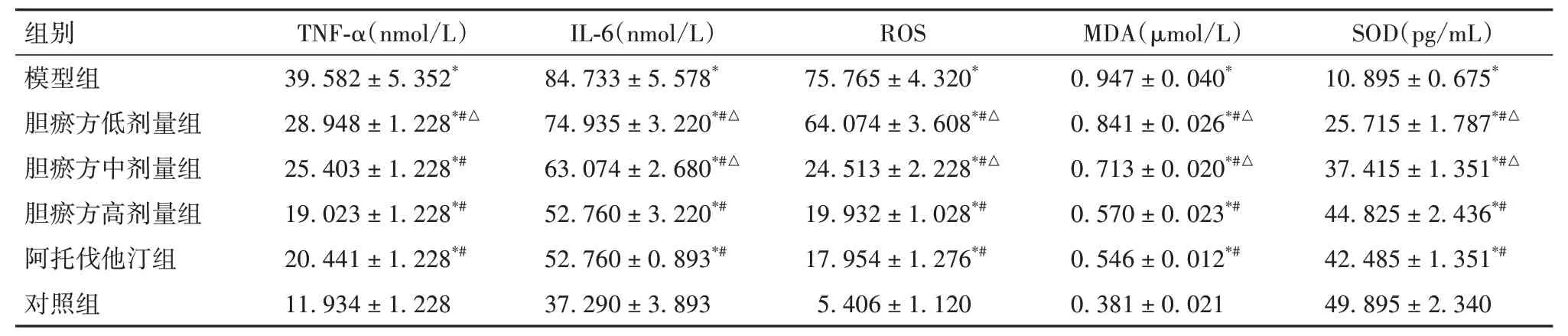
表3 各组细胞TNF-α、IL-6、ROS及上清液MDA、SOD表达比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与阿托伐他汀组及胆瘀方高剂量组比较,△P<0.05。
?
2.4 各组细胞JAK2、STAT3 mRNA、蛋白相对表达量及p-JAK2/JAK2、p-STAT3/STAT3 比较 与对照组比较,模型组细胞JAK2、STAT3 mRNA 相对表达量及p-JAK2/JAK2、p-STAT3/STAT3 均升高(P均<0.05)。与模型组比较,阿托伐他汀组及胆瘀方高、中、低剂量组细胞JAK2、STAT3 mRNA 相对表达量及p-JAK2/JAK2、p-STAT3/STAT3 均降低,以阿托伐他汀组及胆瘀方高剂量组降低更明显(P均<0.05)。各组细胞JAK2、STAT3蛋白相对表达量比较差异均无统计学意义(P均>0.05)。见表4及OSID码图3。
表4 各组细胞JAK2、STAT3 mRNA、蛋白相对表达量及p-JAK2/JAK2、p-STAT3/STAT3比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与阿托伐他汀组及胆瘀方高剂量组比较,△P<0.05。
?
3 讨论
AS是动脉硬化中最常见的类型,在人体重要器官均可发生,并且在引起急性心脑血管疾病(如心梗和脑梗)之前可以很多年都没有临床症状。AS主要表现为大、中动脉内膜的脂质沉积、平滑肌细胞和基质增生,炎症细胞浸润,内膜增厚,血栓形成,最终导致管腔狭窄,严重时会出现闭塞[5]。冠状动脉一旦发生AS,其损伤数量随年龄增加,管腔出现不同程度狭窄,并伴有血栓形成,导致血液循环障碍[6-7]。因此,人体出现AS 后需要积极治疗,防止斑块进展[8-9]。阿托伐他汀是治疗AS 的常用药物,其治疗作用已被临床证实[10],因此本研究选择阿托伐他汀作为阳性对照药物。越来越多的研究表明,部分中药或者中药成分能够用于治疗AS[11-12]。胆瘀方是我科治疗冠心病心绞痛的经验方,方中半夏燥湿化痰,竹茹清热化痰,陈皮理气健脾、燥湿化痰;丹参、水蛭活血化瘀、搜风剔络;茯苓、黄芪健脾益气、利水祛湿,可杜生痰之源;治痰治血先理气,气顺则痰化瘀消,方中檀香、砂仁、桔梗、枳壳均具有宽胸理气之功效,以助化痰活血;甘草调和诸药;诸药配伍,共奏健脾化痰降浊、益气活血化瘀之效。但是,胆瘀方的作用机制,尤其是其治疗AS的作用机制尚不清楚。
在AS发生发展过程中,起到关键性作用的内皮细胞除了建立屏障与运输营养物质外,还具有调节内分泌功能,具有预防血栓、调节血管舒缩和局部血流,降低血管通透性,调节免疫反应和炎症,促进血管新生,抑制细胞迁移和增殖等作用[13]。此外,内皮细胞作为一类传递信号的细胞,当细胞膜受体感知到化学性或者物理性变化后,会分泌多种生物活性物质[14]。当血管内皮细胞受到各种AS 病理因子的反复刺激后,其结构功能遭到破坏,通透性增强,导致动脉硬化的大分子物质如LDL 随即进入内皮下间隙,氧化后被巨噬细胞吞噬,形成泡沫细胞[15];同时,内皮细胞的代谢功能也随之发生变化,通过释放各种细胞因子发挥促进炎症和凝血的作用,从而形成血栓,最终导致相关疾病发生[16]。因此,内皮细胞功能异常不仅是AS形成之前的一个早期表现,更是重要的启动及致病因素之一[17]。本研究以Ox-LDL刺激RAECs 脂质泡沫化模拟发生AS 的内皮细胞,并采用不同剂量胆瘀方进行处理;结果显示,高剂量胆瘀方处理后细胞增殖能力升高,且脂质泡沫化情况比较轻,几乎趋近于对照组;这提示高剂量胆瘀方可以提高Ox-LDL 刺激后RAECs 的增殖能力,并减轻其脂质泡沫化。
炎症反应参与了AS 的各个阶段,贯穿AS 不同阶段损伤,其中IL-6、TNF-α 是最重要的炎症因子。IL-6 在AS 的炎症反应中起核心调节作用,是参与AS 形成的一个重要炎症因子,与AS 斑块的稳定性密切相关[18]。TNF-α是一种对多种细胞的生长分化等功能发挥抑制或刺激效应的因子,其主要生物学活性为激活炎症反应。TNF-α可刺激内皮细胞合成E-选择素,激活平滑肌细胞产生IL-6[19]。研究发现,TNF-α、IL-6 可促使内皮细胞产生ROS,使众多促炎因子表达增加,炎症反应与细胞增殖形成恶性循环,促进AS 斑块生长并导致其稳定性下降[20]。本研究结果显示,Ox-LDL刺激后的RAECs TNF-α和IL-6表达均升高,经过胆瘀方及阿托伐他汀处理后均降低,以高剂量胆瘀方及阿托伐他汀作用最明显;这提示高剂量胆瘀方能够降低AS 过程中内皮细胞的炎症反应。
ROS 累积负荷会扰乱氧化还原的动态平衡,损伤细胞内DNA、脂类和蛋白质等细胞大分子,导致生物膜脂质受到过氧化损伤,进而损伤内皮细胞,减少内皮细胞的一氧化氮合成与生物利用度[21]。氧化应激还可激活细胞内多种转录因子表达,使炎症因子和趋化因子表达升高,引起动脉内皮细胞的损伤[22]。MDA 是ROS 攻击细胞膜所形成的脂质过氧化代谢终产物,其含量可反映机体脂质过氧化的程度,MDA 升高提示氧化应激损伤加重,反之则说明氧化应激损伤减轻[23]。SOD具有清除生物体内超氧阴离子自由基的作用,对维持细胞内环境的稳态、保护血管内皮免受过氧化损伤等发挥重要作用。研究显示,SOD活性增强能抑制细胞介导的LDL过氧化,减少Ox-LDL 形成,阻止巨噬细胞对脂类的过度摄取,减少泡沫细胞形成,SOD变化可反映细胞遭受氧化应激的水平[24]。本研究结果显示,Ox-LDL刺激后RAECs ROS 和MDA 表达均升高、SOD 表达降低,经过胆瘀方及阿托伐他汀处理后ROS 和MDA 表达均降低、SOD表达升高,以高剂量胆瘀方及阿托伐他汀作用最明显;这提示高剂量胆瘀方可减轻Ox-LDL引起的内皮细胞氧化应激损伤。
JAK2/STAT3 通路最开始是在肿瘤微环境中被发现,近年来研究发现其对炎症反应具有重要影响,可以引起IL-6、TNF-α 等下游炎症因子表达[26]。抑制JAK2/STAT3 通路激活可有效缓解AS 患者的组织炎症反应,抑制炎症因子分泌,有效抑制高脂饮食诱发的AS[25]。JAK2 和STAT3 的磷酸化是调节蛋白质活力和功能的最核心机制,是蛋白具有生物学活性的重要标志,提示JAK2/STAT3 通路处于激活状态。本研究结果显示,Ox-LDL刺激后RAECs JAK2、STAT3 mRNA 相对表达量及p-JAK2/JAK2 、p-STAT3/STAT3 均升高,胆瘀方能够有效降低上述指标,而各组细胞JAK2、STAT3 蛋白相对表达量比较差异均无统计学意义;这提示Ox-LDL 刺激后RAECs 的JAK2/STAT3 信号通路被激活,而胆瘀方能够抑制JAK2/STAT3信号通路激活。
综上所述,胆瘀方药液可抑制Ox-LDL 诱导的RAECs 脂质泡沫化,以高剂量胆瘀方药液作用更明显,其机制可能与抑制炎症反应、氧化应激反应及JAK2/STAT3信号通路有关。

