甲型副伤寒沙门氏菌HmpA 蛋白的表达纯化及生物学特征预测
王 磊,刘小草,董 雨,王雪婷,柴徵微,李 吉,丁爱军,张维明,曾韦锟
(昆明学院医学院,云南昆明 650214)
肠热症由伤寒沙门氏菌、副伤寒沙门氏菌(甲、乙、丙)所引起,主要通过污染的水源和食物而爆发流行,不良的卫生条件和生活习惯是疾病发生的主要原因,但是随着人员交际的增加,全球肠热症病发率逐渐成为大部分国家突出的卫生问题[1-3]。近年来,伤寒沙门氏菌感染占比呈下降趋势,而甲型副伤寒沙门氏菌(后简称副甲菌)在某些地区感染占比则呈现上升趋势[4-5]。据调查,近年来云南、广西、湖南、贵州、福建和广东6 个省份伤寒、副伤寒的发病率均显著高于全国平均水平[6]。虽然云南省的伤寒、副伤寒的发病率总体呈逐年下降趋势,但患病率在全国仍处于较高的水平且多年位居第一[7-8]。副甲菌感染引起的疾病在临床上以持续高热,相对缓脉,肌肉酸痛,特征性中毒症,脾肿大,玫瑰疹与白细胞减少等为特征,主要并发症则包括肠出血、肠穿孔等[9-12]。因此探究副甲菌逃脱宿主免疫杀伤的机制十分必要。
多种生物体利用NO 来抵抗微生物感染,NO 通过促进亚硝化应激[13-15]和抑制有氧呼吸链中的血红蛋白来对微生物产生细胞毒性[16-17]。HmpA 蛋白是细菌体内hmpA基因产生的NO 双加氧酶[18],其在宿主一氧化氮合酶产生ROS 和NO 时在细菌体内表现出较高活性[19-21],功能主要是通过将宿主产生的杀伤性NO 以一定方式降解为对菌体无害的硝酸盐,如在大肠杆菌中催化的主要反应是通过双加氧酶机制转化O2和NO 形成硝酸根离子。但有研究显示该蛋白降解NO 的效率在低氧或缺氧环境中可能受到限制[22],即在缺氧或低氧条件下,HmpA 蛋白的活性会显著降低[23]。但总的来说,在细菌于宿主体内的免疫逃避过程该蛋白发挥至关重要的作用。目前关于甲型副伤寒沙门氏菌体内HmpA 蛋白的功能、结构及基本理化性质尚无清晰报道。为了进一步研究副甲菌中HmpA 蛋白的基本生物学信息,本研究以甲型副伤寒沙门氏菌CMCC 50973 菌株为模板,克隆hmpA基因并构建了原核表达载体,诱导表达并纯化了HmpA 蛋白[24-25];并通过生物信息方法对该蛋白相关的多个重要理化性质进行分析[26-27]。这为后续探究甲型副伤寒沙门氏菌体内HmpA 蛋白的免疫学特性与降解宿主细胞产生的杀伤性NO 机理方面的影响提供理论参考。
1 材料与方法
1.1 材料与仪器
甲型副伤寒沙门氏菌CMCC 50973、pNdeI 质粒(本实验室从pET-28a(+)质粒改造而来)、大肠杆菌BL21(DE3) 本实验室保存;pMD19T Vector、T4 DNA 连接酶、DNA 聚合酶、dNTPs、核酸分子质量Marker 宝生物工程有限公司;质粒小量提取试剂盒、微量琼脂糖DNA 回收试剂盒 天根生化科技(北京)有限公司;PAGE 凝胶快速制备试剂盒(10%)、双色预染蛋白Marker 上海雅酶生物医药科技有限公司;ULtraSignal 超敏ECL 化学发光底物、限制性内切酶NdeⅠ及XhoⅠ 赛默飞世尔科技公司;小鼠抗His 标签单克隆抗体 德悦(北京)生物科技有限责任公司;HRP-羊抗鼠IgG、异丙基硫代半乳糖苷(IPTG) 生工生物工程(上海)股份有限公司;PAGE 蛋白上样缓冲液、BeyoBlue™考马斯亮蓝超快染色液 上海碧云天生物科技有限公司;酵母提取物、胰化蛋白胨 英国Oxoid 公司;氨苄青霉素、卡那霉素 BBI 公司;琼脂糖 基因生物技术国际贸易(上海)有限公司;Tris/甘氨酸/SDS 电泳缓冲液(10×)、10×电泳转移缓冲液(转膜液)(粉剂)、10×TBST 缓冲液(粉剂)、10×Tris-甘氨酸电泳缓冲液(粉剂)、1×PBS 缓冲液 北京索莱宝科技有限公司;PCR 扩增引物 昆明擎科生物科技有限公司;0.22 μm 无菌滤膜、0.45 μm 无菌滤膜 Minipore 公司;Histrap 1 mL 预装柱 美国GE 公司。
Nano-200 核酸蛋白测定仪 杭州奥盛仪器有限公司;GZX-DH 电热恒温干燥箱 上海精宏实验设备有限公司; Bio-base BSC-1500 II A2-X 生物安全柜 济南鑫贝西生物安全柜;GI-1 发光成像系统上海天能有限公司;Neo 13R 高速冷冻离心机 上海力申科学仪器有限公司;D3024 台式高速微量离心机、D1008 掌上离心机 美国赛洛捷克科技有限公司;GI-1 紫外凝胶成像分析系统 通宝达成有限公司;HQ45Z 恒温摇床仪 武汉中科科仪技术发展有限责任公司;EPS 200 电泳仪双板垂直蛋白电泳系统上海天能科技有限公司;JY92-IIN 超声波细胞破碎仪 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 目的基因的克隆 以CMCC 50973 基因组为模板设计引物hmpA-F、hmpA-R(表1),为了将片段定向克隆至pNdeI 载体上的NdeI 和XhoI 之间并与XhoI 位点后的6 His 标签融合,分别在上下游引物的5’端引入NdeI 或XhoI 酶切位点,PCR 扩增hmpA基因片段,PCR 程序为:94 ℃(5 min);94 ℃(30 s),57 ℃(30 s),72 ℃(70 s)共30 个循环;72 ℃(5 min)。PCR 产物进行1%琼脂糖凝胶电泳并扫描。

表1 PCR 引物Table 1 PCR primers
1.2.2 亚克隆pMD19T-hmpA的构建及鉴定 将1.2.1 获得的PCR 产物进行1%琼脂糖凝胶电泳,将hmpA基因片段利用微量琼脂糖DNA 回收试剂盒进行回收,后与pMD19T Vector 载体16 ℃连接18 h。-80 ℃取出DH5α感受态细胞在冰水浴中完全融化后加入连接产物,冰水浴静置5 min;42 ℃热激90 s;迅速冰水浴静置2 min;而后加入液体LB 500 μL,37 ℃,200 r/min,培养30 min;将培养液10000 r/min 离心1 min,吸弃培养基剩余约60 μL重悬菌体后,均匀涂于氨苄抗性平板上37 ℃过夜培养18 h。挑取单克隆菌落至带有氨苄抗性(30 μg/mL)的3 mL LB 培养基中37 ℃,200 r/min 培养18 h 后利用质粒小量提取试剂盒提取质粒,进行37 ℃,30 min 的NdeⅠ、XhoⅠ酶切鉴定,用1%琼脂糖凝胶进行电泳,并观察酶切结果。鉴定为正确的质粒,送昆明擎科生物科技有限公司进行测序,测序正确的载体命名为pMD19T-hmpA。
1.2.3 表达载体pNdeI-hmpA的构建及鉴定 将DH5α转化提取的pNdeI 质粒及测序正确的pMD19ThmpA质粒分别进行37 ℃,40 min 的NdeⅠ、XhoⅠ双酶切,微量琼脂糖DNA 回收试剂盒回收双酶切产物,将回收产物用T4 DNA 连接酶16 ℃连接18 h后转化至DH5α感受态细胞,转化步骤同1.2.2。挑取转化后的单菌落至带有卡那抗性(30 μg/mL)的3 mL LB 培养基中37 ℃,200 r/min 培养18 h,提取质粒,进行37 ℃,30 min 的NdeⅠ、XhoⅠ双酶切鉴定,用1%琼脂糖凝胶进行电泳,并观察酶切结果。构建正确的载体命名为pNdeI-hmpA。将此质粒转化入大肠杆菌BL21(DE3)感受态细胞获得重组表达菌pNdeI-hmpA/BL21(DE3)同1.2.2。
1.2.4 HmpA 蛋白的诱导表达与纯化 将pNdeIhmpA/BL21(DE3)原核表达菌株及空载体菌划线获得单克隆,挑取单克隆接种于5 mL 含有50 μg/mL卡那霉素的 LB 培养液中,37 ℃摇床培养过夜。第2 d 将过夜培养的两种表达菌株按1%(100 μL)的比例转种于10 mL(50 μg/mL)K+LB 培养液中;37 ℃摇床培养待OD600≈0.7 左右时,加入IPTG 至终浓度为1 mmol/L,16 ℃诱导过夜。取1 mL 经IPTG 诱导菌,12000 r/min 离心60 s 弃上清,加入600 μL PBS 重悬菌体再次以12000 r/min 的速度离心60 s弃上清。按1:1 体积比加PBS,冰水浴条件超声破碎(312 W,工作5 s,间隔10 s,共工作60 min)。破碎完成后,低温高速离心机4 ℃、2000 r/min,离心10 min;转移上清至新的EP 管后,4 ℃、10000 r/min离心15 min,沉淀则用100 μL PBS 重悬。分别取上清与沉淀重悬液与上样缓冲液混合,煮样15 min 后进行SDS-PAGE 电泳。
在纯化目的蛋白前先用5 倍柱体积的无菌水冲洗Ni 柱,然后用平衡缓冲液5 mL 平衡柱子(上清平衡缓冲液:20 mmol/L PB、150 mmol/L NaCl、pH=7.40,沉淀平衡缓冲液:20 mmol/L PB、150 mmol/L NaCl、8 mol/L 尿素、pH7.40),并用0.45 μm 无菌滤膜过滤上清与沉淀重悬液(两者分别单独纯化)。平衡后将过滤后的上清与沉淀重悬液分批缓慢注入Ni 柱中,随后用含有咪唑的缓冲液洗柱子,上清洗柱子与洗脱缓冲液为20 mmol/L PB、150 mmol/L NaCl、50 mmol/L 及1 mol/L 咪唑、pH7.40,沉淀重悬液的洗柱子与洗脱缓冲液为20 mmol/L PB、150 mmol/L NaCl、50 mmol/L 及1 mol/L 咪唑、8 mol/L 尿素、pH7.40,收集纯化洗脱的样品进行SDS-PAGE 电泳。
1.2.5 纯化后蛋白的Western blot 分析 重组蛋白经SDS-PAGE[28]后电转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,用10%脱脂奶粉轻摇室温封闭2 h,TBST 漂洗4 次,每次10 min,加入按1:2000 比例用TPBS 稀释好的小鼠抗His 标签单克隆抗体,于4 ℃条件下轻摇过夜后,TBST 漂洗PVDF 膜后并浸洗三次,每次漂洗10 min,再加入按1:10000 比例用TPBS 稀释好的HRP 标记的羊抗鼠IgG 室温轻摇1 h 后,用TBST 漂洗PVDF 膜后并浸洗三次,每次漂洗5 min,取ULtraSignal 超敏ECL 化学发光底物(2 种试剂)各0.5 mL 至无菌EP管中(按1:1)混匀,滴加适量稀释后的发光底物于膜上,成像仪拍照保存。
1.2.6 HmpA 蛋白的生物信息学功能分析 用ExPASy 的ProtParam 软件分析HmpA 蛋白的基本理化性质;Protscale 在线分析HmpA 蛋白的亲水性,TMHMM Server v.2.0 软件对HmpA 蛋白的跨膜结构进行了氨基酸序列分析;利用SignaIP 5.0 Server软件对HmpA 蛋白的信号肽预测分析;通过NPS@SOPMA 在线分析软件对目的蛋白的二级结构进行氨基酸序列分析;采用ExPASy 的SWISSMODEL 蛋白质库,建立了HmpA 蛋白的三维结构同源模型;采用NCBI 中的CDD(Conserved Domain Database)数据库通过目的蛋白的氨基酸序列分析其结构域;在NetPhos 3.1 Sever 在线工具中利用目的蛋白的氨基酸序列来分析其磷酸化位点;采用ATRING 1.0 蛋白互作数据库分析与HmpA 相关蛋白。
2 结果与分析
2.1 亚克隆载体pMD19T-hmpA 的重组构建及鉴定
以副甲菌CMCC 50973 基因组为模板,PCR 扩增产物经1%琼脂糖凝胶电泳可见约1197 bp 的hmpA基因,见图1A。亚克隆载体pMD19T-hmpA经NdeI 和XhoI 限制性内切酶双酶切后,行1%琼脂糖凝胶电泳,可见切出的目的片段(图1B)。测序结果部分峰图见图1C,碱基序列与预期相符。表达载体pNdeI-hmpA经NdeⅠ和XhoⅠ的双酶切鉴定后,电泳结果如图1D 所示,可切出目的片段,表明该载体构建成功。
2.2 HmpA 蛋白的诱导表达
将重组pNdeI-hmpA质粒转入大肠杆菌BL21(DE3)后IPTG 诱导表达,蛋白电泳条带结果如图2A所示。诱导前泳道和诱导后泳道的对比发现,诱导后在40~50 kDa 间可见明显蛋白条带,说明目的蛋白诱导成功。在16 ℃条件下诱导过夜后,诱导后的pNdeI-hmpA/BL21(DE3)菌株超声破碎后,分别将离心上清及沉淀进行电泳,结果如图2B 所示,表明表达载体可同时表达可溶性与包涵体两种形式的目的蛋白,泳道4 是全菌超声破碎后的离心沉淀,泳道5 是超声破碎后的离心上清,两者比较发现沉淀中的目的蛋白条带比上清中的目的蛋白条带粗,以此推测低温诱导表达时,目的蛋白仍然主要以包涵体形式存在。
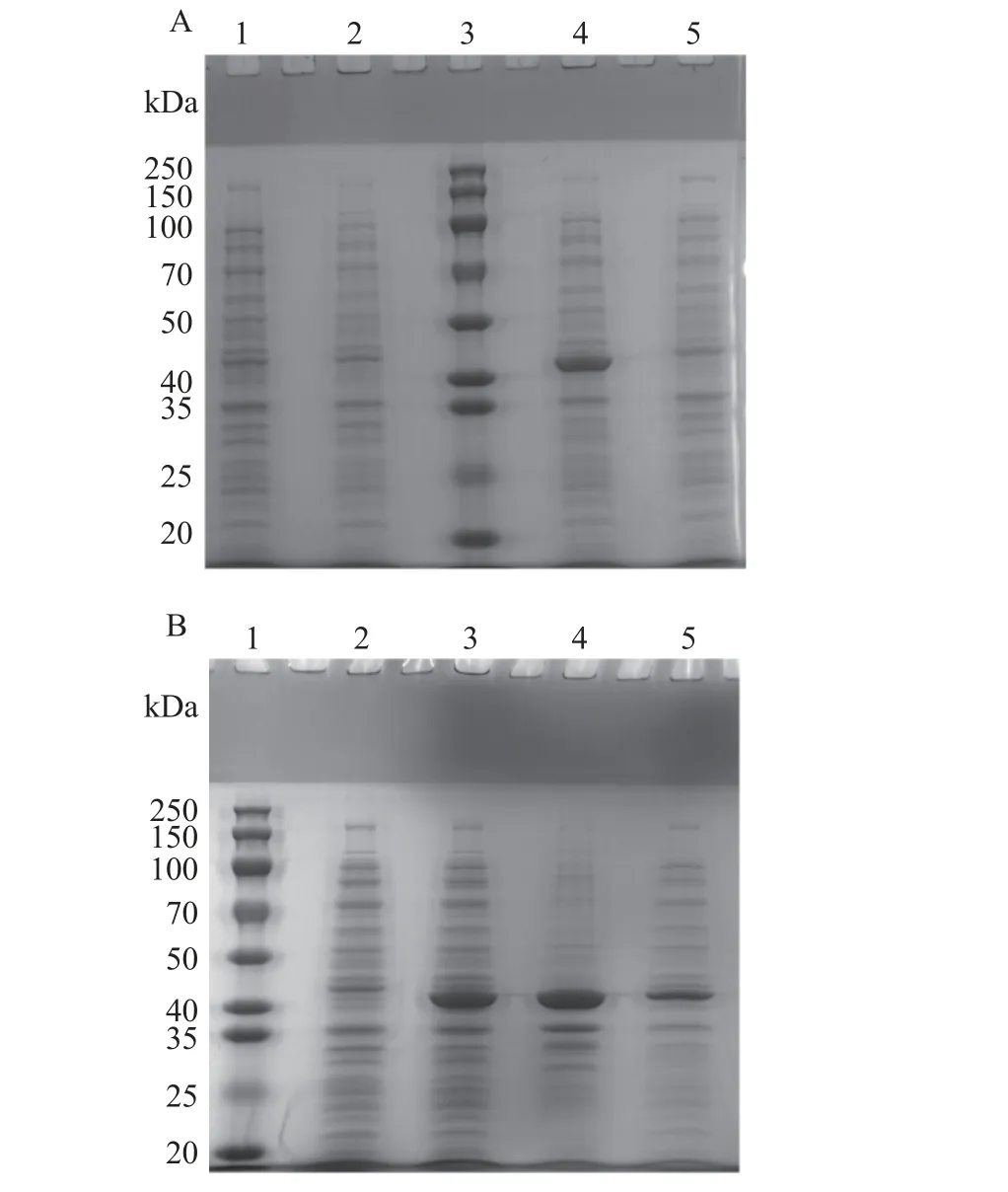
图2 重组菌的IPTG 诱导表达及HmpA 蛋白表达形式鉴定Fig.2 Protein expression of recombinated bacteria after IPTG induced and indentification of expression pattern of protein HmpA
2.3 HmpA 蛋白的纯化与Western blotting 鉴定
纯化后的蛋白进行SDS-PAGE 检测,结果如图3A 所示,纯化出的蛋白大小约为44 kDa。经Gel-Pro Analzer 软件分析,可溶性表达形式纯化后的目的蛋白纯度约97.3%,包涵体表达形式纯化后的目的蛋白纯度约71.7%。为了识别HmpA 重组蛋白条带,克隆设计时在hmpA基因下游添加了6 个组氨酸密码子,因此表达的HmpA 蛋白C 端带有6 个组氨酸标签(Histidine-tag,His-tag),如图3B 所示,纯化后的目的蛋白均可被抗His 抗体检测到。
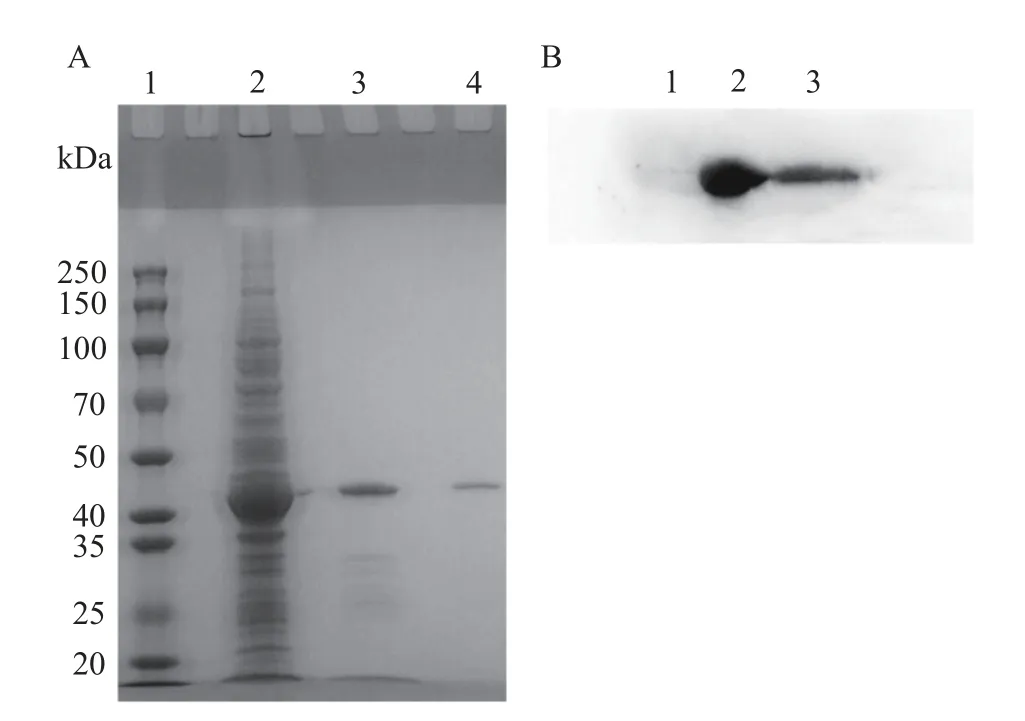
图3 SDS-PAGE 检测纯化后的HmpA 蛋白及Western blot 鉴定Fig.3 SDS-PAGE detection of purified HmpA protein and identification with Western blot
2.4 生物信息学功能分析结果
通过ExPASy 的ProtParam 软件对HmpA 蛋白进行了分子式预测,其分子式为C1976H3018N540O580S12,相对分子质量为44003.69,理论等电点(pI)为5.56,原子总量为6126;在哺乳动物细胞中的半衰期约为30 h,在酵母中>20 h,大肠埃希菌中>10 h。不稳定因子约为28.32,说明其稳定性较高(不稳定因子在40 以下提示蛋白质结构稳定性较好而大于40 提示蛋白质可能不稳定)[29];总亲水指数为-0.268,推测是亲水性蛋白;脂肪族指数为80.38(热稳定性较高)。结果还显示该蛋白含有396 个氨基酸,其中有4.3%的Ile(I);8.3%的Leu(L);1.5%的Trp(W),以及带正电荷的氨基酸残基(Arg+Lys,含碱性R 基的氨基酸)的数量为33 个,带负电荷的氨基酸残基(Asp+Glu,含酸性R 基的氨基酸)的数量为48 个。详细情况见表2。
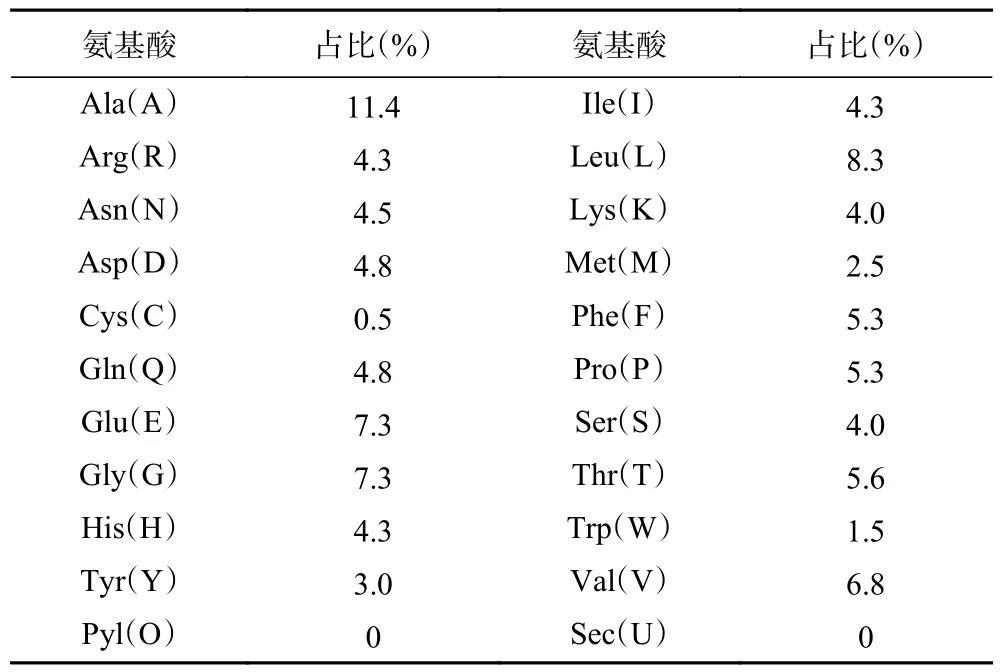
表2 HmpA 蛋白氨基酸占比Table 2 Percentage of protein amino acid of HmpA
利用Protscale 分析HmpA 蛋白亲水性,选用Kyte & Doolittle 模式计算方法,将亲水性与疏水性峰值分析图谱间隔设置为21,所得结果见图4。图中纵坐标分值大于0 表示疏水性强弱,纵坐标分值小于0 表示亲水性强弱。结果显示目标蛋白的第45 位氨基酸亲水性最强(分值为-1.948),第272 位氨基酸疏水性最强(分值为1.186),同时肽链的亲水区占比多于疏水区占比,提示目标蛋白为亲水性蛋白的可能性较大,这和ProtParam 预测的结果相同。
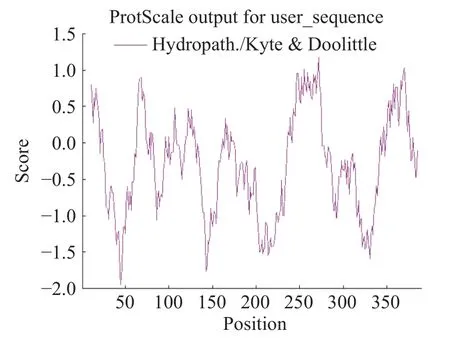
图4 HmpA 蛋白的亲水性分析Fig.4 Hydrophilic analysis of HmpA protein
通过TMHMM Server v.2.0 软件对HmpA 蛋白的跨膜结构进行了氨基酸序列分析,其中跨膜螺旋值趋于0,所以推测该蛋白没有跨膜区的结构(图5)。利用SignaIP 5.0 Server 软件对HmpA 蛋白是否存在信号肽进行预测分析(信号肽是引导蛋白质进行膜转移的小分子氨基酸,根据信号肽的存在与否,可预测蛋白是否为分泌型),结果显示HmpA 蛋白为Sec/SPI 信号肽的概率为1.22%,TAT/SPI 信号肽的概率为0.16%,Sec/SPII 信号肽的概率为0.1%,其他类型的概率为98.52%,综合上述结果,表明目标蛋白是分泌型蛋白的可能性很低(表3)。采用NCBI中的CDD(Conserved Domain Database)数据库通过目的蛋白的氨基酸序列分析其结构域,结果显示HmpA 蛋白含一个结构域,属于PRK13289 超级家族(图6)。
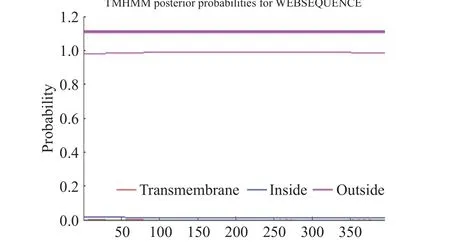
图5 HmpA 蛋白跨膜域预测Fig.5 Prediction of transmembrane domain of HmpA
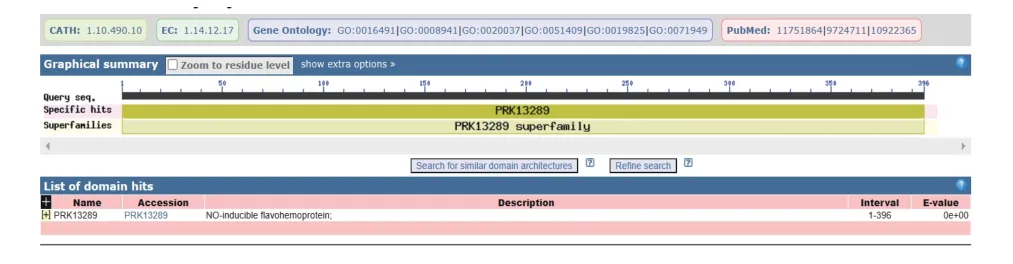
图6 HmpA 蛋白的结构域预测Fig.6 Prediction of structural domain of HmpA

表3 HmpA 蛋白的信号肽类型预测Table 3 Signaling peptide type prediction for HmpA proteins
通过在线软件NPS@SOPMA 对HmpA 蛋白的二级结构进行预测(图7),其中α-螺旋占42.17%,延伸链占16.67%,β-转角占4.8%,无规则卷曲占36.36%。HmpA 蛋白的三级结构通过ExPASy 的SWISS-MODEL 蛋白质库预测,模板序列为1gvh.1.A,序列相似度为91.16%,结果如图8 所示。
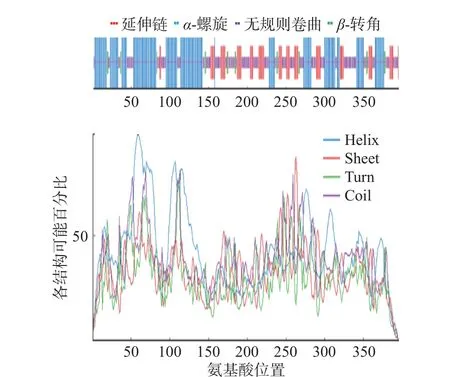
图7 HmpA 蛋白的二级结构预测Fig.7 Prediction of secondary structure of HmpA
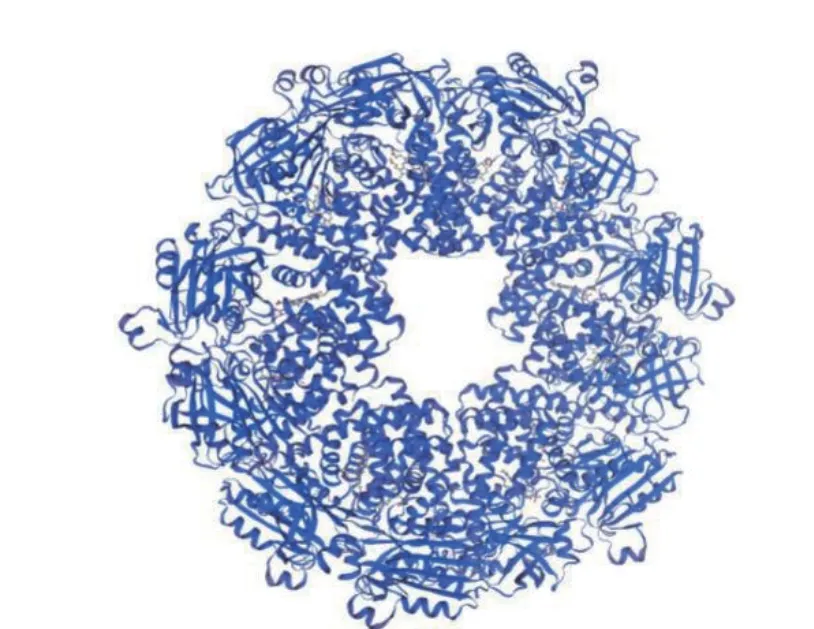
图8 HmpA 蛋白的三维模型Fig.8 3D model of HmpA
在NetPhos 3.1 Sever 在线工具中,利用目的蛋白的氨基酸序列来分析其磷酸化位点。结果显示HmpA 蛋白具有多个磷酸化位点,其中磷酸化能力超阈值有12 个丝氨酸(Serine),15 个苏氨酸(Threonine),5 个酪氨酸(Tyrosine),所以HmpA 蛋白共有32 个磷酸化位点(图9)。采用ATRING11.0 蛋白互作数据库预测与HmpA 蛋白相关蛋白,图中每个节点代表一个互作蛋白,若两个蛋白质之间存在相互作用,则以连线连接,连线的颜色反映了互作类型,包括试验验证或预测得到的,也包含直接物理作用、共表达、基因融合等关系[30]。结果显示,HmpA 在鼠伤寒沙门氏菌中的同源蛋白为hmp(hmp 蛋白在鼠伤寒沙门氏菌体内有氧过程中参与NO 解毒,从而被称为一氧化氮双加氧酶),与hmp 蛋白有较紧密联系的蛋白质有HTH 型转录抑制因子NsrR(参与细胞亚硝化应激基因激活的一氧化氮敏感抑制因子)、铁硫簇修复蛋白YtfE(参与修复被氧化和亚硝酸盐应激条件破坏的铁硫簇的含二铁蛋白)、细胞色素C 亚硝酸盐还原酶nrfA(催化亚硝酸盐还原为氨),其他还有同源蛋白DD95_08350 及在其他文章中一起被提及的thiD、thiG、hemE、hcp 等与细菌NO 解毒途径有关的转录因子和酶[31-33],据此推测HmpA 蛋白的功能与副甲菌降解宿主产生的杀伤性NO 机制通路密切相关(图10)。
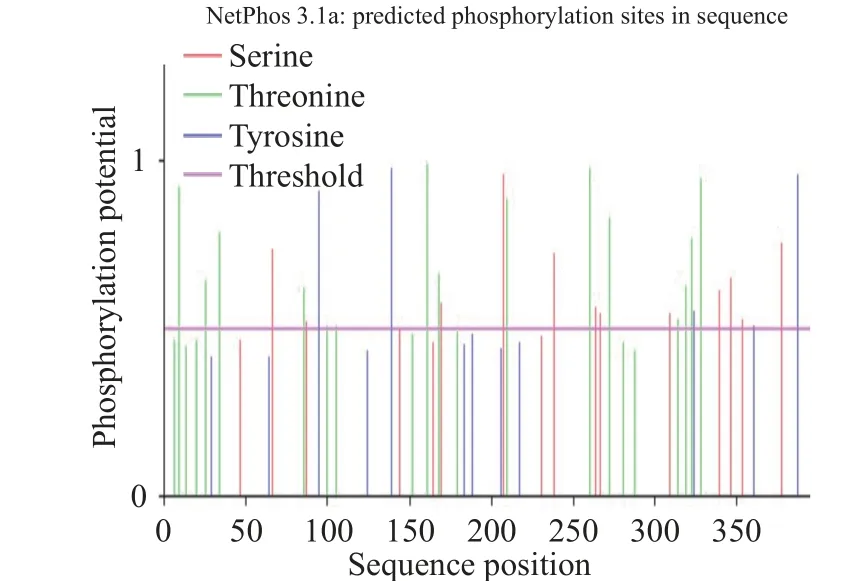
图9 HmpA 蛋白的磷酸化位点预测Fig.9 Prediction of phosphorylation site of HmpA
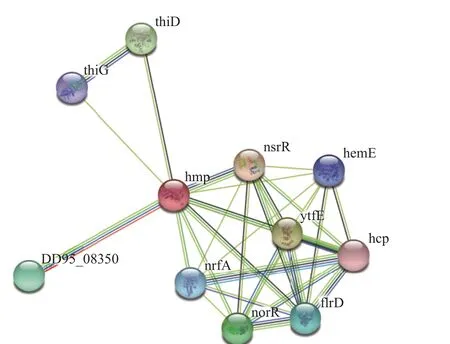
图10 HmpA 蛋白的互作蛋白预测Fig.10 Prediction of interacting protein of HmpA
3 结论
本研究成功构建了pNdeI-hmpA原核表达载体,转入BL21(DE3)后经IPTG 诱导、亲和层析法纯化可得到重组蛋白。生物信息学分析结果显示HmpA蛋白为亲水性蛋白,无信号肽、跨膜区域;属PRK13289超级家族蛋白;二级结构较松散,主要由α螺旋与不规则卷曲构成;含有多个磷酸化位点,与副甲菌体内降解NO 的多种酶、多肽及转录因子等关联,初步验证了HmpA 蛋白与副甲菌NO 解毒途径有关,但关于该重组蛋白的体外NO 降解活性、在副甲菌体内产生的机理途径,以及同宿主细胞的抗原抗体反应分子机制在研究中均未涉及。后续研究将对HmpA 蛋白的体外活性及其对宿主免疫细胞功能的影响做进一步探究,以分析该蛋白在副甲菌感染过程中所起到的作用,为副伤寒疾病的治疗及副甲菌的防治提供帮助。
生物信息学分析结果显示HmpA 蛋白为亲水性蛋白,但实验结果显示诱导的目的蛋白既有包涵体形式又有可溶性形式,这提示我们在典型的大肠杆菌原核表达系统中,蛋白的两亲性跟目的蛋白的表达形式可能不是互相对应的。本实验所用到的载体是基于T7 RNA 聚合酶及其强启动子之间的特异性和转录高效性建立,该系列载体诱导目的蛋白表达,同时将大量菌体内资源用于高效率的蛋白表达,且蛋白产量极高。因此在诱导时由于细胞内肽链合成过快却来不及正确折叠进而不能形成天然构象蛋白。同时影响外源基因在大肠杆菌系统中表达的因素还包括目的蛋白的分子质量、培养条件的控制(温度的选择和诱导及培养的时间)、密码子的选用等。后续实验将从表达载体的选取、诱导表达条件的优化等方面改善以提高HmpA 蛋白的表达效率。

