PITC 柱前衍生-高效液相色谱法测大米肽中的16 种氨基酸含量
黄 莹,黄 晶,杨 晓,陈 曦,胡武瑶
(中国健康促进基金会抗衰老营养与健康研发中心,湖北武汉 430000)
大米肽是以大米蛋白为原料,经过酶解得到一类含有肽混合物及少量的游离氨基酸、糖类、水分和无机盐等的物质。大米肽具有抑制酪氨酸酶活性[1]、调节免疫力[2]、抗氧化[3]和降血压[4]等功能。大米肽的氨基酸构成模式与人体需求模式基本一致[5],可以为人体提供所需的各种必需氨基酸。氨基酸分析是研究各种肽类物质构造、特性和营养价值的重要手段[6]。并且,大米肽的活性与其氨基酸的组成和含量紧密相关[7]。因此,分析大米肽中氨基酸的含量,对大米肽的品质评价和开发利用等均具有重要意义。
目前,测定氨基酸的检测方法有直接测定法和间接测定法,直接测定法有液相色谱-串联质谱法和离子色谱-积分脉冲安培法[8];间接测定法有柱前衍生法和柱后衍生法。其中,使用最为广泛的就是柱后衍生法[9],是采用氨基酸分析仪测定氨基酸的经典方法,该方法前处理主要是采用酸水解法,但该处理方法时间较长(为22 h 左右),同时仪器设备较为昂贵,仪器的应用主要集中在测定氨基酸的领域[10];柱前衍生(高效液相色谱法)则无需专一设备,灵敏度高、分析时间短、仪器的适用性更广[11],被认为是经典氨基酸分析技术的一种替代技术[12]。柱前衍生常用试剂有邻苯二甲醛(O-phthalaldehyde,OPA)[13]、6-氨基喹啉-N-羟基琥珀酰亚胺基氨基甲酸酯(6-Aminoquinolyl-N-hydroxysuccinimidyl Carbamate,AQC)[14],2,4-二硝基氯苯(2,4-Dinitrochlorobenzene,DNCB)[15]和异硫氰酸苯酯(PITC)等[16]。这些衍生试剂中PITC 与氨基酸反应迅速、产物单一稳定、衍生后易除去多余试剂且不会影响检测灵敏度[17],已被广泛应用于胶原蛋白肽[18]、黄酒[19]、烟草[20]、水果[21]、药物[22]等领域中。目前鲜有关于大米肽中氨基酸含量采用柱前衍生-高效液相色谱法检测的报道,为了证明该方法同样适用于大米肽中氨基酸的检测,并能够同时、快速、高效、稳定的完成16 种氨基酸的检测,因此本文拟建立一种柱前衍生化高效液相色谱法,以PITC 为柱前衍生剂,以期为大米肽的品质评价和开发利用提供技术支持。
1 材料与方法
1.1 材料与仪器
16 种氨基酸(天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、甘氨酸(Gly)、组氨酸(His)、精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、脯氨酸(Pro)、酪氨酸(Tyr)、缬氨酸(Val)、蛋氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)、赖氨酸(Lys))标准混合液、苯酚(分析纯)、异硫氰酸苯酯、三乙胺、三水乙酸钠、乙腈、甲醇、正己烷 其余均为色谱纯,上海安谱科学仪器有限公司;盐酸、冰醋酸分析纯,国药集团化学试剂有限公司;大米肽样品市售。
MTN-2800D-12 氮吹仪 天津奥特塞恩斯仪器有限公司;Agilent1260 高效液相色谱(High performance liquid chromatography, HPLC) ( ultraviolet detector,VWD) 美国Agilent 公司;202-2AB 电热恒温干燥箱 天津市泰斯特仪器有限公司;MS3digitial 涡旋振荡器 德国IKA 公司;PE20 型pH 计梅特勒-托利多仪器;AB204-A 分析天平 上海梅特勒-托利多仪器公司;ZORBAXSB-Aq(4.6×250 mm,5 μm)色谱柱、AthenaAAA(4.6×250 mm,5 μm)色谱柱 上海安谱实验科技股份有限公司。
1.2 实验方法
1.2.1 混合标准溶液配制 分别精密量取16 种氨基酸混合标准溶液2.5 μmol/mL,用0.1 mol/L 的盐酸溶液稀释成1.25、0.5、0.25、0.125 μmol/mL 4 个浓度,2~8 ℃冷藏保存。
1.2.2 样品溶液制备 大米肽样品:称取大米肽样品80.00 mg 放入水解管中,加入含0.1%苯酚6 mol/L盐酸10 mL,将水解管中充入氮气2~3 min 后拧紧螺丝盖。将已封口的水解管放在165 ℃的恒温箱中水解1 h,取出冷却至室温。打开水解管,将水解液转移至100 mL 容量瓶内,用少量水多次冲洗水解管,水解液移入同一100 mL 容量瓶内,定容,过滤,除去初滤液后收集剩余滤液。准确吸取1 mL 滤液移入试管中,在60 ℃氮吹条件下吹干,用1 mL 超纯水完全溶解后转移至1.5 mL 离心管中,待衍生备用。
空白样品:除了不加入大米肽样品之外,空白样品的制备和大米肽样品的制备相同。
1.2.3 柱前衍生化 室温条件下,取氨基酸标准混合液或样液200 μL 置于1.5 mL 离心管中,加入0.2 mol/L异硫氰酸苯酯乙腈溶液100 μL、1 mol/L 三乙胺乙腈溶液100 μL,混匀,室温下放置1 h 后加入400 μL正己烷,漩涡混合器振荡5~10 s,静置10 min。吸取下层溶液200 μL 和800 μL 超纯水混合,过0.45 μm有机滤膜,得样品溶液,待进样。
1.2.4 色谱条件和计算方法 色谱柱:Athena AAA 4.6×250 mm,5 μm;柱温:35 ℃;流速:1.0 mL/min;检测波长:254 nm;进样量:5 μL;流动相A:甲醇:乙腈:水=20:60:20;流动相B:50 mmol/L 乙酸钠溶液;洗脱程序为:0~38 min:5%流动相A 和95%流动相B、39 min:49%流动相A 和51%流动相B、40~50 min:100%流动相A、51~60 min:5%流动相A 和95%流动相B。
计算公式如下:
As 表示氨基酸s 的含量,%;Xs 表示氨基酸s 的峰面积带入相应曲线后计算出的氨基酸s 的浓度,μmol/mL;Ms 表示氨基酸s 的分子量,g/mol;0.001 表示单位换算系数;m 表示样品的质量,g;V 表示定容体积,L;N 表示浓缩倍数。
1.2.5 方法学考察 从线性关系、专属性实验、精密度实验、重复实验性、稳定性实验和加标回收实验对该方法进行方法学考察。
1.3 数据处理
采用Microsoft Excel 2016 进行数据统计,并利用SPSS 21.0 软件进行显著性分析(P<0.05),每组实验进行3 次平行,实验结果以平均值表示。
2 结果与讨论
2.1 色谱柱的选择
ZORBAXSB-Aq 色谱柱最适用于增加难以分离的酸性,碱性和极性化合物的保留值,其保留作用比许多传统的C18 HPLC 柱要强,该柱子具有亲水性的表面,及时采用100%的水溶液流动相,也可以有效的防止固定相的塌陷,因此该柱子作为一种实验室常用的HPLC 分离柱。Athena AAA 色谱柱是一种应用于生物发酵液、饲料、氨基酸注射液、食品、饮料中的氨基酸检测的专用柱,具有分离性能优,重现性好,适应性强,稳定性好的特点。
本实验先采用ZORBAXSB-Aq 色谱柱进行氨基酸混合标准品中氨基酸的分离,发现分离效果较差,为了将各个氨基酸完全分离出来,而后采用了Athena AAA 色谱柱进行分离,实验对比结果由图1可以看出,采用Athena AAA 色谱柱的分离效果优于ZORBAXSB-Aq 色谱柱的分离效果:a.分离度高。Athena AAA 色谱柱能将16 种氨基酸完全分离出来,ZORBAXSB-Aq 色谱柱并没有将第13 号和第14 号氨基酸分离出来;b.分离时间快。Athena AAA 色谱柱分离16 种氨基酸在39 min 分钟全部完成,ZORBAXSB-Aq 色谱柱则需要41 min;c.精密度高。两款柱子在分离同一浓度的氨基酸混合标准品时,Athena AAA 色谱柱分离得到各个氨基酸的峰高均高于ZORBAXSB-Aq 色谱柱分离得到的各氨基酸的峰高。因此后续实验采用Athena AAA 色谱柱对大米肽中氨基酸进行分离。
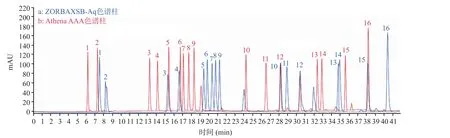
图1 ZORBAXSB-Aq 色谱柱(a)和Athena AAA 色谱柱(b)分离的色谱图Fig.1 Chromatogram of separation between ZORBAXSB-Aq column (a) and Athena AAA column (b)
2.2 线性关系考察
以混合标准液的浓度为横坐标,其衍生物峰面积为纵坐标,绘制标准曲线,根据信噪比(S/N=3)和(S/N=10)分别确定出检出限(LODs)以及定量限(LOQs)。结果见表1,16 种氨基酸在0.125~2.5 μmol/mL 的范围内的线性关系良好,其中14 种氨基酸的决定系数R2均≥0.9999,另外2 种氨基酸的决定系数R2分别为0.9998 和0.9994,检出限为0.003%~0.018 %,定量限为0.010%~0.059 %,表明仪器灵敏度高,较低质量浓度的氨基酸即可被进行检测。傅博强等[23]采用6-氨基喹啉基-羟基琥珀酰亚胺基甲酸酯柱前衍生-超高效液相色谱测定转基因大米中氨基酸的含量,发现17 种氨基酸标准工作曲线的线性回归决定系数均大于0.999,这与本实验发现大米肽中各氨基酸的线性关系良好相一致,说明采用柱前衍生-高效液相色谱法适合测定大米肽中的氨基酸含量。
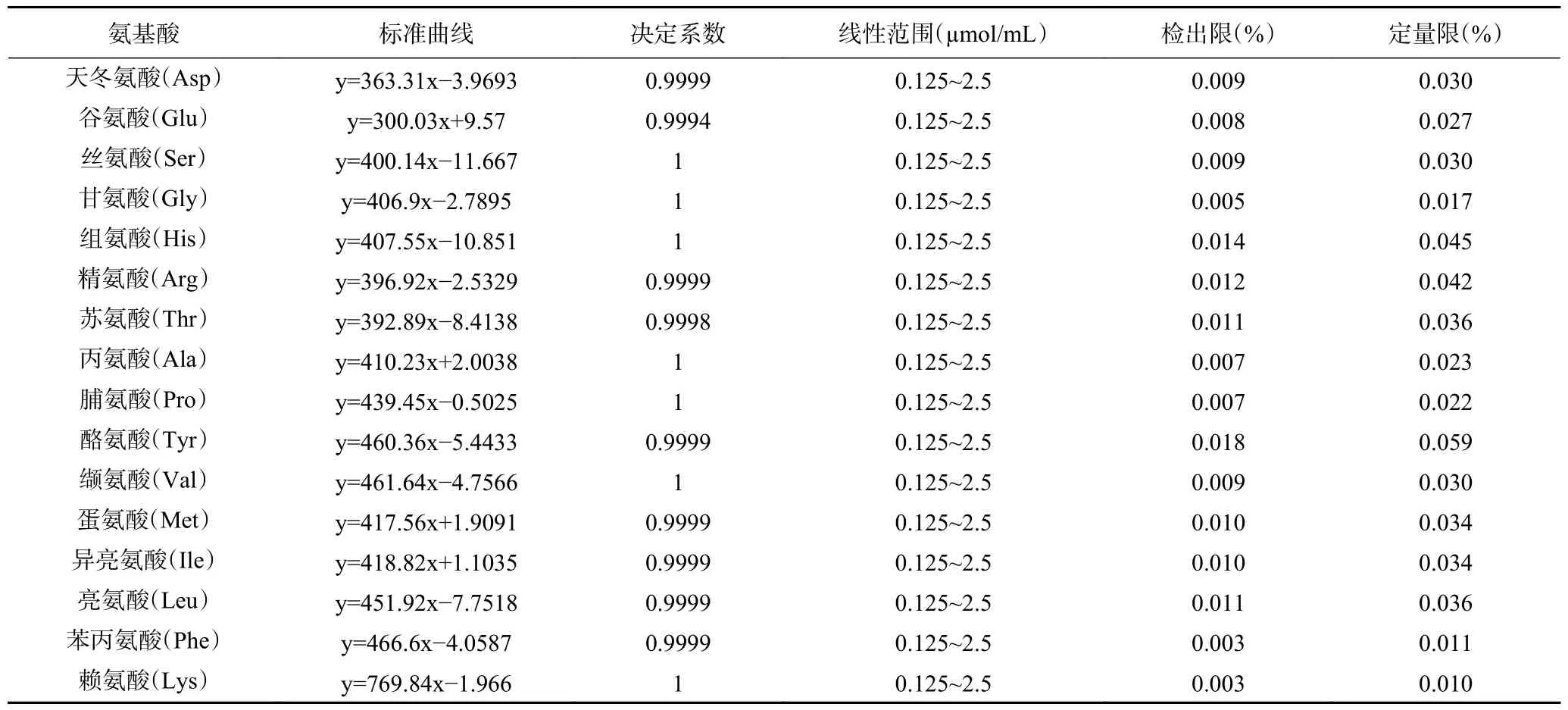
表1 16 种氨基酸的线性方程Table 1 Linear equations of 16 amino acids
2.3 专属性实验
取大米肽样品、16 种氨基酸混合标准品和空白样品进样测定。结果空白样品中未出现干扰主峰测定的色谱峰,供试样品与对照样品溶液色谱中,氨基酸峰保留时间一致,各氨基酸间分离度大于1.5。其色谱峰见图2。
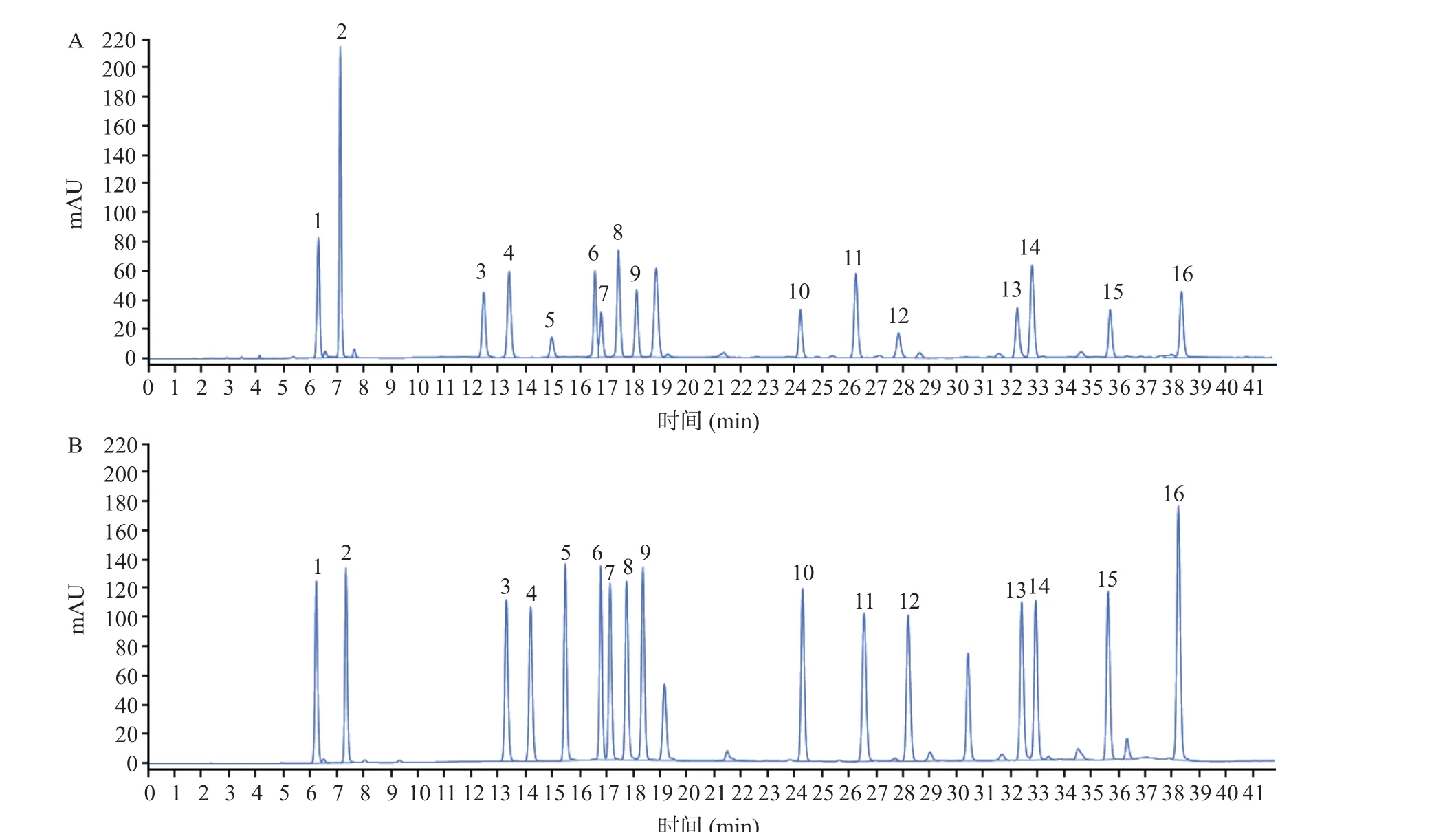
图2 供试样品(A)、混合标准品(B)、空白样品(C)色谱图Fig.2 Chromatogram of test sample (A), mixed standard (B) and blank sample (C)
2.4 精密度试验
精密吸取2.5 μmol/mL 氨基酸混合标准溶液,衍生后连续进样6 次,测定各种氨基酸的峰面积并计算其RSD,结果如表2 所示,16 种氨基酸的RSD均<5%,表明该仪器精密度良好。

表2 16 种氨基酸的加标回收率Table 2 Recovery rates of 16 amino acids
2.5 重复性试验
取6 份同一大米肽样品80.00 mg 分别放入6 个水解管中,按1.2.2 和1.2.3 进行样品水解和衍生,制备6 份衍生样品进样,测定各种氨基酸的峰面积并计算其RSD,结果如表2 所示,16 种氨基酸的RSD 均<5%,说明该方法重复性良好。
2.6 稳定性试验
取同一大米肽样品80.00 mg,按1.2.2 和1.2.3进行样品水解和衍生,制备1 份衍生样品,在衍生后0、2、4、8、12、24 h 后进样,测定各种氨基酸的峰面积并计算其RSD,结果如表2 所示,16 种氨基酸的RSD 均<5%,表明衍生样品在衍生后24 h 内稳定性良好。
2.7 加标回收试验
称取同一大米肽样品80.00 mg(已知氨基酸含量)6 份,分别进行水解,其中2 份样品用于样品浓度测定,3 份用于加标回收实验浓度测定。加入2.5、1.25、0.5 μmol/mL 的氨基酸标准混合液,每个浓度分别进行3 次衍生平行。计算平均加标回收率和RSD,结果如表2 所示,结果表明各组分的平均加标回收率为82.21%~103.59%,RSD 均<5%,说明该方法精密度良好,准确度高。
2.8 样品测定
精密称取5 份不同厂家的大米肽样品,编号为样品1~样品5,采用上述优化方法进行进样测定,16 种氨基酸的含量见表3。从表3 的结果可以看出,5 份大米肽均含有较高含量的Glu 和Asp,其次是Arg 和Leu,这与周侃等[24]的研究结果相似,均为这几种氨基酸含量较高。Glu 是生物机体内氮代谢的基本氨基酸之一[25],可促进氮基丁酸的合成,从而降低血氮,促进脑细胞呼吸[26]。Asp 具有防止和恢复疲劳的作用[27]。Arg 是维持婴幼儿生长发育必不可少的氨基酸[28]。Leu 具有抗氧化的作用[29],这也进一步说明大米肽具有抗疲劳、抗氧化等生物活性离不开这些氨基酸的作用。同时王申等[30]采用柱后衍生高效液相色谱法测定大米中氨基酸的组成,发现大米肽中氨基酸含量最高的也是Glu,其含量为16.1%;其次含量高的也是Asp,为8.44%,与本实验采用柱前衍生-高效液相色谱法测定五种大米肽中最高氨基酸的含量相一致,说明柱前衍生-高效液相色谱法适合测定大米肽中的氨基酸含量。
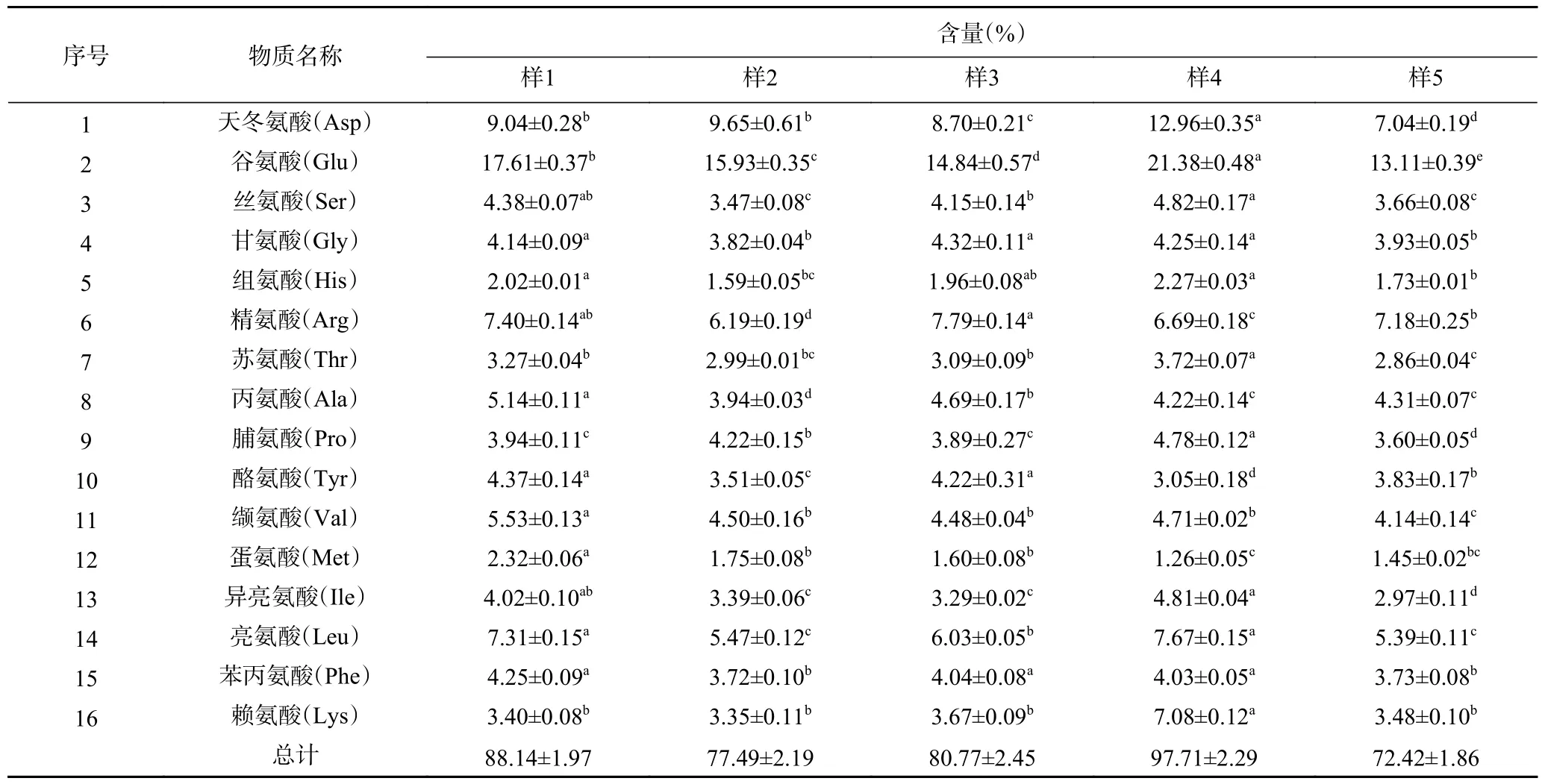
表3 不同厂家大米肽的氨基酸组成和含量Table 3 Amino acid composition and content of rice peptides from different manufacturers
精密称取某个厂家的大米肽样品2 份,编号为样品6,分别采用传统的国标方法氨基酸分析仪和PITC 柱前衍生-高效液相色谱法测定氨基酸含量,其检测结果如表4 所示。结果发现,16 种氨基酸中,同一种氨基酸分别采用两种方法测定的含量之间无显著性差异,氨基酸分析仪测定的氨基酸总量为80.58%±1.32%,PITC 柱前衍生-高效液相色谱法测定的氨基酸总量为81.62%±1.15%,也无显著性差异,说明柱前衍生-高效液相色谱法适用于测定大米肽中氨基酸的含量,且准确度较高。
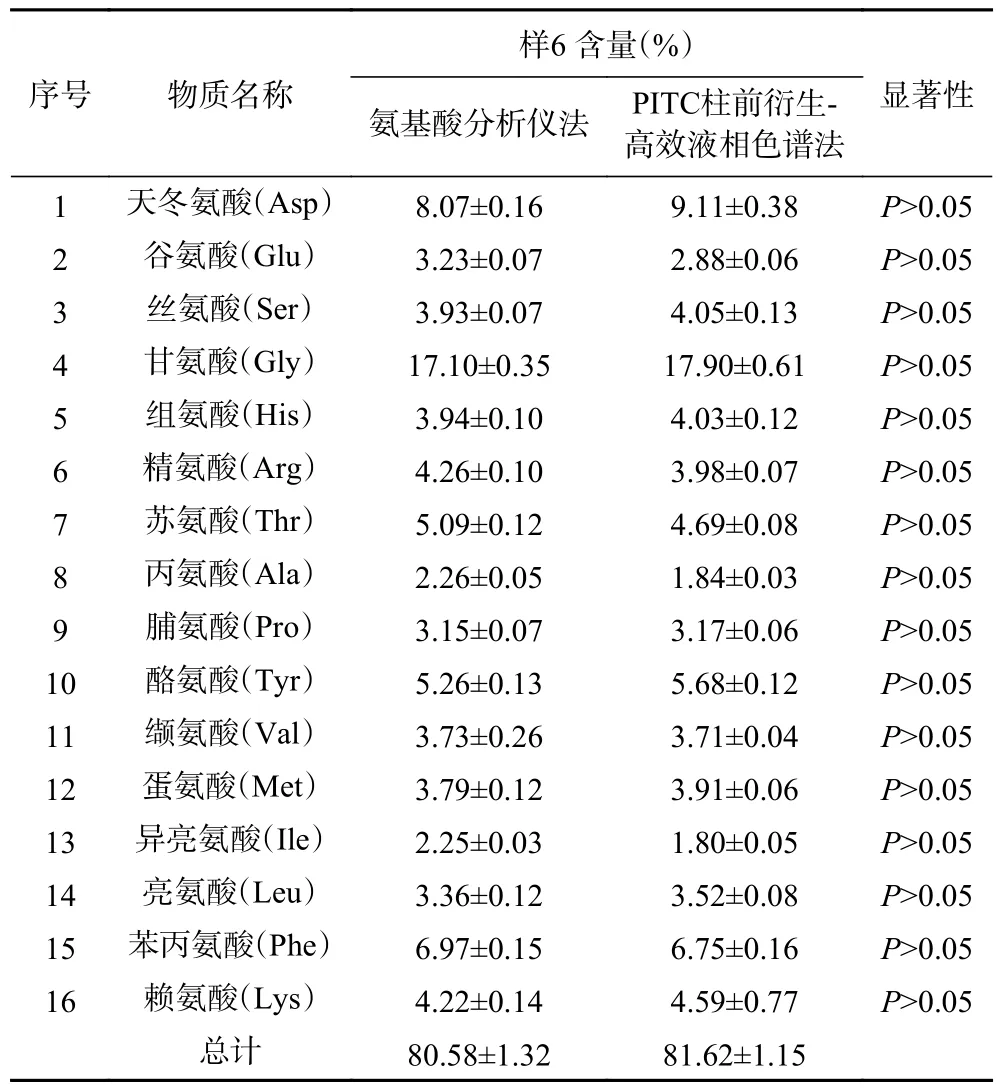
表4 不同方法测定大米肽的氨基酸组成和含量Table 4 Determination of amino acid composition and content of rice peptides by different methods
3 结论
本实验构建了PITC 柱前衍生高效液相色谱法测定大米肽中的16 种氨基酸含量的方法,该方法能有效分离16 种氨基酸,各氨基酸组分的线性范围较宽,均在0.125~2.5 µmol/mL 范围内,呈良好的线性关系,14 种氨基酸线性关系的决定系数R2≥0.9999,另外2 种氨基酸的决定系数R2分别为0.9998 和0.9994,检出限为0.003%~0.018%,定量限为0.010%~0.059%,加标回收率在82.21%~103.59%,RSD 均小于5%。说明方法精密度好,准确度高,适用于大米肽的氨基酸含量分析,为后续大米肽的氨基酸含量测定提供理论基础和技术支持。

