低共熔溶剂在植物多糖提取中的应用研究进展
刘 伟,王晓雨,周玉溪,徐 恒,张 恒,曹 云,侯旭杰,裴龙英,*
(1.塔里木大学食品科学与工程学院,新疆阿拉尔 843300;2.新疆理工学院食品科学与工程学院,新疆阿克苏 843000)
多糖一般是指由10 个或者10 个以上的单糖通过糖苷键连接而成的大分子物质[1],其广泛存在于人们日常食用的谷物、果蔬、食用菌和中草药中。食源性多糖由于诸多保健和药理功能活性,在近几十年逐渐成为天然产物研究中的热点,现已被应用于食品、饮料、医药和化妆品等领域的研究和应用中[2]。植物资源是人类生存和发展的重要基础,其中食用植物和药用植物是我们日常生活中最重要的植物资源。随着近年来中医药和保健食品的快速发展,大量植物源特别是中草药中活性物质及功效研究更加深入,其中以植物多糖研究最为广泛。现代研究已经证实中草药中的多糖是其重要的功效物质[3],因此通过提取植物中的多糖对其结构及活性进行深入研究,对于中医药的现代化发展及食药同源战略具有重要意义。
传统植物多糖提取主要采用水提法、酸提法和碱提法等,水提法操作简单、成本较低,但提取时间长且提取率较低,酸碱提法常用于含有酸性基团或酸性多糖提取,可以促进多糖溶解、缩短提取时间,不过容易破坏多糖的糖苷键和空间结构。当前基于传统溶剂的辅助提取方法包括酶辅助提取、超声辅助提取、微波辅助提取、亚临界提取和超临界提取等,这些辅助方法使得提取效率显著提升[4],同时也伴随着多糖的降解和更高的提取成本。随着多糖的研究不断深入,高效、安全、绿色的多糖提取方式是其低能耗与高应用价值的重要前提,传统溶剂提取法主要以水、盐酸、硫酸、硝酸、氢氧化钠和乙醇等作为溶剂,通常需要较大的溶剂用量,提取过程容易造成溶剂的浪费且具有一定的安全隐患和环境污染问题。近年来,低共熔溶剂(low eutectic solvent,DES)因其较低的成本、优良的提取效果和可降解性被广泛研究。
DES 是指由一定量的氢键受体(Hydrogenbonded acceptor,BHA)和氢键供体(Hydrogen bond donor,BHD)按一定比例混合以后经过加热形成更低熔点的粘稠、透明液体,合成以后会形成强大的氢键网络,使多糖的体系溶解度变大并导致DES 具有较高的粘度[5],因此在提取过程中往往需要水的介入。2011 年首次在一些强耐寒动物(蠕虫、瓢虫、青蛙)体内发现该体系并命名为天然低共熔溶剂(Natural low eutectic solvent, NADES),主要是由糖类、氨基酸、有机酸、酰胺类和胆碱类衍生物组成[6](图1),在多糖提取研究中所使用的基本都是这类DES。相较于传统溶剂,DES 的生产成本低、合成方法简单、在提取过程中可以避免因过高的温度和不适的酸碱性对多糖结构和活性产生不利影响;其化学性质稳定且无毒无害易降解,被认为是传统溶剂和离子溶剂(ionic solvent,IL)的优良替代品。DES 作为新型绿色溶剂可多次重复提取仍保持稳定的理化性质[7],NADES 甚至可以直接作为添加剂或配方加入食品中,因此从食源性多糖的提取效率、产物纯度和安全性方面衡量都是较为理想的溶剂体系,在提取过程中加入一定的辅助条件可以显著提高提取效率,比如超声波、微波和酶辅助等,其中超声波辅助需要的溶剂量少且复现性好,应用最为广泛。不过目前基于DES 对多糖的提取工作仅限于实验室研究,难以通过合成大量DES 进行工业化提取生产。
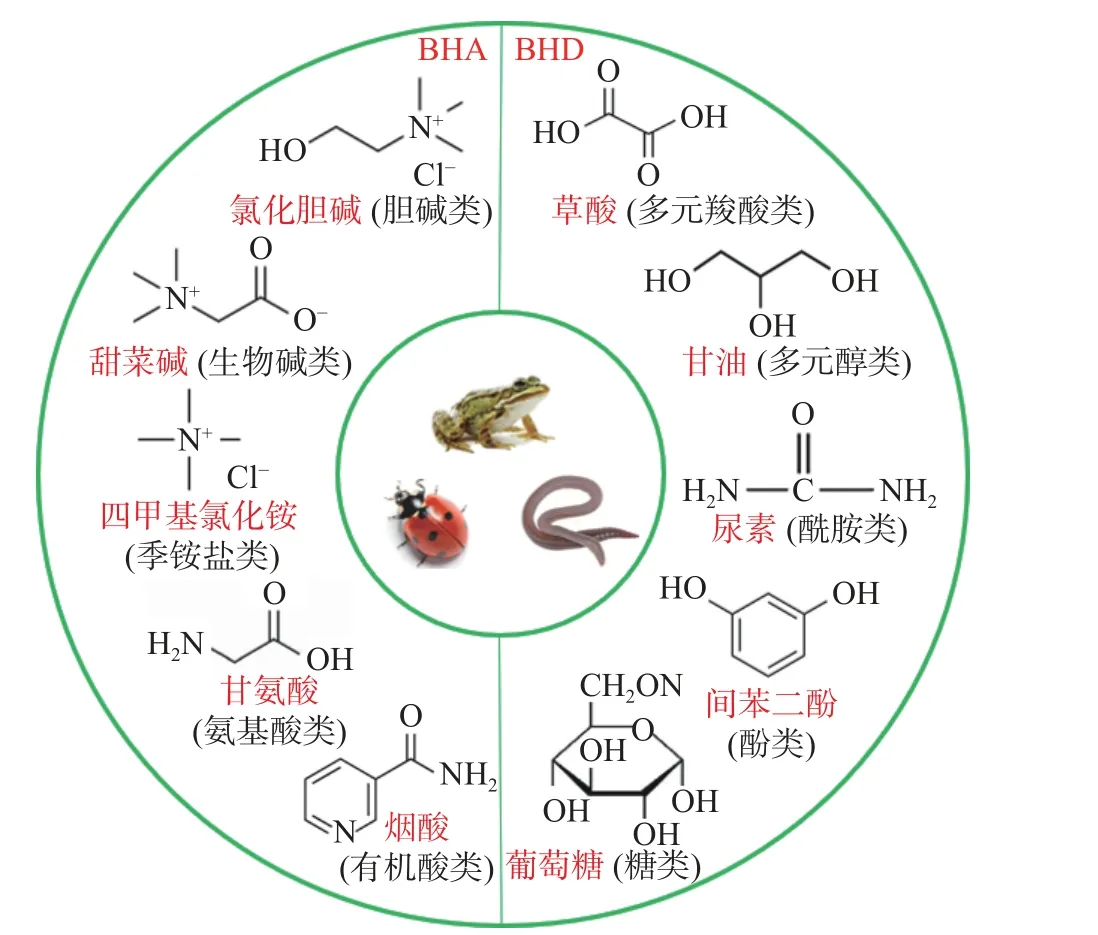
图1 常见BHA 和BHD 及类型Fig.1 Common BHA and BHD and their types
本文阐述了DES 的组成、合成方法和主要性质特点,探讨了DES 性质的主要影响因素,对该法在植物多糖及果胶类物质的提取研究进行了一定的总结,并分析了目前DES 应用的一些挑战及解决前景,以期为植物多糖的高效提取提供新的思路和理论基础。
1 低共熔溶剂概况
DES 是由一定摩尔比的氢键受体BHA(如季铵盐)和BHD(如酰胺、有机酸、糖类和多元醇等)组合而成的两组分或多组分混合物,熔点显著低于单个组分的熔点[8]。水本身较强的氢键效应可以作为重要的组成部分[9],氢键相互作用强度会直接影响DES的理化性质和和溶解性。在DES 中加入少量水,除了可以增大溶解度、调节pH 和粘度外,还具有缩短制备时间、降低制备温度等作用[10]。
加热法是制备DES 最简便的方法之一,将配制的DES 置于密闭容器在一定温度下加热,直至形成均一透明的溶液或胶体,经干燥后备用[11];研磨法就是将两组分或者多组分置于研钵中,在室温下充分研磨,最终形成澄澈的液体[12];真空蒸发法是将所有组分(粘度较大)都溶解在甲醇或者水溶液中,随后经真空减压蒸发除去溶剂,直至恒重[13];冷冻干燥法是将所有组分用超纯水稀释,达到含水量5wt%左右时,经真空冷冻干燥除去这部分水,获得透明胶体[14]。微波和超声波合成法是将所有组分混合物封装后经微波辐照或超声波处理,然后静置形成均匀稳定的体系,其中冷冻干燥法、蒸发法和研磨法操作简便,超声波和微波辅助合成法快速高效,因为微波辐射会与溶剂体系发生相互作用并引起偶极旋转,HBD 和HBA 组分发生碰撞产生介电加热,迅速升温显著缩短了合成时间;超声波产生的空化效应能够加速HBD 和HBA 组分之间的相互反应和溶解[15-16],具体合成操作如图2 所示。不过目前制备DES 最常用的方法还是加热搅拌,因为它易于操作且成本较低,在合成过程中更容易调节条件,这主要是考虑到一些热不稳定性组分的合成。
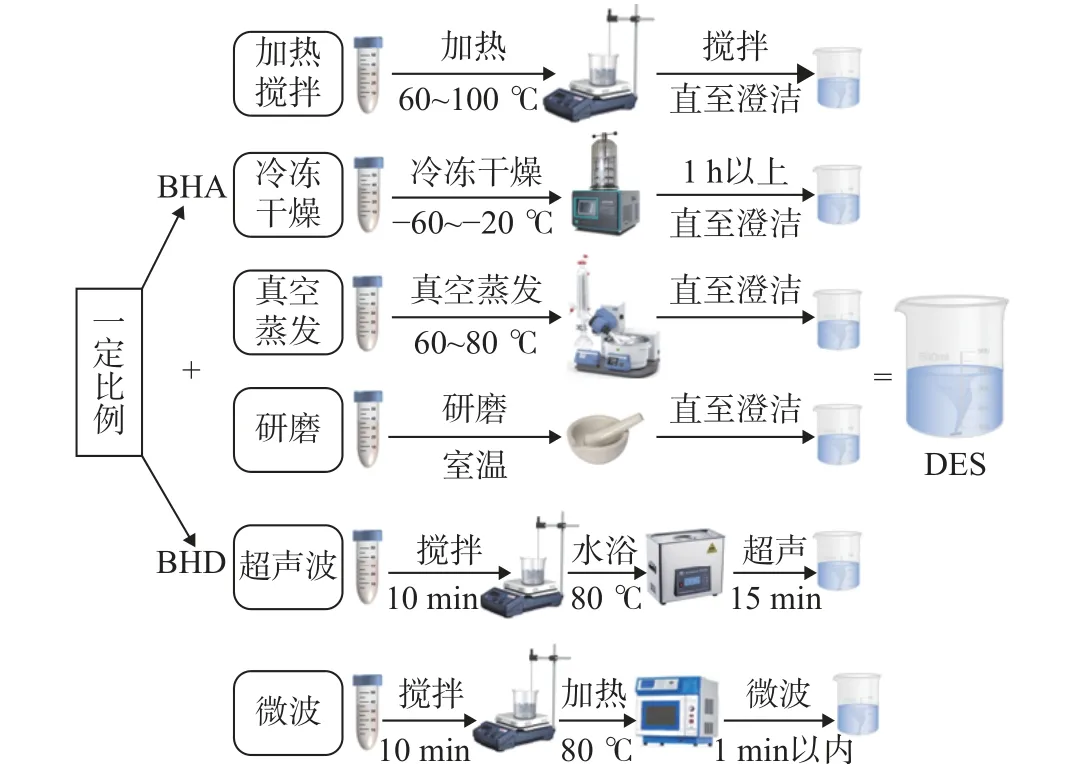
图2 DES 制备方法Fig.2 DES synthesis methods
2 低共熔溶剂的性质及其影响因素
2.1 低共熔溶剂的性质
DES 与IL 相比具有更特殊的性质,主要包括熔点、粘度、pH、毒性和生物降解性,而这些性质大部分可以通过改变溶剂的组分或摩尔比来调节,BHA和BHD 之间的氢键相互作用和范德华力是导致熔点降低的主要因素[17],所有DES 的熔点都显著低于单一纯组分,其中熔点低于50 ℃的DES 因其安全性和低成本被广泛研究应用。有研究发现BHD 的链长和摩尔比的上升对熔点影响相对较大,而且体系中的阴离子含量也会对熔点产生显著影响,这是造成胆碱盐类-尿素体系较低熔点的主要原因[18]。
DES 纯组分普遍具有较高的粘度,这种高粘度特性是广泛的氢键分布造成的[19],而高粘度则会阻碍流动、影响传质,因此粘度是多糖提取操作中重要的控制因素。使用高纯度的DES 直接提取多糖非常困难,而制备低粘度的DES 具有严苛的条件,因此需要加入一定量的水或升高温度来降低粘度、增大传质能力,但过少的氢键分布会造成DES 的稳定性变差,加入适量无机盐也可以有效降低DES 的粘度[20]。此外,DES 的酸碱性也是应用中非常重要的控制因素,BHA 和BHD 本身的酸碱性和比例就决定了DES 的酸碱性。Abbott 等[21]在氯化胆碱-甘油体系中加入一定量的氯离子后碱性增强,氯化胆碱-尿素体系也具有较强的碱性,而氯化胆碱与马来酸、柠檬酸组成的DES 表现为高酸性。Jablonsky 等[22]通过对体系pH 行为的研究发现,升温时pH 表现为线性降低,相较于醇基DES,酸基DES 的pH 的下降更为明显,进一步证明了BHD 对体系的pH 有更大影响。
Hayyan 等[23]首次提出DES 的毒性问题,分别研究了氯化胆碱与尿素、乙二醇、三甘醇和甘氨酸体系对部分细菌和小虾的细胞毒性,发现3 种DES对细菌并无毒性,但是对于小虾的毒性高于无机盐和HBD 本身,并且毒性在水中有所增强。DES 的细胞毒性取决于化学组成、浓度和黏度等因素,研究发现基于氯化胆碱的DES 的毒性普遍很低,但是基于一些金属盐物质的DES,对细菌和真菌都有很强的毒性[24]。大多数DES 在体内或体外对细菌、真菌、病毒和动物表现出无毒或低毒性,但仍不能认为是绝对的安全体系。此外,DES 的生物降解能力主要取决于组分,BHA 和BHD 本身较强的降解性会造成DES 的高降解水平,这使得NADES 的生物降解能力普遍高于其他类型的DES。氯化胆碱作为最常用的BHA,在14 d 即可降解93%左右[25]。Zhao 等[26]通过检测20 种不同的以氯化胆碱为BHA 的NADES的生物降解值,28 d 时氯化胆碱-尿素体系的降解性最好(97.1%),酸基相较于醇基体系的降解性整体较差,加入水的糖基三元溶剂的降解水平可以达到90%以上。Radosevic 等[27]研究了以氯化胆碱为HBA,甘油、葡萄糖和草酸为BHD 的溶剂毒性和降解能力,结果得到当HBD 为甘油和草酸时,最高和最低降解水平分别为96%和68%,而且毒性与降解性之间有很好的相关性。表明通过对DES 的合理选择和设计,在得到所需溶剂的良好性质以外,还可以控制溶剂更好的毒理学水平。
2.2 低共熔溶剂性质的影响因素
2.2.1 含水量 大多数低DES 是吸湿性混合物,很难实现完全干燥,在向DES 中添加水时,应考虑水的双重作用,因为水可以同时与HBD 和HBA 相互作用形成更多氢键,而含水量过多会迅速削弱体系的氢键作用[28]。Hammond 等[29]通过对氯化胆碱-尿素体系的水合物进行了微观表征,发现在较低含水量(42wt%)时,DES 的整体氢键作用有所增强,结构更稳定;而含水量较高(83wt%)时,DES 结构被破坏,取而代之的是水-水和DES-水相互作用,氢键作用急剧降低,溶剂变成了多组分的水溶液。Gabriele 等[30]研究了3 种醇基DES 加入水后的理化性质,得到少量的水可以降低粘度、增强导电性和极性,采用傅里叶红外光谱和核磁共振法研究了水对DES 纳米结构的影响,结果得到DES 的两个组分之间存在较强的氢键相互作用,加水至50wt%左右,这种相互作用逐渐减弱,随后的水添加导致这种相互作用将近消失,直到含水量达到75wt%左右完全消失。
DES 中氢键作用的减弱就会使粘度降低,从而改善提取时的物质流动状况,这会很大程度上提高溶剂的应用价值,在一定范围内,提取率与含水量成正比[31]。Dai 等[10]研究了氯化胆碱-葡萄糖(摩尔比5:2)体系,其粘度在含水量为5wt%时下降到纯溶剂的1/3,添加10wt%的水以后,粘度降到原来的1/10。还有研究发现,氯化胆碱-尿素体系在30 ℃条件下加入10wt%的水可以使粘度降低80%以上,水含量的增加导致DES 分子可以自由移动,流动性和扩散性都会增加;同时发现水的加入使得尿素-尿素、尿素-氯化胆碱的相互作用力明显下降[32],而且当尿素基DES 吸收空气中的水分以后(5.5wt%),其熔点降低了15 ℃以上[33],说明水会一定程度降低DES 的熔点,所以在DES 合成和应用时要考虑含水量对熔点的影响。
2.2.2 温度 温度主要影响DES 的粘度,随着温度的升高,DES 的粘度随着剪切速率的增加而降低,因为DES 在较高温度下具有较低的分子间作用力和膨胀、剪切效应,这对DES 的整体结构有一定破环作用,也使DES 的体系粘度趋向收敛于BHD 纯组分粘度[34]。Dai 等[10]进一步考察了葡萄糖、氯化胆碱和水(摩尔比为2:5:5)在20~60 ℃范围内制备的NADES 的粘度变化,当温度升高到原来的两倍时,粘度降低到原来的1/3。还有研究发现当温度从30 ℃升高到90 ℃时,氯化胆碱-木糖(摩尔比为1:1)体系的粘度从100 Pa·s 降低到0.5 Pa·s[35],而这种粘度变化对于活性物质的提取是更为有利的,表明DES 在较宽的温度范围内仍能保持较强的稳定性,这一优良性质使DES 的应用价值及潜能显著提高。
3 低共熔溶剂在植物多糖提取中的应用研究进展
3.1 在茶多糖提取中的研究
茶多糖是一种酸性糖蛋白,是一类蛋白质和多酚结合的具有生物活性的复合多糖,具有抗氧化和抗炎等活性。一般可以从茶的叶片、花和果实中提取得到,一般较为粗老茶叶中的多糖含量相对较高[36]。目前基于DES 对茶多糖的提取研究较少,Xia 等[37]将氯化胆碱分别与乙二醇、己二醇和1,4-丁二醇按摩尔比为1:2、1:2、1:4 制得3 种DES 提取安吉白茶中的多糖,经超声辅助提取得到氯化胆碱-1,6-己二醇体系提取率最高(19.18%)且抗氧化活性最好,比水提多糖表现更好的α-葡萄糖苷酶抑制力和降血糖活性,碳水化合物含量更高(72.67%)但分子量更低,这是由超声波诱导多糖分子气泡的形成和破裂产生的空化效应所致[38](图3)。不同的超声波频率、时间对于多糖的结构与活性的影响也并不相同,超声波对多糖的结构具有一定的破坏作用,但超声波处理一般能够显著提高多糖的提取效率。黄秀红等[39]以氯化胆碱和甜菜碱作为BHA 制备了6 种DES 提取乌龙茶多糖,其中甜菜碱-1,3 丁二醇体系的提取效果更好,与传统水提法相比,DES 提取的多糖得率、DPPH自由基和羟基自由基清除能力分别提高了20.22%、53.79%和32.65%,这对提高乌龙茶多糖的提取效率和抗氧化活性具有重要意义。
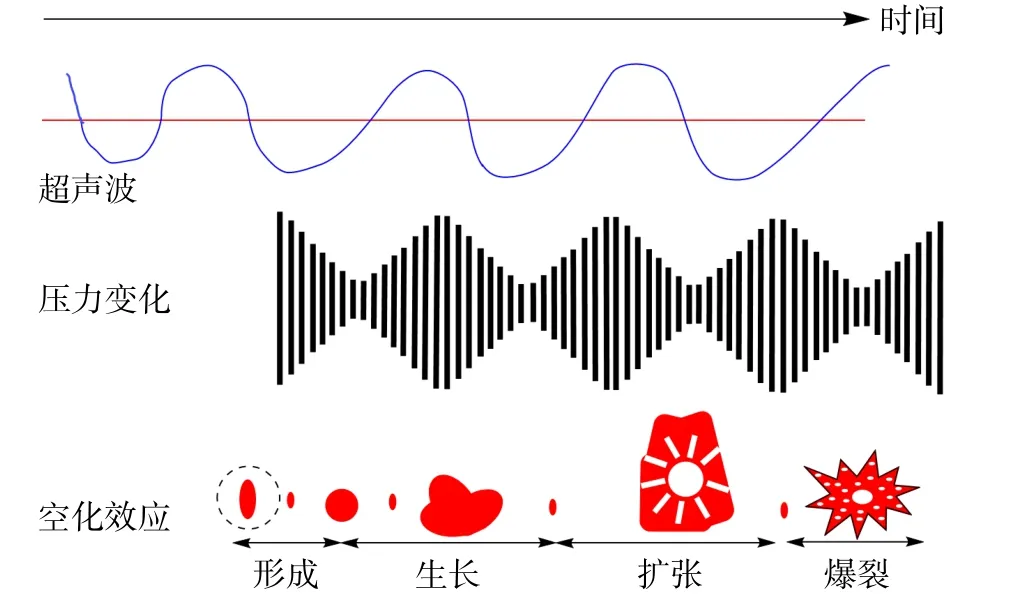
图3 超声波空化效应作用原理[38]Fig.3 Principle of action of ultrasonic cavitation effect[38]
3.2 在中草药多糖提取中的研究
中草药是我国体系的重要组成部分,具有悠久的历史和广泛的应用,现代医学研究表明,中草药的诸多药用功能都源于其中的天然活性成分,而多糖就是重要成分之一,因此安全高效的多糖提取方法是其药理作用研究的必要手段。铁皮石斛在我国具有很长的药用历史,具有提高免疫、增强体质、改善心血管疾病和降糖降脂等功效,多糖是铁皮石斛的主要活性成分,《中国药典》规定铁皮石斛多糖含量不得低于25%,多糖含量越高则石斛的质量越好[40]。梁静[41]使用19 种DES 加入复合酶(纤维素酶和果胶酶)提取铁皮石斛多糖发现,氯化胆碱-丙三醇体系提取率最高(42%),提取效果好于不加酶的纯DES 提取和传统热水提取法,所得粗多糖的纯度高达96.78%,这主要是由于酶对细胞壁的破坏作用促进了多糖的溶出,而有机强酸基DES 的提取效果并不理想,因为强酸会加速多糖的水解[42]。糖类物质也是DES 制备常用的BHD,有研究以紫皮石斛粉末中的多糖本身作为BHD,选择左旋肉碱作为BHA,基于低共熔溶剂系统(Low eutectic solvent system,DESys)结合化学机械法提取( chemical-mechanical extraction,MCE),在保留多糖理化性质的同时,DESys-MCE 的提取效率显著优于传统提取方法,且不需要提前合成DES[43],简化了多糖的提取和分离过程。先前的研究也证明DESys 比传统DES 提取更有效,而且提取时间很短,这会显著降低提取过程中的能耗[44]。
黄精是百合科黄精属草本植物的干燥根茎,其味甘性平,具有健脾润肺和补肾益气等功效,包括黄精在内的多种百合科黄精属植物都属于传统药食同源性中药材。唐兰芳[45]筛选了氯化胆碱-1,4-丁二醇体系作为黄精多糖提取溶剂,提取率约为水提法的4 倍,并且DES 提取多糖的ABTS+、DPPH 自由基清除能力、Fe3+还原能力、氧自由基吸收能力和抗糖基化能力均显著高于水提黄精多糖,氯化胆碱-尿素型DES 提取得到的黄精多糖也得到相同的性质且与质量浓度呈量效关系[46],该型DES 在重复提取第3 次时提取率最高,较新鲜溶剂提高了83.9%,而且黄精多糖含量随重复次数增加呈先增加后趋于稳定,重复提取4~5 次后多糖含量基本稳定,进一步结合超声酶解(纤维素和果胶酶)法提取柴胡多糖的研究也有类似发现[47],这是由于重复提取后DES 的物理状态改变,比新鲜DES 的流动性更强,对多糖分子的充分溶出与传质是更有利。
研究表明多糖的抗氧化和生物活性一般与提取条件、分子量大小和单糖组成有关[48]。刘旭等[49]进一步研究了不同温度条件下氯化胆碱-尿素型DES提取得到的黄精多糖的相对分子量和单糖组成等基本性质和体外抗氧化活性之间的关系,结果表明,相比于传统水提醇沉法,70 ℃时多糖得率最高为18%,提高了36%,相对分子量变小且半乳糖含量升高;提取的多糖相对分子量更小,且主要成分为葡萄糖,DES 在70 ℃条件下提取的黄精多糖体外抗氧化能力明显高于传统水提醇沉法(4.3 倍)和DES 在100 ℃条件下(7.4 倍)提取的黄精多糖,这可能与70 ℃条件下DES-多糖体系中较强的氢键效应和更低的分子量水平有关。尿素基DES 提取得到玉竹(百合科黄精属)多糖的提取率达到29.03%,是热水浸提法的4.67 倍[50],对糖基化终末产物(advanced glycation end products,AGEs)相对抑制率达到87.63%,AGEs的体内积累是引发糖尿病和其他慢性疾病的重要因素[51],从而揭示了该多糖在新型降糖保健食品的开发方面的应用潜力。酚酸和多糖是百合属植物中的主要活性物质,因其抗氧化活性和潜在的保健功效受到关注,Chen 等[52]采用氯化胆碱-乙二醇型DES 提取了卷丹百合(百合科)中多糖和酚酸类物质,实现了同时高效提取两种活性物质且提取时间显著变短,这种快速有效的提取方法有利于中草药主要成分的测定和质量评价,而乙二醇基DES 对于千斤拨多糖的提取效果较差,1,3 丁二醇基体系的提取效果更好,这主要是其内部空间位阻更小且醇基分支少,极性分布更适合于千斤拔多糖的溶解[53]。
近年来的深入研究表明多糖类物质是肠道微生物的有效调节因子,在保护宿主肠道微生态稳态中发挥关键作用,多糖可以通过增加肠道中的有益菌和减少有害菌来调节肠道菌群组成,改善菌群结构,参与肠道菌群的各种相互作用[54]。冯康琳[55]采用氯化胆碱-乙二醇型DES 提取得到了荷叶多糖,多糖在体外粪便发酵过程中被肠道微生物降解和利用,显著增加了拟杆菌属、双歧杆菌属、巨单胞菌属和柯林斯氏菌属等有益菌的相对丰度,并显著降低了变形菌门和梭杆菌门等有害菌的相对丰度,同时荷叶多糖能够显著促进短链脂肪酸的产生,表明该型荷叶多糖可以有效调节肠道菌群,可作为促进肠道健康的潜在益生元,还有研究分别采用水提法、中温碱提法、DES 提取法和高压均质辅助双酶法提取荷叶多糖发现,氯化胆碱-丙二醇体系提取率最高且与水提法相近,尿素基DES 的提取率显著低于其他方法,但是,水提法和尿素基DES 提取的多糖具有更好的益生元活性[56]。此外,经DES 复合酶(纤维素酶、果胶酶、木瓜蛋白酶)辅助提取得到枸杞子多糖对DPPH 自由基和羟基自由基有一定的清除能力,抑菌活性表明该多糖可以抑制大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的生长,特别是对大肠杆菌的抑制效果最好,表现为高敏感度[57],这为枸杞子在保健、药品领域的应用奠定了基础。
除此之外,研究发现,采用氯化胆碱-尿素体系提取结合分级醇沉法得到淮山多糖的提取率是水提法的5.11 倍,该法对多糖的抗氧化活性有一定弱化作用,但是对抑制α-淀粉酶和抗糖基化能力有一定增强作用[58],相同的DES 提取红枣多糖也能够显著提高提取率(2.46 倍)[59],不过对恰玛古多糖的提取率比水提法虽有所上升,但是提取效果不如碱提法和超声辅助提取法,可能是BHD 摩尔比太低导致体系氢键效应相对较低所致,尿素基DES 提取的恰玛古多糖主要在铁离子螯合力和α-淀粉酶抑制方面有更好的作用效果[60]。孙悦等[61]研究发现,尿素和甘油基DES 对甘草多糖的提取效果较差,异丙醇基DES 的提取效果更好,这可能是异丙醇分子更小的空间位阻所致。值得一提的是,在他们关于鹰嘴豆活性物质提取研究中发现,氯化胆碱-柠檬酸体系既可以高效提取其中的多糖,也可以提取黄酮类物质,多糖和黄酮提取率分别为8.31%和2.49%[62]。还有研究发现氯化胆碱-乙二醇型DES 可以同时提取得到五味子中的多糖和精油[63],这表明相同的DES 改变提取条件就可以高效提取不同样本中的多糖或者相同样本中不同的目标物质。不过,关于DES 对于不同天然产物都具有良好溶解性和提取选择性的内在机理并不明确。
尽管DES 在多糖提取方面具有良好的应用前景,但其不易挥发性也给多糖与溶剂的回收带来困难,新兴的可切换DES 可能具有解决这一难题的潜力,可切换DES 就是可以通过改变外界条件(温度、pH 和CO2等)实现亲疏水性的转变,控制提取过程为均相,提取结束以后为两相(水相和富含DES 组分),从而实现多糖的提取分离和溶剂的回收利用[64-65],其中关于温度切换型DES(temperatureswitchable DES,TS-DES)的研究相对较多,Tang等[66]从12 中TS-DES 中筛选得到丁卡因-月桂酸体系为提取枸杞多糖的最佳体系,最大提取率为465 mg/g,重复提取5 次以后提取率保持在430 mg/g以上,而且重复提取后DES 回收率达到80.5%。具体的茶和中草药多糖提取的DES 组成及工艺参数如表1 所示。
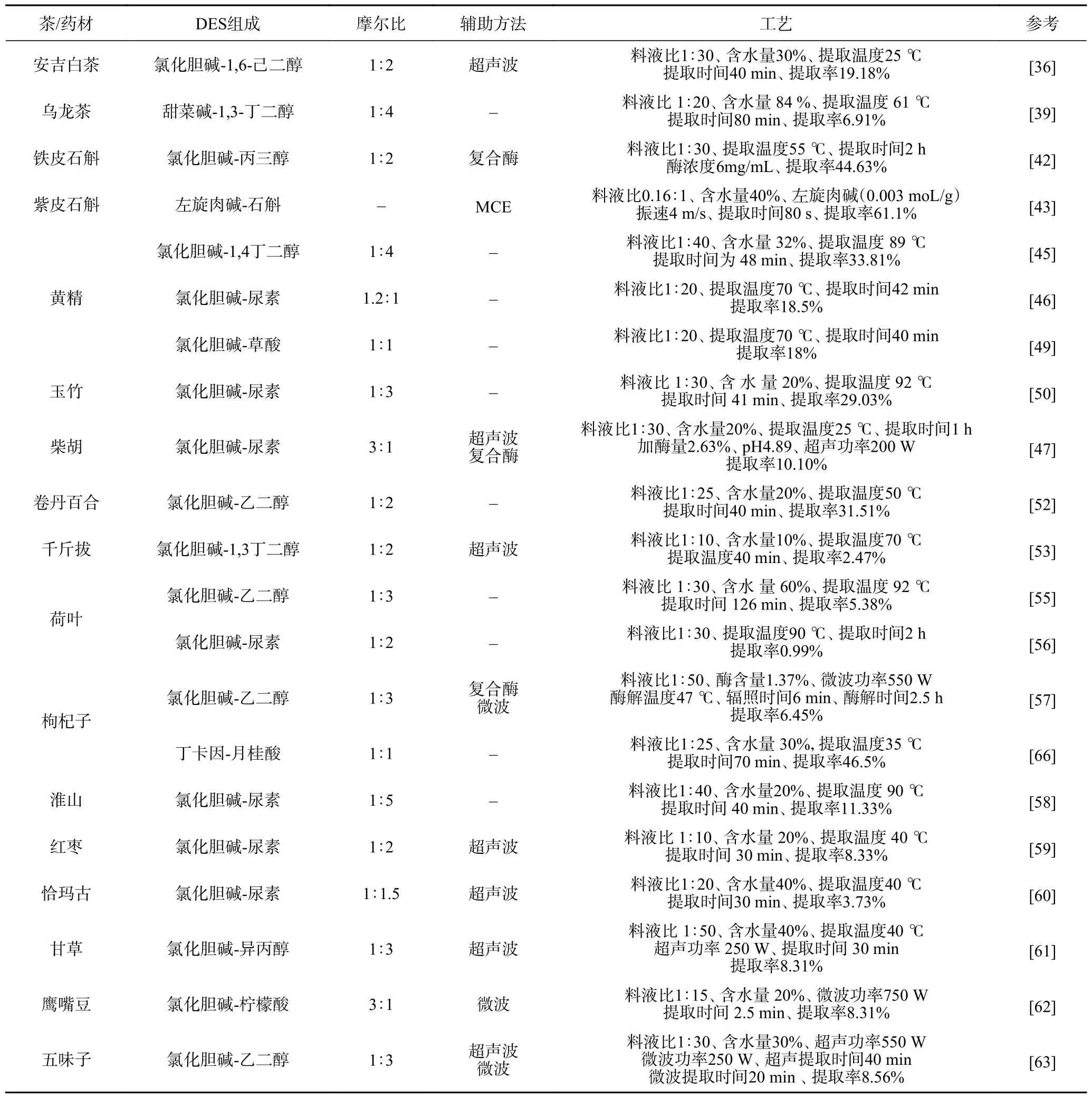
表1 DES 在茶和中草药多糖提取中的应用及工艺Table 1 Application and technology of DES in the extraction of polysaccharides from tea and Chinese herbs
3.3 在果胶提取中的应用
果胶是一种广泛存在于水果和蔬菜中的多糖,其组成有同质多糖和杂多糖两种类型,是植物细胞壁的重要组成部分,常作为酸性饮料的凝胶剂、增稠剂或稳定剂,除此之外,果胶可以调节肠道菌群的组成和多样性、预防动脉粥样硬化并抑制饮食诱导的肥胖[67]。果胶的理化性质和健康功能主要取决于其复杂的结构特征,其中水果皮层是植物果胶的重要来源之一。Chen 等[68]筛选出甜菜碱-柠檬酸和氯化胆碱-苹果酸体系,用于提取芒果皮果胶,果胶提取率分别为27.62%和30.01%,显著高于盐酸提取法(13.17%),高强度超声功率提高了低酯果胶的得率,但降低了提取果胶的分子量和粒径,这是由于超声空化作用能够打破果胶多糖的糖苷键,从而产生更多低分子量的果胶[69]。而盐酸提取的果胶比两种DES提取的果胶或商业果胶具有更高的粘度特性,这有助于研究者掌握提取条件与所提果胶理化性质之间潜在联系,从而根据不同的应用要求选择合适的提取方法。
DES 提取体系合成组分虽然具有广泛的选择性,但是只有极少部分经合成以后具有优良的提取效果,部分体系的提取效果也差于传统提取法,不同体系提取产物的理化性质也有一定的差异,因此在DES 的设计与合成时需要考虑组分本身与实验条件对果胶提取过程的影响。El-gharbawy 等[70]研究了超声辅助DES 在提取柚子皮中的果胶得率和酯化度(DE,degree of esterification)的影响,结果表明,氯化胆碱-丙二酸和氯化胆碱-葡萄糖-水为最佳提取体系,两种DES 的果胶得率均为94%左右,DE 均值为52%,与糖基DES 相比,酸基DES 提取的果胶结构形貌更光滑,丙二酸体系提取的果胶在产量和结构方面比葡萄糖基DES 更稳定,另有一些研究使用氯化胆碱-丙二酸体系高效提取了生育酚和花色苷类物质[71-72],表明该体系不仅可以高效提取果胶,也是其他各类活性物质提取的良好溶剂。Liew 等[73]采用檬酸法和乳酸-葡萄糖-水型DES 分别提取柚子皮果胶发现,DES 提取的果胶得率最高为23.04%,而柠檬酸提取的得率达到了39.72%,柠檬酸提取的提取效果显著优于DES 提取法,这是由于乳酸相对较弱的酸性和过量的水稀释削弱了体系氢键相互作用。研究发现,高温(≥80 ℃)相关酸性介质(pH 接近2)有利于打破果胶所在细胞壁所需的水解条件,从而促进果胶的溶出与传质[74],因此在提取植物果胶时,DES的设计应该选取酸性较强的有机酸且考虑提取温度对体系pH 的影响。
有研究比较了几种酸(有机和无机)在90 ℃下提取90 min 的甜瓜果皮果胶提取率,得到果胶在羧酸中的提取是更有利的,其中柠檬酸最适合甜瓜果皮果胶的提取[75]。Benvenutti 等[72]利用柠檬酸-葡萄糖-水体系提取了嘉宝果果皮中的果胶,发现该型DES 合成时间较短(50 min),具有较低的pH(1.01)和粘度(298 K 时为0.159 Pa·s),最高提取率为27.3%,比传统柠檬酸提取(9.7%)高出3 倍,进一步结合亚临界水提取法提取,在水中加入DES 作为提取改性剂,可以在更短的时间内实现更好的提取效果,这主要是在高压条件下DES 粘度的降低,促进体系传质导致的,提取率比传统水提法高1.5~1.8 倍,所得果胶的抗氧化能力和乳化稳定性都更强[76],说明具有低pH 的柠檬酸型DES 是提取果胶的良好溶剂,这也揭示了氯化胆碱-羧酸型DES 在果胶提取方面的潜力。
一般DES 的组分和摩尔比不仅会影响果胶提取率,而且改变果胶的一些理化性质和生物活性。Shafie 等[77]以不同摩尔比的氯化胆碱-柠檬酸体系提取了木胡瓜中的果胶,最大得率为14.44%,达到最高得率长达2.5 h,这是由于DES 溶液进入木胡瓜皮粉末中,逐步破坏细胞壁且溶解果胶,再从细胞壁扩散出来需要一定时间,体系的温度、pH 和粘度都会影响这一过程,提取得到的木胡瓜多糖是一种高纯度的酸性杂多糖,表现出良好的持水性(3.70 g/g),持油性(2.40 g/g)和起泡性(133.33%),可作为一种新的天然药理聚合物或潜在的功能性食品成分,进一步研究发现,不同摩尔比的DES 提取得到了不同分子支链结构的木胡瓜果胶,不同的多糖结构由于位阻效应影响了其溶解性、理化性质和功能特性,特别是增加DES 中一水合柠檬酸的摩尔比时,多糖的酸性和总酚含量有所增加,而这与多糖的抗氧化活性密切相关[78]。具体的果胶提取的DES 组成及工艺参数如表2 所示。
4 低共熔溶剂提取植物多糖的局限性
在大多数研究中,DES 提取法的提取率均显著高于传统方法,这主要是由于已经开发了一系列成熟DES 体系并优化了提取条件参数。在制备的DES体系中,只有少数具有较高的提取效率,而多数DES提取效果差的主要原因就是高粘度,目前,降低DES黏度的方法主要有两种,一是通过加入水、调节温度,虽然温度和含水量增加对粘度的改善作用显著,但是对氢键作用的削弱也非常明显,调节合适的含水量及温度来降低粘度需要大量的实验验证;二是开发低黏度体系,对DES 的组分要求很高,需要考虑离子尺寸及空腔大小进行设计[79],开发难度大,但仍是新型DES 潜力较大的研究方向。
当前基于DES 提取多糖的提取效果研究很多,但针对于特异性提取研究很少,提取样本中的物质较多,无法明确是对多糖的特异性提取,比如前文中提到,氯化胆碱-尿素型DES 对黄精、玉竹和淮山等的多糖都有很好的提取效果,而氯化胆碱-丙二酸体系不仅可以提取多糖和果胶,也可以提取得到生育酚和花色苷类物质,即相同的DES 在不同的条件下可以提取得到不同样本中的多糖或其他活性物质,因此采用DES 提取得到的多糖性质与提取条件关系密切,不同提取条件对于目标多糖的影响并不明确,通过DES 对多糖的选择性提取还需要做大量研究。而且,DES 的不易挥发性使其难以通过直接蒸发回收再利用,溶剂反向萃取、大孔树脂吸附和膜透析等方法虽然可以有效回收,但这使得提取后续操作更加复杂,提取成本也更高[80-81]。加大可切换溶剂的开发可能是解决这一难题的主要研究方向与突破口。
DES 是具有可再生、廉价和绿色的可“设计”溶剂,这归因于它们良好的降解性、环境友好性和低毒或无毒性。前文中提到一些研究表明常用DES 在细胞、真菌和动物(小虾)学水平都表现为无毒或低毒,但也有研究发现,氯化胆碱-尿素型DES 对水螅的毒性强于单个组分[82]。因此DES 的安全性还需要进一步的毒理学研究和更多动物实验,从而避免多糖提取过程中DES 的残留可能对多糖品质和人体健康产生不利影响。
5 结论与展望
近年来,DES 在植物多糖提取领域得到广泛应用。DES 具有环保、高效和易降解等优点,能够有效提高植物多糖的提取率和纯度,而且其良好的生物相容性和相对温和的提取条件可以显著提高多糖的溶解度和稳定性,与传统提取法相比,DES 提取的植物多糖具有更好的生物活性和功能特性。DES 也更加符合绿色提取的要求,其理化性质(极性、熔点、溶解度、密度、电导率和粘度等)具有较高的可调性,可以通过改变组分及摩尔比实现,具有更好的设计性的灵活性,未来可以利用分子模拟技术设计得到具有优良理化性质和选择性的DES 应用于多糖的提取。此外,DES 可以重复提取多次仍保持良好的提取效果,所以溶剂的回收再利用是非常必要的,可切换型DES 的研究开发或是有效途径之一。值得一提的是,虽然DES 普遍认为是安全的,但毒性评估显示,它们比其单个组分具有更高毒性的案例也存在,因此,对于DES 的毒性和生物降解性的评估,特别是DES 对生物体的影响,需要做更全面细胞学和动物学研究,以确定通过DES 提取的植物多糖是否可以直接用于食品和医药领域,继续加大DES 在多糖提取中的内在机理研究,探索其应用于工业生产的可能性,为植物多糖高效提取利用提供新的思路和理论依据。

