超声对高浓度大豆分离蛋白结构和酶解产物抗氧化活性的影响
徐晨晨,杨志艳,祝宝华,李晓晖,2,3,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
大豆分离蛋白(soybean protein isolate,SPI)是低温条件下以脱脂大豆粕为原料生产的蛋白、含量在90%以上的大豆蛋白,具有成本低、蛋白含量高等特点,已被广泛应用于食品加工中。但因功能特性不理想、含胀气因子及不良风味等因素,限制了其在食品领域中的应用[1]。大豆分离蛋白最常用的改性方法是酶法,但酶法反应时间长,生产效率低,限制了高活性功能肽的产生[2]。为了促进蛋白质改性进程及提高酶解产物的抗氧化活性,非热加工技术已被用于改变大豆分离蛋白的功能特性。
超声作为一种绿色的非热加工技术,被广泛应用于蛋白质改性中,由于空化现象,会引起机械效应以及热和化学效应,从而改变蛋白质的结构,改善功能特性[3-4]。代世成等[5]将大豆分离蛋白(1%)超声预处理后,结果表明非共价/共价复合物中大豆分离蛋白的二级结构发生改变,与未处理的大豆分离蛋白样品相比,β-转角和无规卷曲相对含量增加,α-螺旋和β-折叠相对含量下降,色氨酸和酪氨酸基团暴露增多,大豆分离蛋白结构变得更加舒展及松散,且抗氧化能力显著提升。Yan 等[6]超声处理大豆分离蛋白(3%)后,大豆分离蛋白的α-螺旋和β-折叠增加,从而增加了大豆分离蛋白的柔韧性和巯基含量,并展开了其三级结构。
虽然超声处理技术可以改善大豆分离蛋白的分子结构,但目前报道的超声处理大豆分离蛋白常规浓度在1%~12%之间,这导致后续酶解不利于提高终产物浓度和生产效率。本文中高浓度指浓度在16%~20%之间,与常规浓度相比,高浓度条件下可以提高单位设备生产产能,反应加热冷却及产物浓缩干燥能耗少,降低成本。然而迄今为止,尚未见超声应用于高浓度大豆分离蛋白改性的研究报道。因此,本文研究了超声处理高浓度大豆分离蛋白的可行性,通过SDS-PAGE、傅立叶变换红外光谱、荧光光谱和荧光探针等检测手段,对蛋白分子结构进行表征,同时,利用碱性蛋白酶酶解大豆分离蛋白制备得到大豆肽,并评价酶解产物抗氧化功能,以期为高浓度大豆分离蛋白超声改性和酶解工艺开发提供新的技术参考。
1 材料与方法
1.1 材料与仪器
SPI(蛋白含量95%) 河南金晶生物科技有限公司;碱性蛋白酶(酶活2.0×105U/g) 南宁东恒华道生物有限公司;十二烷基硫酸钠(SDS)、过硫酸铵、四甲基乙二胺(TEMED)、丙烯酰胺(Acr)、Tris 等分析纯、蛋白Marker、R-250 考马斯亮蓝染色液、5×上样缓冲液(Loading Buffer) 上海生工生物工程有限公司;8-苯胺-1-萘磺酸(ANS) 上海麦克林生化科技有限公司;三氯乙酸、氢氧化钠、盐酸、硫酸铜等 上海国药集团。
JX-950D 超声波细胞破碎仪 北京冬歌博业生物科技有限公司;F-7100 荧光分光光度计、LA-8080超高速氨基酸自动分析仪 日本日立公司;Spotlight 400 傅里叶变换红外光谱仪 英国PerkinElmer 公司;LYNX 4000 冷冻离心机 赛默飞世尔科技(中国)有限公司;KJELTEC 8400 全自动凯氏定氮仪苏州福斯赛诺分析仪器;CHRIST ALPHA1-2 真空冷冻干燥机 美国Marin Christ 公司。
1.2 实验方法
1.2.1 超声处理不同浓度SPI 按照前期超声工艺优化条件(超声功率300 W,20 min),分别采用去离子水配制4%、8%、12%、16%和20%浓度的样品溶液进行超声预处理,分别记为UP-4、UP-8、UP-12、UP-16、UP-20,以未超声预处理浓度4%为对照,记为WP。
1.2.2 超声处理后SPI 酶解液的制备 将超声处理不同浓度SPI 分别稀释成4%,调节温度和pH 至最适条件,加入碱性蛋白酶。酶解4 h 后于90 ℃灭酶15 min,冷却至室温于10000 r/min,4 ℃离心20 min。分别记为EUP-4、EUP-8、EUP-12、EUP-16、EUP-20。以未超声处理为对照,记为EWP。收集上清液,冷冻干燥备用。
1.2.3 SDS-PAGE 测定 参照李杨等[7]方法并稍作修改,配制3 mg/mL 的样品与5×Loading Buffer 按4:1 比例混合均匀,浓缩胶和分离胶浓度分别为4%和12%,上样量8 µL。
1.2.4 傅里叶变换红外光谱测定 参照Subasi 等[8]方法,采用Spotlight 400 傅里叶变换红外光谱仪对不同超声处理后SPI 进行红外光谱测定。
1.2.5 荧光光谱测定 根据Huang 等[9]并进行了修改。采用0.01 mol/L(pH7.4)磷酸盐缓冲液配制成0.4 mg/mL 的样品溶液。在荧光分光光度计中于290 nm 处激发,300~460 nm 发射,在5 nm 的恒定狭缝下扫描样品溶液并记录发射光谱。
1.2.6 表面疏水性测定 参照Wang 等[10]实验方法并稍作修改,将超声处理不同浓度SPI 冻干后用0.01 mol/L pH7.4 Na2HPO4-NaH2PO4缓冲液稀释至2、4、6、8、10 mg/mL 浓度,取20 μL 的ANS 缓冲溶液加入4 mL 上述配制的水解液混合,立即摇匀,在荧光分光光度计中于390 nm 激发、发射波长400~650 nm 检测发射荧光强度。用荧光强度对蛋白水解液浓度作图并进行线性回归,以线性回归斜率作为表面疏水性。
1.2.7 多肽含量测定 参照GB/T 22729-2008《海洋鱼低聚肽粉》[11]测定方法。采用KJELTEC 8400 全自动凯氏定氮仪测定样品中酸溶蛋白质水解物含量,L-8080 氨基酸自动分析仪测定样品中游离氨基酸含量。多肽含量X1计算如公示(1):
式中:X1,多肽含量(以干基计算),%;X2,酸溶蛋白质水解物含量(以干基计算),%;X3,游离氨基酸含量(以干基计算),%。
1.2.8 分子量测定 参照GB/T 22492-2008《大豆肽粉》[12]测定方法并稍加修改。色谱条件:色谱柱TSKgel G2000SWXL(7.8 mm×300 mm),进样量10µL,检测波长220 nm,温度30 ℃,流动相为乙腈:水:三氟乙酸=450:550:1,流速0.5 mL/min。样品经0.22 µm微孔滤膜处理进行测定。
1.2.9 游离氨基酸(FAA)组成测定 将0.2 g 酶解冻干粉与15 mL 5% TCA 混合,均质,超声5 min,静置2 h,4 ℃ 10000 r/min 离心15 min,吸取上清液5 mL,用NaOH/TCA 调pH 至2.0,定容,过0.22 µm 滤膜,得到透过液于氨基酸自动分析仪中进一步分析氨基酸组成。
1.2.10 抗氧化活性测定
1.2.10.1 DPPH 自由基清除率测定 参考许瑞如等[13]的测定方法并略做改动。配制不同质量浓度的样品溶液(1.0、2.0、3.0、4.0 和5.0 mg/mL)取1mL 与含2 mL 0.2 mmol/L DPPH 的95%乙醇置于试管中振荡,混匀,黑暗处放置30 min 后,在517 nm 处测定吸光度。计算公式如(2)所示:
式中:A样品,1 mL 样品与2 mL DPPH 反应后的吸光度;A对照,1 mL 蒸馏水与2 mL DPPH 反应后的吸光度;A空白,1 mL 样品与2 mL 95%乙醇反应后的吸光度。
1.2.10.2 羟基自由基清除率测定 参考李煦等[14]的测定方法并略做改动。配制不同质量浓度的样品溶液(1.0、2.0、3.0、4.0 和5.0 mg/mL),取1 mL 依次加入2.25 mmol/L 硫酸亚铁、9 mmol/L 水杨酸甲醇溶液、8.8 mmol/L 过氧化氢溶液各1 mL,37 ℃条件下放置30 min,4000 r/min 离心5 min,在510 nm 处测上清液的吸光度,公式如下:
式中:A1,添加样品时的吸光度;A2,水杨酸甲醇溶液和过氧化氢溶液均替换成甲醇时的吸光度;A0,样品替换成同体积甲醇的吸光度。
1.2.10.3 还原能力测定 参照张雨[15]测定方法并略作修改,取不同质量浓度的样品液1.0 mL,加入1%的铁氰化钾、PBS 缓冲液(pH6.6)各1 mL,在50 ℃的水浴锅中静置加热20 min,快速冷却后加入10%的TCA(三氯乙酸)1 mL,混匀后6000 r/min离心5 min,取1 mL 的上清液,加入等体积的蒸馏水和0.05%三氯化铁,混合均匀在700 nm 测吸光度,一定程度上吸光度值与还原能力成正比。
1.3 数据处理
试验重复3 次、取平均值加减标准差,SPSS 26 软件进行显著性分析(P<0.05),PeakFit 4.12 软件对红外吸收曲线进行拟合处理,采用Origin 2022b软件作图。
2 结果与分析
2.1 超声处理对不同浓度SPI 结构的影响
2.1.1 SDS-PAGE 分析 SDS-PAGE 电泳图可以观察超声处理大豆分离蛋白的分子量及蛋白组成变化,图1 为不同浓度SPI 超声处理后取相同浓度进行还原性SDS-PAGE 电泳图谱。在所有处理中均显示了分子量分别为20、33、50 和85 kDa 的蛋白条带。与对照组相比,超声处理的SPI 之间的电泳图谱没有明显变化,说明在超声功率300 W,20 min 处理下不同浓度SPI 的一级结构没有变化。该结果与李杨等[7]的研究结果一致,即超声处理条件后没有形成二聚化。张淑艳等[16]发现超声处理下无论花生蛋白浓度(5%~15%)如何变化,均不能使花生蛋白分子酰胺键断裂,并且在更高超声强度下处理也是如此。
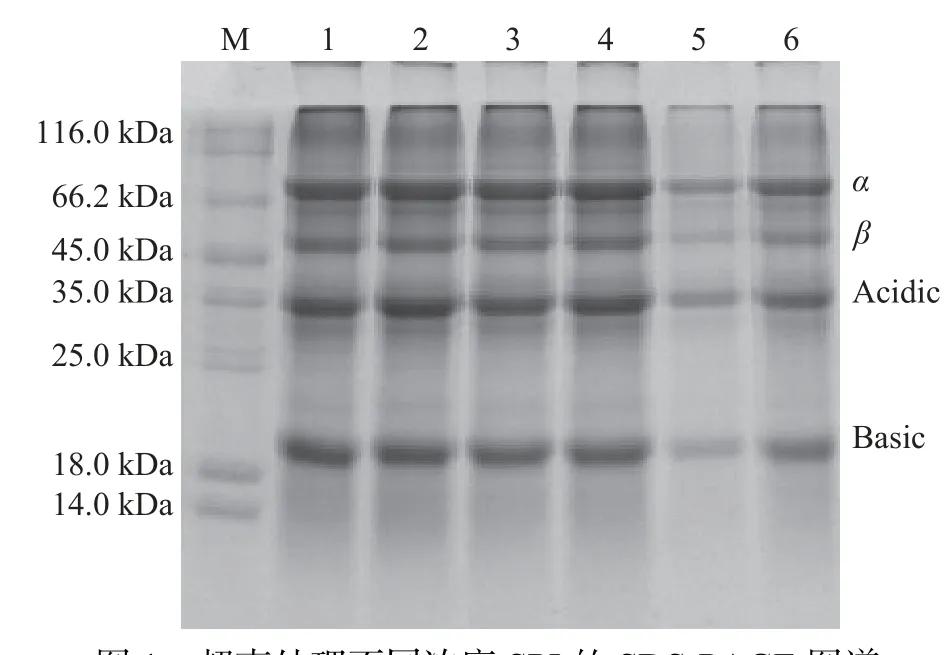
图1 超声处理不同浓度 SPI 的 SDS-PAGE 图谱Fig.1 SDS-PAGE spectra of SPI at different concentrations by ultrasound treatment
2.1.2 傅里叶变换红外光谱分析 傅里叶变换红外光谱常用来表征蛋白质的二级结构,图2 为超声处理的SPI 在不同浓度下的傅里叶变换红外光谱图。结果表明,SPI 浓度4%、8%、12%、16%、20%进行超声处理后,酰胺I 带的峰位分别从WP 组(对照)的1630.43 cm-1变为1636.37、1635.9、1635.45、1634.48和1634.43 cm-1,酰胺I 的位置改变表明SPI 的二级结构已经发生了转变[17]。为了进一步获得有关二级结构变化的信息,在表1 中计算了α-螺旋,β-折叠,β-转角和无规则卷曲的比例。与WP 相比,随着浓度增加,α-螺旋含量降低,β-折叠含量先增加后降低,β-转角含量先降低后增加,无规则卷曲总体变化较小,说明超声改变了局部氨基酸残基和分子不同部分之间的相互作用,促进了蛋白质分子的结构转变。尤其在16%高浓度下最为显著(P<0.05),其中,UP-16 样品的β-折叠含量达到最高43.2%,β-折叠含量的增加有助于暴露蛋白质的疏水区域。而α-螺旋含量的变化随着超声处理SPI 浓度增大而减少,这使得蛋白二级结构趋向于展开,这与Zhang 等[18]研究超声处理酪蛋白观察到的结果类似。因此,在浓度16%时可以通过超声的空化作用削弱维持蛋白质稳定性的氢键,使蛋白结构由有序转变为无序,更有利于后续酶解时酶切位点的暴露。
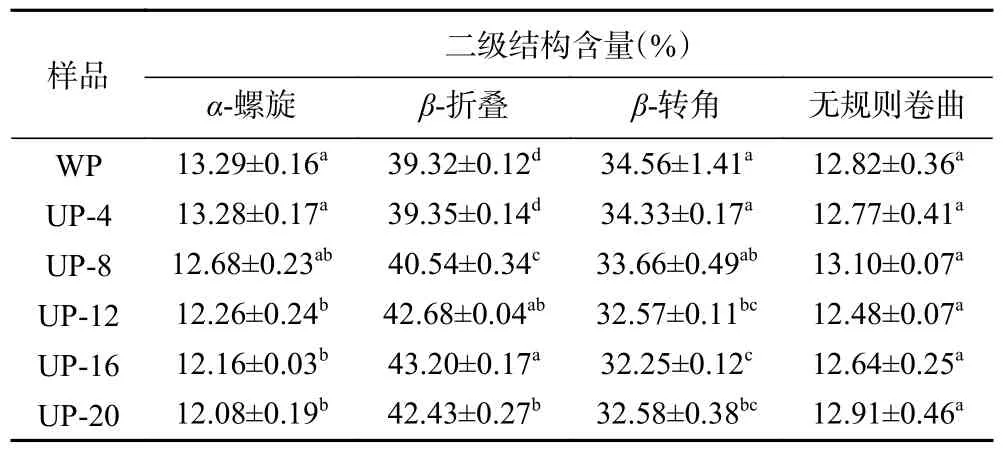
表1 超声处理不同浓度SPI 的二级结构分布Table 1 Secondary structure distribution of SPI at different concentrations by ultrasound treatment
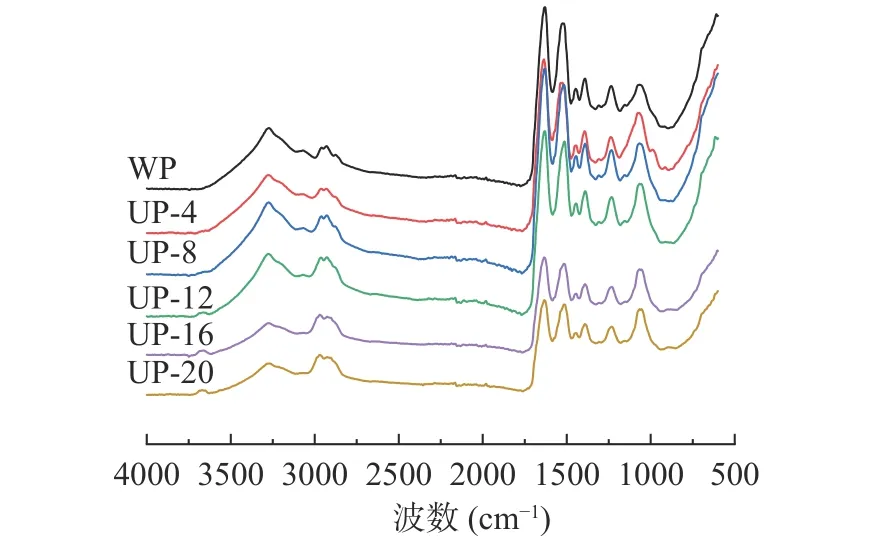
图2 超声处理不同浓度SPI 的傅里叶变换红外光谱图Fig.2 Fourier transform infrared spectra of SPI with different substrate concentrations treated with ultrasound
2.1.3 荧光光谱分析 SPI 含有许多芳香族氨基酸,如酪氨酸、色氨酸和苯丙氨酸,在290 nm 激发存在下可以产生固有的荧光光谱。因此,为了获得更多有关蛋白质结构变化的信息,采用荧光光谱技术研究蛋白质的结构和不同条件下蛋白质加工过程中的构象变化。通过监测荧光强度和最大发射波长(λmax)来确定蛋白内部结构的松散程度,由于发射强度与荧光激发幅值成正比,荧光强度的增加进一步说明色氨酸残基更容易被疏水环境包围,从而了解蛋白质三级结构的变化[9]。超声处理不同SPI 浓度的荧光光谱如图3。与WP 相比,经超声处理不同浓度SPI 后,λmax时的荧光强度分别从209.8 增加到299.2、332.7、359.9、391.8 和338.9。Zou 等[19]在研究超声波对鸡血浆蛋白水解物的影响时也有类似的趋势。还观察到在超声处理16%高浓度SPI 时,SPI 的λmax由338 nm 减少到336 nm,这种降低表明色氨酸和酪氨酸之间的能量转移效率的差异,即发生了红移[20]。此外,UP-20 样品的荧光强度明显低于UP-16 和UP-12 样品,可能的原因是浓度过高SPI 流动性较差,增加了反应体系的粘度系数,导致超声空化阈值增加,最终减少了空化气泡的产生,在传播和扩散过程中增加了声波的损失[21],这对蛋白质的改性产生负面影响,导致荧光强度降低。
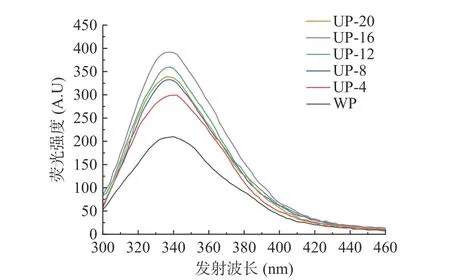
图3 超声处理不同浓度SPI 的荧光强度变化Fig.3 Fluorescence intensity changes of SPI at different concentrations by ultrasound treatment
2.1.4 表面疏水性分析 超声处理所产生的空化和机械效应,导致蛋白质结构展开,暴露出更多的游离巯基,从而显示出更高的表面疏水性[22]。对所有样品的表面疏水性进行测定,如图4 所示。与WP 组相比296.92±2.1,经过超声处理样品的表面疏水性均显著提高(P<0.05)。随着SPI 浓度由4%增加到8%、12%、16%、20%时,SPI 的表面疏水性分别从362.27±3.63 增加到371.25±1.92、470.0±3.54、543.75±6.57和480.45±3.75。而当蛋白浓度过高时(如20%),体系黏度非常高,从而影响空化效应,正如β-折叠含量增加(表1)和荧光光谱(图3)荧光强度降低。Zhu等[23]报道了SPI 结构中的低α-螺旋和高β-折叠含量表明其柔韧性和表面疏水性同时增加,这可能是因为超声处理导致更多的疏水基团通过疏水相互作用重新聚合,从而导致蛋白质疏水性降低。同时,蛋白质的疏水性是影响蛋白质水解物ACE 抑制活性和抗氧化活性的重要因素之一[24],表面疏水性的增加可以提高酶解产物的生物活性。
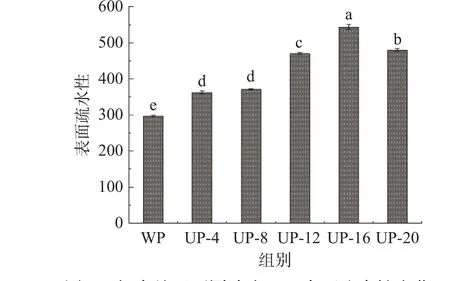
图4 超声处理不同浓度SPI 表面疏水性变化Fig.4 Effect of ultrasonic treatment with different concentrations on the hydrophobicity of SPI surface
2.2 超声处理不同浓度SPI 的酶解产物分析
2.2.1 多肽含量 超声处理不同浓度对SPI 酶解产物的多肽含量的影响如图5 所示。与EWP(未超声对照组)相比,超声可显著提高碱性蛋白酶酶解产物的多肽含量(P<0.05),随着超声处理SPI 浓度的增加,多肽含量呈先增加后降低的趋势,超声处理16%高浓度SPI 时多肽含量达到最大值84.27%,而浓度20%时多肽含量下降到76.02%。由此可知,在一定的处理浓度下,超声可以有效破坏SPI 的细胞壁,加快碱性蛋白酶的酶解,使大分子物质展开、肽键断裂和亲水氨基酸残基的暴露。而在浓度过高的情况下,超声对SPI 的结构作用较小,从而影响其超声对酶解产物的效果,这也和超声处理对不同浓度SPI 结构的结果相互印证。Wang 等[21]研究玉米蛋白表明,超声处理能够显著提高酶解产物中的多肽含量。而Chen 等[25]在高固形物浓度研究中则表明SPI 浓度越高蛋白回收率越低,与本实验结果趋势一致。

图5 超声处理不同浓度SPI 对酶解产物多肽含量的影响Fig.5 Effect of different concentrations of SPI on the peptide content of enzymatic digestion products by ultrasonic treatment
2.2.2 分子量分布 多肽分子量分布是评价酶解产物质量的一个重要指标,它与酶解产物的活性高度相关。表2 为超声不同浓度SPI 对酶解产物分子量分布的影响。可以看出大豆多肽分子量以小于1000 Da为主要成分,占比88%左右,200~1000 Da 占80%以上,3000~5000 Da 的范围变化较小。与EWP 相比,超声处理8%~16%浓度SPI 更有利于200~1000 Da分子量的肽段释放。这表明超声处理可能导致SPI的疏水残基或基团暴露、解产物结构的松散,使蛋白内部的酶切位点大量暴露,增加了碱性蛋白酶和酶解部位的接触,有利于酶解反应。然而,超声处理20%浓度SPI 后,200~1000 Da 的分子量明显下降,可能是由于超声高浓度条件下蛋白体系粘度大,超声处理不均匀,限制了大分子物质的降解,不利于酶解产物中小分子肽的产生[26]。对比其他人SPI 酶解的结果进行分析[27],本研究得到的分子量范围与目前报道的水平接近。
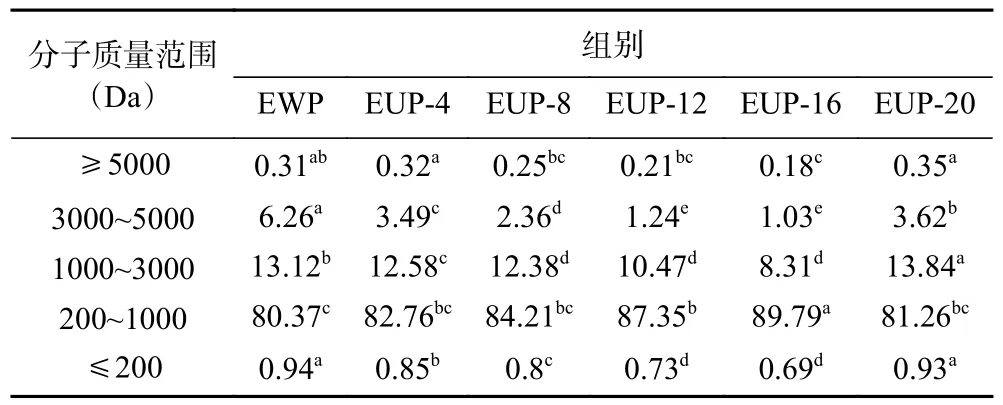
表2 超声处理不同浓度SPI 对酶解产物分子量分布的影响Table 2 Effect of different concentrations of SPI on the molecular weight distribution of enzymatic digestion products by ultrasonic treatment
2.2.3 游离氨基酸(FAA)组成分析 从表3 中可以看出超声处理不同浓度SPI 酶解产物的FAA 组成和含量的差异。由于该方法为酸处理法,测定时样品的浓度低,导致半胱氨酸、亮氨酸、组氨酸、脯氨酸没有检出,但必需氨基酸(6 种)的含量超过70%。EWP、EUP-4、EUP-8、EUP-12、EUP-16 和EUP-20处理得到酶解产物总FAA 含量分别为30.14、30.02、43.14、45.32、45.96 和37.26 mg/g,EUP-16 组总含量高于其他组。同时,SPI 酶解产物中含有大量游离疏水氨基酸(30.79 mg/g),经超声处理后的游离疏水氨基酸含量增加了11.44 mg/g。这是因为在合适的蛋白浓度下超声的空化效应、机械效应和瞬时高温高压才能更好的破坏蛋白质肽链,以及对蛋白质结构的破坏可以使更多酶作用位点暴露,从而生成大量FAA。Koláková等[28]研 究 表 明,这 些 必 需FAA含量和疏水性氨基酸的增加从理论上可以提高产品的营养价值。另外,研究表明氨基酸在抗氧化反应中起重要作用,其作为电子供体,能够直接与自由基结合,形成有利于发挥抗氧化活性的构象[29]。疏水性氨基酸残基如Val 或Leu 可以增加水-脂质界面的多肽,有利于清除脂质阶段产生的自由基。经超声处理后(EUP-16 组),酶解产物中Leu、Met、Tyr、Phe 等疏水氨基酸含量显著(P<0.05)增高。Cheison 等[30]认为含疏水性氨基酸残基的氨基酸的个数越多,则多肽的抗氧化活性越高。
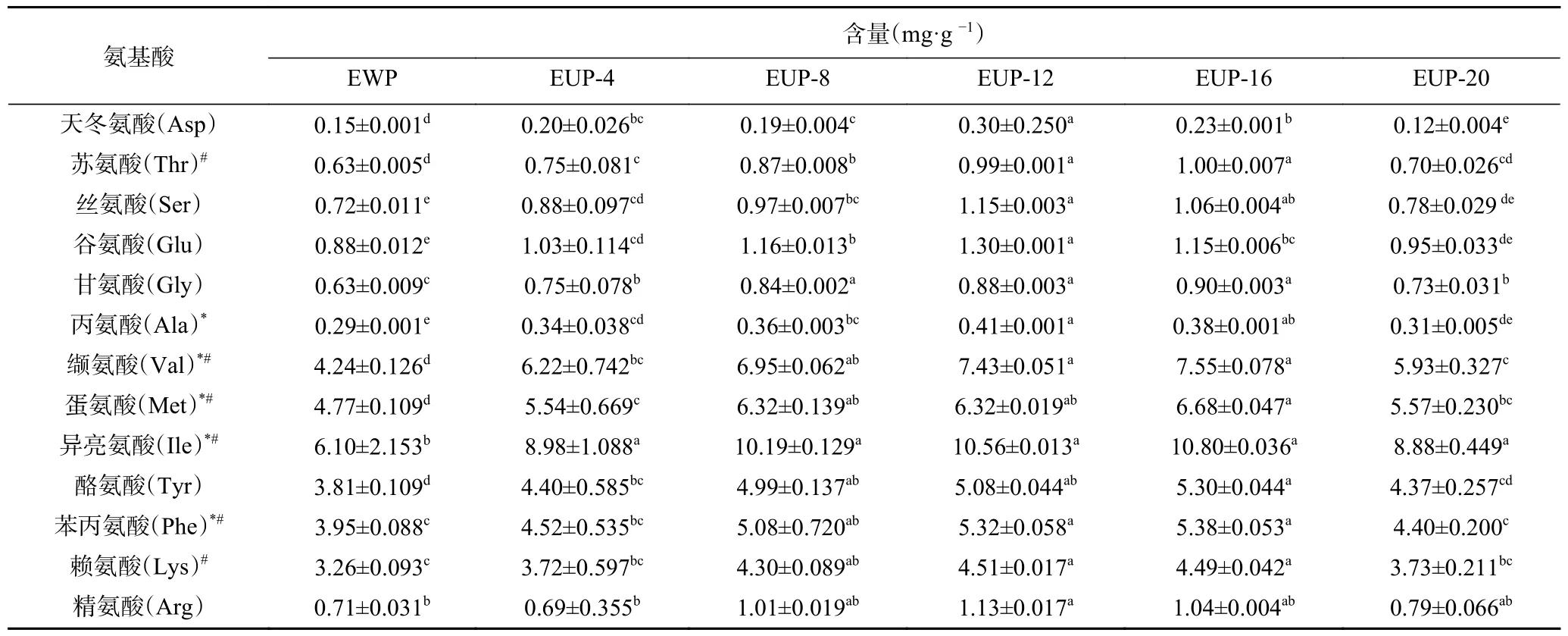
表3 超声处理不同浓度SPI 对酶解产物FAA 组成的影响Table 3 Effect of different concentrations of SPI on the FAA composition of enzymatic digestion products by ultrasound treatment
2.2.4 抗氧化活性分析 SPI 酶解产物的抗氧化活性受酶解程度、分子量分布和氨基酸种类的影响。本文使用三种不同的方法来评估酶解产物的抗氧化活性,如图6 所示。与EWP(未超声对照组)相比,随着质量浓度的增加,经超声获得的酶解产物中DPPH自由基清除率、羟基自由基清除率和还原能力都显著增加(P<0.05)。此外,在同一浓度下,超声16%高浓度SPI 酶解产物中DPPH 自由基清除率、羟自由基清除率和还原能力均显著高于其他组对应数值(P<0.05)。对质量浓度和清除率之间作回归方程并计算半抑制浓度(half inhibitory concentration,IC50)。由图6a 可知超声处理4%~20%浓度SPI 的酶解产物对DPPH 的IC50值分别为3.74、3.21、2.0、1.6和2.325 mg/mL,比未超声(IC50=4.16 mg/mL)显著(P<0.05)降低,说明超声处理有助于在酶解过程中,将大分子量部分蛋白质降解为小分子量部分,DPPH自由基的更高吸收能力可能是比未超声处理中存在更大量的疏水性残基,因为疏水性可以改善多肽与DPPH 分子的相互作用[31]。由图6b 可知,其酶解产物对羟自由基清除率的趋势与DPPH 大致相同。随着超声SPI 浓度增加样品的羟自由基清除率呈现先增加后减少的趋势,且在超声处理16%高浓度SPI 的IC50值为1.67 mg/mL,比未超声组(IC50=4.53 mg/mL)明显降低2.86 mg/mL(P<0.05)。图6c是酶解产物对还原能力的影响,在质量浓度范围内,超声16%高浓度SPI 得到的吸光度值从0.357 上升到0.960,4%浓度SPI 得到的吸光度值从0.194 上升到0.618,未超声的吸光度值从0.120 上升到0.541,说明在相同的酶解浓度和条件下,16%高浓度SPI 经超声后,酶解产物的抗氧化活性高于其余组的抗氧化活性。
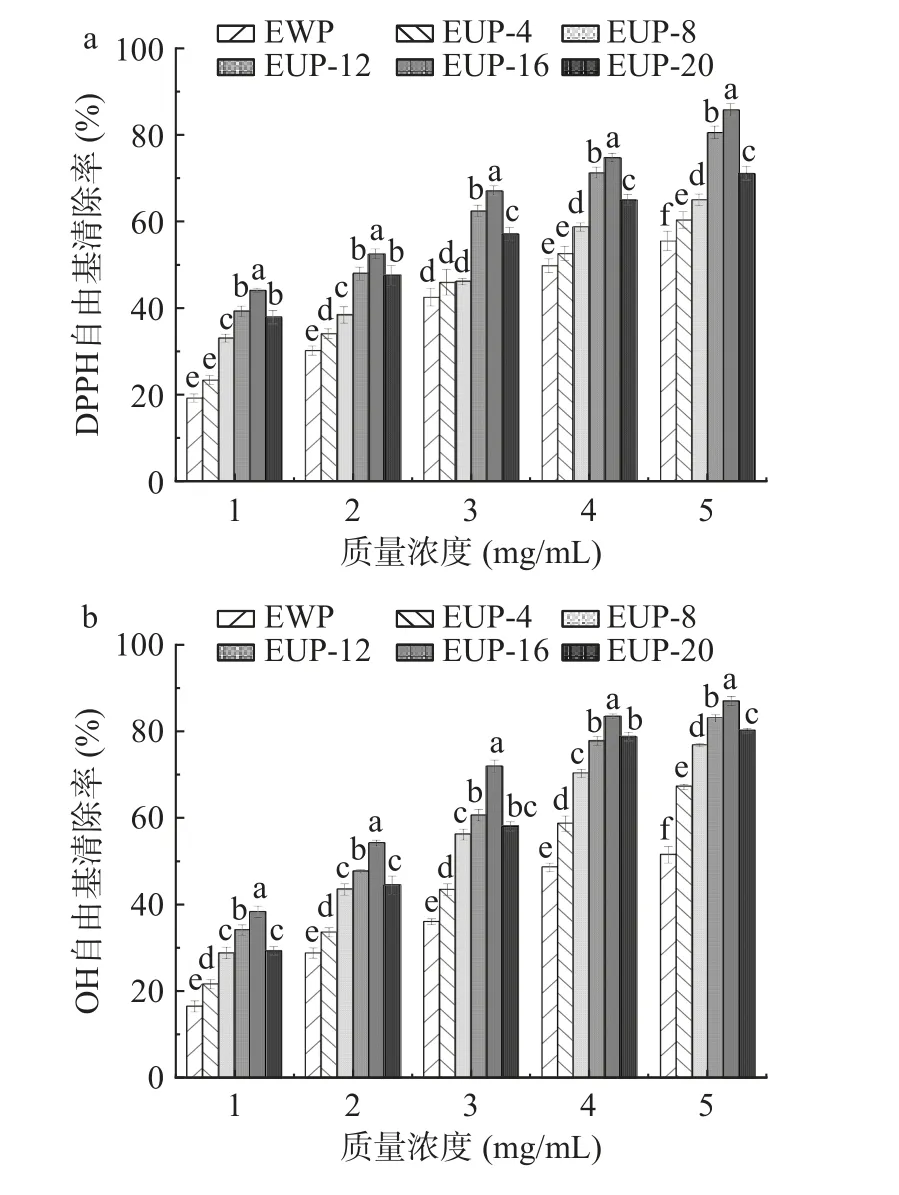
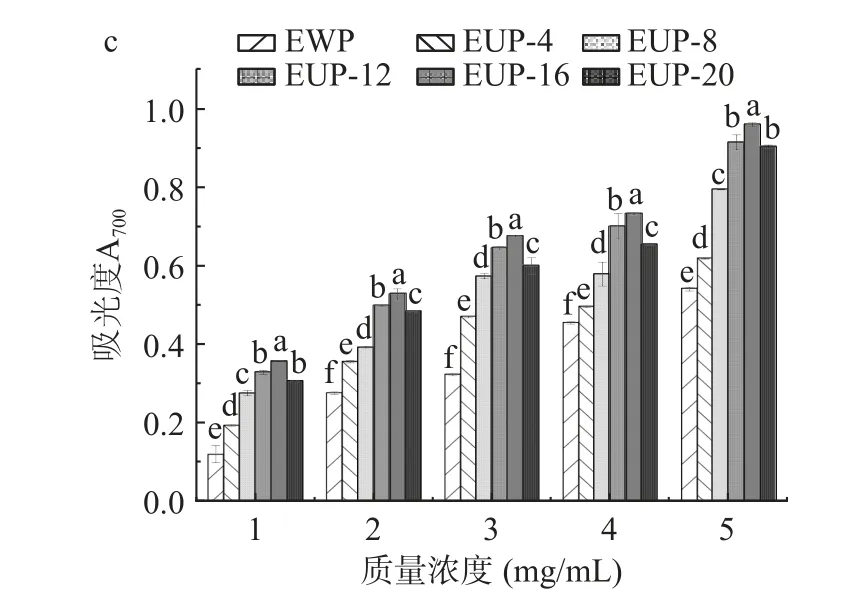
图6 超声处理不同浓度SPI 对酶解产物抗氧化活性的影响Fig.6 Effect of different concentrations of SPI on the antioxidant activity of enzymatic digestion products by ultrasound treatment
抗氧化活性分析结果表明16%高浓度SPI 经过超声处理后,其抗氧化活性最高,推测与其酶解产物200~1000 Da 分子量增加,含有较多的游离氨基酸(FAA)有关。后续将进一步分析其酶解产物中200~1000 Da 组分中抗氧化肽的组成、筛选和鉴定新型抗氧化大豆肽。
3 结论
本研究探讨了超声对高浓度SPI 结构的影响及其酶解制备大豆肽的效果。SDS-PAGE 表明,无论蛋白浓度高低,超声处理都未使SPI 一级结构发生改变;二级结构表明,浓度增加会影响β-折叠和α-螺旋含量,在16%浓度SPI 超声处理后β-折叠含量达到最高43.2%,β-折叠含量的增加有助于暴露蛋白质的疏水区域,α-螺旋含量会使蛋白分子柔性增加,结构变松散,疏水性增强,在一定程度上提高了超声改性效果;荧光光谱强度和表面疏水性增加进一步说明,增加SPI 浓度是超声导致蛋白内部结构的松散程度和更多疏水基团暴露的原因。经超声改性后在相同4%底物浓度SPI 进行酶解,结果表明,在超声处理16%浓度SPI 后,酶解产物多肽含量最高达84.27%,产物中FAA 含量显著高于其他浓度的超声处理。同时,对酶解产物分子量的分析表明,在8%~16%浓度SPI 超声处理后,有利于200~1000 Da 低分子量肽段的生成。在对酶解产物抗氧化分析中发现,16%浓度SPI 的超声处理使得酶解产物中具有更高的抗氧化活性。
综上表明,超声时选择合适的SPI 蛋白底物浓度十分重要,16%高浓度SPI 超声后对后续酶解产物大豆多肽的含量和酶解产物的抗氧化活性具有明显提高的效果,本研究为高浓度SPI 超声处理和开发大豆肽酶解技术提供了技术参考。因此,在超声条件下,选择合适的蛋白浓度,可以达到对蛋白分子结构特性改性的目的,但关于超声对高浓度蛋白结构与活性之间的构效关系及其具体作用机制仍需进一步探究。

