蜜生假丝酵母LGL-2 发酵油菜蜂花粉酵素工艺优化及品质评价
廖 湘,邓俊霞,白卫东,肖更生,赖秋萍,王 宏,*,刘功良,*
(1.仲恺农业工程学院轻工食品学院,广东省岭南特色食品科学与技术重点实验室,农业农村部岭南特色食品绿色加工与智能制造重点实验室,广东广州 510225;2.广东桂岭蜂业科技股份公司,广东梅州 514199)
蜂花粉是蜜蜂从蜜粉源植物花蕊内采集的花粉粒与其自身腺体分泌物加工而成的一种混合物,富含丰富的酚类化合物,具有降血脂、促进免疫和抗菌等活性[1-2]。此外,植物来源和地理位置不同的蜂花粉组分不同,有报道表明可通过酚类化合物的组成辨别蜂花粉的植物来源和地理位置[3]。油菜蜂花粉外观为淡黄色,多呈长球形或圆球形,是中国目前产量占比最高的蜂花粉,同时也是中国开发利用最多的蜂花粉品种[4-5],具有较好的开发基础。
近年来,酵素产品越来越受消费者欢迎。食品原料经发酵制备成食用酵素,不仅可以提高食品原料的活性成分,而且还能赋予特殊的发酵香气[6]。苏春雷等[7]发现发酵后的余甘子酵素总酚含量比发酵前高;Tohamy 等[8]观察到发酵埃及蜂花粉制品具有较强的体外抗氧化活性;王印壮等[9]将葡萄果实发酵成酵素后,发现原料风味物质更为丰富;Yan 等[10]研究表明酵母菌在改善蜂花粉营养特性方面具有优势。目前油菜蜂花粉已被中国卫生部以普通食品管理办法纳入“食品新资源名单”,具有较大的开发潜力[11],利用源自蜂蜜的酵母LGL-2 将油菜蜂花粉制成酵素有望提升蜂花粉品质和附加值。
目前,蜂花粉产品品类单一,关于油菜蜂花粉发酵制品风味分析的报道较少。因此,为丰富蜂花粉发酵菌种资源,提高蜂花粉产品品类以及质量,本实验以油菜蜂花粉为原料,采用响应面法探究影响油菜蜂花粉酵素总酚含量的因素,制备品质优良的油菜蜂花粉酵素,并对油菜蜂花粉及其酵素的酚类化合物、挥发性成分与抗氧化活性进行分析比较,以期为蜂花粉产品的发酵工艺优化、风味品质评价以及综合性开发提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
油菜蜂花粉 广州市谭山蜂业有限公司;蜜生假丝酵母LGL-2(CCTCC M 2016787) 保藏于中国典型培养物保藏中心,采用酵母浸出粉胨葡萄糖培养基(YPD)活化培养;没食子酸、对香豆酸、鞣花酸、丁香酸、芥子酸、芦丁和槲皮素(标准品) 上海阿拉丁生化科技股份有限公司;总抗氧化能力检测试剂盒 南京建成生物工程研究所有限公司;无水乙醇、乙腈、甲酸等 均为国产分析纯,上海阿拉丁生化科技股份有限公司。
7890A-5975C 气相色谱-质谱联用仪 美国Agilent 公司;57328-U 萃取纤维头 美国Agilent 公司;LC-20AT 高效液相色谱仪、M20A 二极管阵列检测器 日本Shimadzu 公司;FD-1D-50 真空冷冻干燥机 北京博医康实验仪器有限公司;722 型紫外-可见分光光度计 上海佑科仪器仪表有限公司;SWCJ-1F 超净台 苏州安泰空气技术有限公司;LDZX-50FBS 高压灭菌锅 上海申安医疗器械厂;ZQZY-98CES 振荡培养箱 上海知楚仪器有限公司;1508X高速冷冻离心机 上海力申科学仪器厂。
1.2 实验方法
1.2.1 油菜蜂花粉酵素发酵工艺 油菜蜂花粉酵素的制作工艺如图1 所示,主要包括杀菌、接种、发酵等步骤,将发酵制得的油菜蜂花粉酵素经真空冷冻干燥后置于-20 ℃冰箱保存备用。
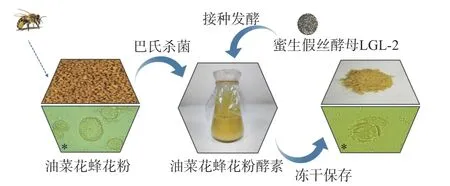
图1 油菜蜂花粉酵素发酵工艺流程Fig.1 Fermentation process of rape bee pollen jiaosu
1.2.2 菌种的活化与扩培 蜜生假丝酵母LGL-2 的活化参照张敏倩等[12]的方法。将活化后的蜜生假丝酵母LGL-2 按照体积分数2%接种至液体YPD 培养基中,28 ℃恒温振荡培养48 h,备用。
1.2.3 单因素实验
1.2.3.1 发酵时间对油菜蜂花粉酵素总酚含量的影响 在发酵温度30 ℃、接种量10%、底物含量25%条件下,180 r/min 恒温培养,收集不同发酵时间(0、6、12、18、24、30、36、42、48、54、60 h)的油菜蜂花粉酵素,待测。
1.2.3.2 发酵温度对油菜蜂花粉酵素总酚含量的影响 以10%接种量将蜜生假丝酵母LGL-2 接种在25%底物含量培养液中,分别在24、26、28、30、32、34 和36 ℃和180 r/min 的摇床中培养42 h,收集样品待测。
1.2.3.3 接种量对油菜蜂花粉酵素总酚含量的影响
分别以体积分数为5%、10%、15%、20%、25%和30%的接种量,将蜜生假丝酵母LGL-2 接种在底物含量25%的培养液中,在30 ℃,180 r/min 的摇床中培养42 h,收集样品待测。
1.2.3.4 底物含量对油菜蜂花粉酵素总酚含量的影响 以10%接种量将蜜生假丝酵母LGL-2 分别接种在5%、10%、15%、20%、25%、30%、35%和40%底物含量培养液中,于30 ℃和180 r/min 恒温摇床中培养42 h,收集样品待测。
1.2.4 Box-Behnken 试验设计 选取发酵时间、发酵温度、接种量和底物含量作Box-Behnken 设计,并且以油菜蜂花粉酵素总酚含量作为响应值,试验设计见表1。

表1 Box-Behnken 试验因素水平设计Table 1 Factors and levels of Box-Behnken test
1.2.5 酚类化合物的提取 在2 g 样品冻干粉末中加入100 mL 蒸馏水,超声波(100%,70 ℃)辅助提取2 h,离心后取上清液作为样品溶液用于随后试验。
1.2.6 总酚含量测定 油菜蜂花粉及其酵素的总酚含量测定参照王小超等[13]与田文礼等[14]的方法,并稍作修改。配制0.1 mg/mL 的样品溶液,精密吸取1.0 mL 样品溶液于试管中,分别加入0.5 mL 福林酚,2 mL 超纯水,充分摇匀,1 min 后加入7.5%无水碳酸钠溶液5 mL,充分混匀,在暗处放置50 min,以不添加样品溶液为空白,在760 nm 波长处测定吸光度,以没食子酸为标准品,得到标准曲线y=0.0109x+0.0268(R2=0.9986)。总酚含量表示为mg 没食子酸当量(GAE)/g。根据标准曲线计算油菜蜂花粉及其酵素的总酚质量浓度,并按下式计算总酚含量。
式中:c 为稀释样品对应标曲的没食子酸浓度(mg/L);V 为样品体积(L);m 为样品质量(g);t 为稀释倍数。
1.2.7 游离酚类化合物测定 参考徐元元等[15]的方法,采用高效液相色谱法(HPLC)测定油菜蜂花粉及其酵素的游离酚类化合物。将从油菜蜂花粉及其酵素中提取的酚类化合物过0.22 μm 滤膜后进样,进样量为10 μL。色谱柱型号为Agilent ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm)。柱温为30 ℃,流动相A 为体积分数0.1%甲酸,流动相B 色谱级乙腈,梯度洗脱程序为0.00~5.00 min,5%~10% B;5.01~10.00 min,10% B;10.01~22.00 min,10%~17%B;22.01~50.00 min,17~50% B;50.01~75.00 min,50%~95% B;75.01~78.00 min,5% B,流速为1 mL/min。以标准品的保留时间与紫外-可见光光谱图确定样品酚类化合物组成。对香豆酸、槲皮素、芦丁在320 nm波长处测定峰面积,丁香酸、鞣花酸、没食子酸和芥子酸在280 nm 波长处测定峰面积,外标法定量。
1.2.8 挥发性香气成分富集与分析
1.2.8.1 挥发性香气成分富集 顶空固相微萃取方法参考程娅娅[16]并略作修改。吸取8 mL 油菜蜂花粉溶液与油菜蜂花粉酵素,分别置于20 mL 样品瓶中并加入2.5 g 氯化钠和磁力转子,45 ℃平衡25 min后插入活化完全的纤维萃取头45 ℃吸附40 min,于250 ℃解吸5 min。
1.2.8.2 GC-MS 条件 色谱条件:采用HP-INNO WAX毛细管色谱柱(60 m×250 μm×0.25 μm);载气(He)流速0.8 mL/min,进样量0.5 μL,不分流进样;进样口温度:250 ℃;升温程序:起始35 ℃,保持3 min,以5 ℃/min 升温至200 ℃,保持3 min,再以10 ℃/min的速率升温至230 ℃,保持10 min,总运行时间约为52 min;质谱条件:电子轰击离子源;电子能量70 eV;离子源温度为250 ℃,质谱接口温度270 ℃;质量扫描范围:m/z 20~450。
1.2.8.3 挥发性成分的定性与定量分析 检测结果在图谱库NIST 11 上检索解析,结合特征离子峰、基峰等信息在谱库中筛选出相似度≥80(最大值为100)的化合物,采用峰面积归一化法计算得到各挥发性香气成分的相对百分含量。
1.2.9 相对气味活度值(ROAV)计算 相对气味活度值可以用于评定各类挥发性香气成分对产品风味贡献程度,贡献程度最大的挥发性香气成分ROAV值为100。ROAV≥1 表明该挥发性香气成分为样品中的关键挥发性风味物质,ROAV 值越大表示该成分对样品整体风味影响越大[17]。
式中:Cmax与Tmax分别表示对贡献程度最大挥发性香气成分的相对含量(%)及感觉阈值(mg/kg);C1与T1表示各待测成分的相对含量(%)和感觉阈值(mg/kg)。
1.2.10 抗氧化活性测定
1.2.10.1 DPPH 法测定抗氧化活性 吸取各梯度Trolox 标准液及样品溶液100 μL 与100 μL DPPH反应液混合后,于室温避光反应30 min,517 nm 处测定吸光度,Trolox 标准曲线为y=0.0016x+0.0112(R2=0.9905)。抗氧化活性以水溶性维生素E 类似物(Trolox)当量抗氧化能力表示,单位为μmol TE/g。
1.2.10.2 ABTS 法测定抗氧化活性 吸取各梯度Trolox 标准液与样品溶液20 μL 于96 孔板中,加入180 µL ABTS 工作液,充分混匀后于37 ℃避光静置6 min,734 nm 处测定吸光度,Trolox 标准曲线方程为:y=0.0012x+0.0518(R2=0.9888)。抗氧化活性以Trolox 当量抗氧化能力表示,单位为μmol TE/g。
1.2.10.3 FRAP 法测定抗氧化活性 吸取各梯度Trolox 标准液与样品溶液20 μL 于96 孔板中,再加入180 µL FRAP 工作液,摇匀后避光放置于37 ℃反应15 min,593 nm 波长测定吸光度,Trolox 标准曲线方程为:y=0.0016x+0.2104(R2=0.9867)。抗氧化活性以Trolox 当量抗氧化能力表示,单位为μmol TE/g。
1.3 数据处理
试验数据采用SPSS Statistics 22.0 和Design-Expert 8.0.6 软件进行统计分析。所有实验进行3 次平行,测定结果以平均值±标准差表示,组间差异采用单因素方差分析进行Duncan’s 差异分析,以P<0.05 表示差异显著。
2 结果与分析
2.1 油菜蜂花粉酵素发酵工艺条件的单因素实验结果
2.1.1 发酵时间对油菜蜂花粉酵素总酚含量的影响
如图2 所示,在发酵时间从0 h 增加到60 h 的过程中,油菜蜂花粉总酚含量随发酵时间的增加而明显提高,发酵时间达到42 h 时,总酚含量达到最大值,此时油菜蜂花粉总酚含量为8.63±0.02 mg GAE/g,在发酵过程中产生的乙醇可以提高部分酚类化合物的溶解性,进而提高测定总酚含量[18];当发酵时间大于42 h 时,油菜蜂花粉总酚含量不再随发酵时间的增加呈上升趋势,蜜生假丝酵母LGL-2 在发酵50 h左右时进入发酵平稳期,此时酚类化合物水解、氧化与溶解、合成等反应达到相对平衡位点,故选取42 h作为最佳发酵时间。Kaprasob 等[19]研究发酵腰果梨发酵过程中活性成分变化时发现,发酵中后期的总酚含量变化相对平稳,与本实验结果基本相符。
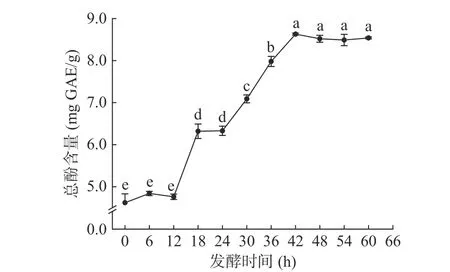
图2 发酵时间对油菜蜂花粉酵素总酚含量的影响Fig.2 Effect of fermentation time on the total phenolic content of rape bee pollen jiaosu
2.1.2 发酵温度对油菜蜂花粉酵素总酚含量的影响
如图3 所示,当发酵温度范围在24~30 ℃时,油菜蜂花粉酵素总酚含量随着温度的上升而逐渐提高,发酵温度为30 ℃时总酚含量达到最大值8.83±0.15 mg GAE/g;当发酵温度超过30 ℃后,总酚含量随温度升高而下降,因此选取30 ℃作为最佳发酵温度。微生物发酵过程中产生的酶不仅可以水解蜂花粉的细胞壁,使其营养成分与活性成分更好地释放[11],也可能会抑制酵母细胞内与酚类化合物合成相关酶的活性,导致油菜蜂花粉酵素总酚含量降低,过高与过低的温度均会抑制酶的活性。张敏倩等[12]在利用蜜生假丝酵母LGL-2 制备海藻糖时,发现蜜生假丝酵母LGL-2 的最佳发酵为28 ℃左右,与本研究结果有差异。
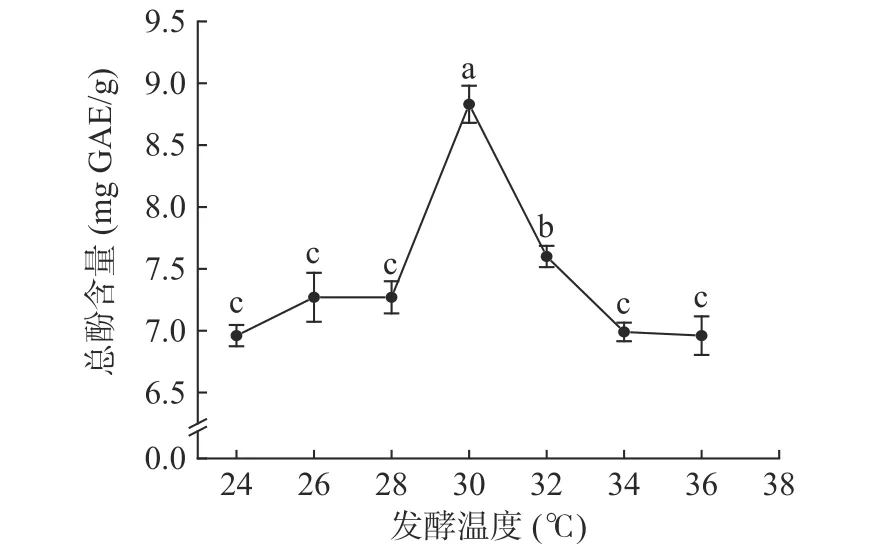
图3 发酵温度对油菜蜂花粉酵素总酚含量的影响Fig.3 Effect of fermentation temperature on the total phenolic content of rape bee pollen jiaosu
2.1.3 接种量对油菜蜂花粉酵素总酚含量的影响如图4 所示,当LGL-2 接种量从5%提升到20%时,油菜蜂花粉酵素总酚含量随着接种量的提高而提高,接种量为20%时总酚含量达到最大值10.94±0.20 mg GAE/g;当接种量大于20%,总酚含量随着接种量的提高反而明显下降,因此选取20%接种量作为LGL-2 的最佳接种量。当接种量过高时,发酵底物不足为酵母提供充足的营养,从而抑制酵母发酵。张笑莹等[20]优化雪花梨酵素制备工艺时,同样发现酵母菌接种量与酵素总酚含量呈现先上升后下降的峰形趋势。
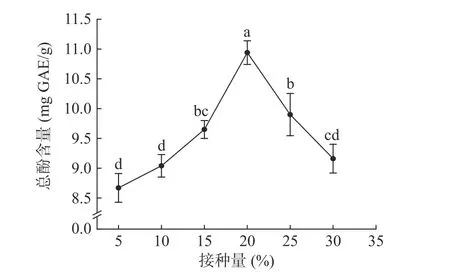
图4 接种量对油菜蜂花粉酵素总酚含量的影响Fig.4 Effect of inoculum amount on the total phenolic content of rape bee pollen jiaosu
2.1.4 底物含量对油菜蜂花粉酵素总酚含量的影响
如图5 所示,当底物含量由5%升高至30%时,油菜蜂花粉酵素总酚含量随底物含量的升高而提高,发酵液的底物含量为30%时总酚含量达到最大值10.26±0.23 mg GAE/g;总酚含量在底物含量达到30%后随着底物含量的提高反而呈下降趋势,因此选取30%底物含量作为发酵最佳底物含量。底物含量过高会引起外界渗透压增大,酵母的生长将会受到抑制,进而影响酚类化合物的释放。张敏倩等[12]的研究中也发现底物添加量过高会反抑制蜜生假丝酵母LGL-2 的代谢的现象。

图5 底物含量对油菜蜂花粉酵素总酚含量的影响Fig.5 Effect of substrate content on the total phenolic content of rape bee pollen jiaosu
2.2 油菜蜂花粉酵素发酵工艺条件的响应面优化试验结果
根据Box-Behnken 的中心组合试验设计原理,结合单因素试验结果,采用响应面法对油菜蜂花粉酵素发酵工艺进行优化,以发酵时间(A)、发酵温度(B)、接种量(C)和底物含量(D)为自变量,油菜蜂花粉酵素总酚含量(Y)为响应值,得出油菜蜂花粉酵素总酚含量的四因素三水平的结果如表2 所示。利用Design Expert 软件对上述结果进行分析,得到油菜蜂花粉酵素总酚含量(Y)对发酵时间(A)、发酵温度(B)、接种量(C)和底物含量(D)的二次多项回归方程为:

表2 Box-Behnken 试验设计及结果Table 2 Box-Behnken design with experimental results
Y=-548.523+0.93A+29.61B+1.99C+5.02D-7.71E-3AB-3.83E-3AC-1.50E-3AD+2.50E-3BC-0.06BD+3.70E-3CD-5.69E-3A2-0.46B2-0.05C2-0.05D2
由表3 可知,模型P<0.0001,说明该模型极其显著;失拟项不显著(P>0.05),说明该模型拟合得较好;R²=0.9132,可知该模型对综合评分的预测值与实际值的拟合程度较高;RAdj2=0.8263,说明该模型能解释82.63%响应值的变化,具有较好预测能力。方差分析中的显著性分析可以评价自变量对因变量的影响程度。在所有作用因素中,对总酚含量影响显著(P<0.05)的因素有:B 和BD;影响极显著(P<0.01)的因素有:A、D、B²、C²和D²。各单因素对总酚的影响顺序依次为A>D>B>C。
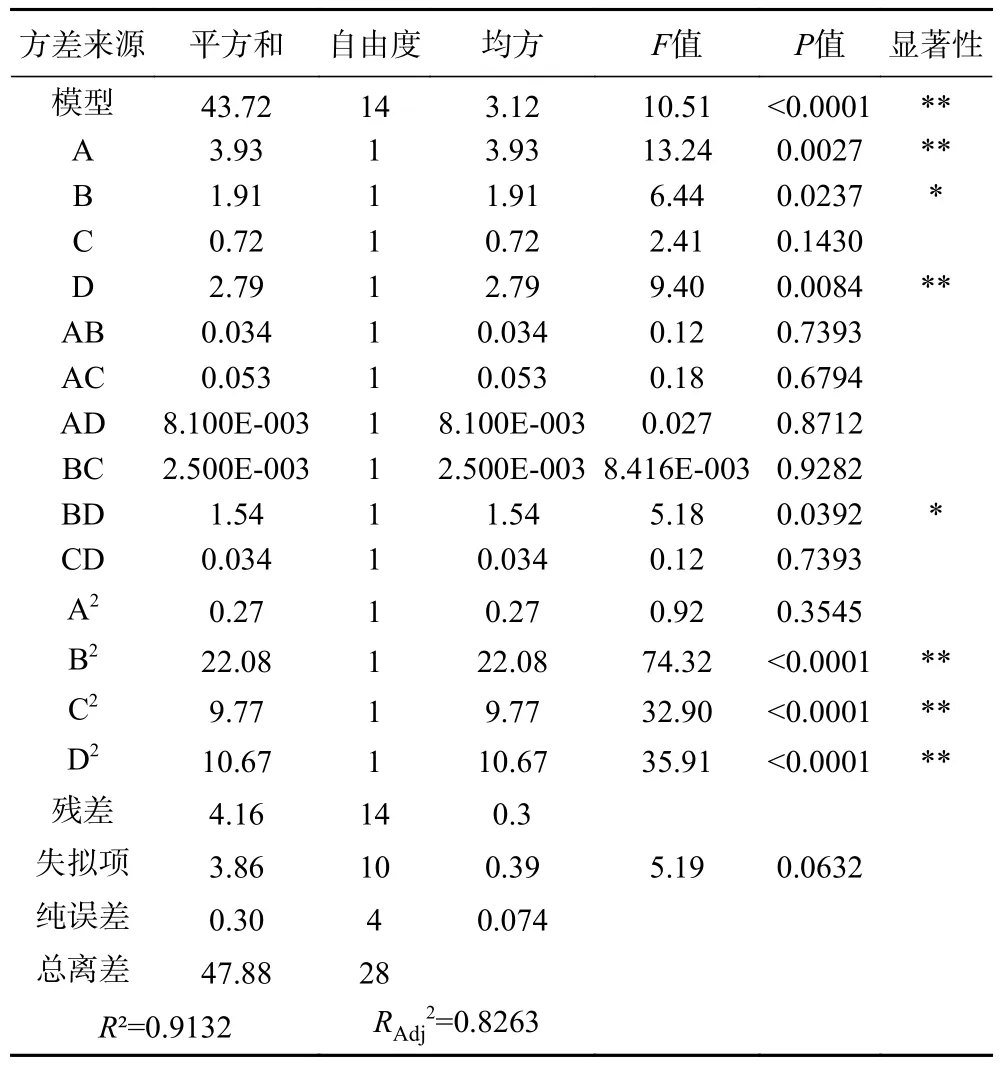
表3 回归方差分析结果Table 3 Analysis of variance for the fitted regression model
根据回归方程拟合的响应面图能直观反映各实验因素的交互作用,若响应曲面的坡度越陡峭,表明交互作用越强[21]。如图6 所示,相较于图6A~图6D及图6F,图6E 的等高线更为密集且曲面坡度陡峭,说明发酵温度与底物含量的交互作用对响应值的影响更强,这与方差分析的结果相符合。

图6 两因素交互作用对总酚含量的响应面图Fig.6 Response surface plot of the interaction between two factors on total phenol content
2.3 验证性实验结果
通过Design-expert 软件分析得到油菜蜂花粉酵素发酵最优工艺条件为:发酵时间47.91 h,发酵温度29.92 ℃,接种量20.31%,底物含量30.48%。考虑到实际性操作,将最优工艺条件调整为发酵时间48 h,发酵温度30 ℃,接种量20%,料液比30%,以修正后的工艺条件进行3 次平行验证试验,结果取平均值,得到蜂花粉酵素的总酚含量为11.48±0.27 mg GAE/g,接近模型预测值11.66 mg GAE/g,两者相对误差为1.58%,试验结果吻合度较高,证明该响应面方程的准确性和实用性。
2.4 油菜蜂花粉及其酵素的酚类化合物组成
多酚是蜂花粉中主要的活性物质之一[22]。HPLC检测结果如表4 所示,在油菜蜂花粉及其酵素中共检出5 种酚类化合物,其中包括酚酸(没食子酸、对香豆酸和鞣花酸)与黄酮类化合物(芦丁、槲皮素)。可以明显地看到,油菜蜂花粉酵素中的酚类化合物含量均高于发酵前样品。在酚酸类化合物中,没食子酸从0.52 mg/g 提高至1.90 mg/g,提升幅度最大;黄酮类化合物中提升最明显的是槲皮素,从0.11 mg/g 提高至0.21 mg/g。油菜蜂花粉及其酵素中芦丁含量分别是1.79 与2.41 mg/g,由此可见芦丁是油菜蜂花粉及其酵素中含量最高的酚类化合物之一,即油菜蜂花粉酵素的主要酚类化合物是芦丁。此外,丁香酸和芥子酸均未检出。
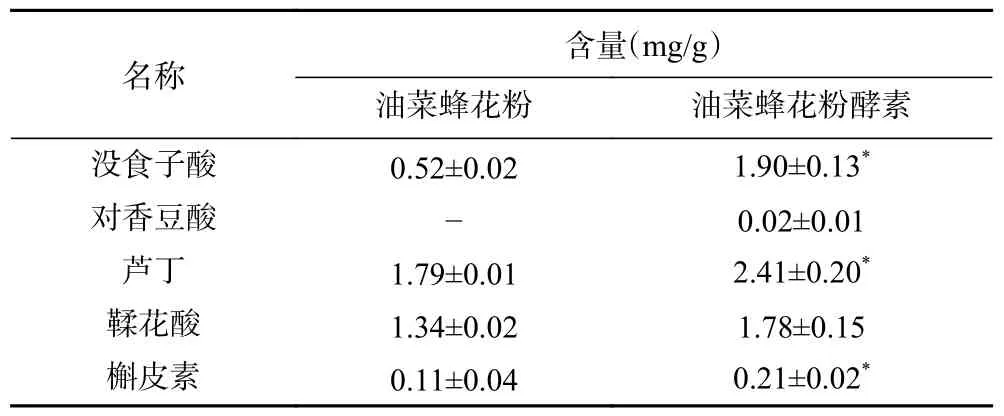
表4 油菜蜂花粉及其酵素的酚类化合物组成Table 4 Phenolic compounds of rape bee pollen and rape bee pollen jiaosu
Zhang 等[23]检测油菜蜂花粉的酚类化合物组分时,发现油菜蜂花粉中含有异鼠李素、山奈酚、芦丁、槲皮素等酚类化合物,其中芦丁的含量最高,与本实验结果相符。肖兴英等[24]通过对中国不同产地油菜蜂花粉检测发现,不同产地的同一植物来源蜂花粉所含酚类化合物存在差异。有研究报道,在微生物产生的酶解作用下,可以将原料中部分不溶性结合酚释放[25],与本研究中酚类化合物含量经发酵后提高的现象一致。此外,油菜蜂花粉酵素中仍可能存在其他未被检出的酚类化合物。
2.5 油菜蜂花粉及其酵素的挥发性香气成分
利用气相色谱法-质谱法联用技术(GC-MS)测定油菜蜂花粉及其酵素的挥发性香气成分,共鉴定出26 种挥发性化合物,包括醛类(8 种)、醇类(6 种)、酯类(5 种)、酮类(4 种)、酸类(2 种)、萜烯类(1 种)(见表5)。发酵后酯类物质与醇类物质明显增多,新增2 种酯类物质与4 种醇类物质,而醛类物质、酮类物质和酸类物质在发酵后种类均有所减少,其中醛类物质从8 种减少至1 种,酮类物质从3 种减少至2 种,酸类物质在发酵后未检出。Yan 等[26]提出大部分产香型酵母在发酵过程中能够合成酯类物质以改良产品风味。吴昊远[27]采用乳酸菌将油松松花粉发酵制备成风味乳饮料,同样检出正戊醇、苯甲醛和正己酸等成分。Bleve 等[28]在发酵橄榄时观察到除苯甲醛外,所有检测到的醛类物质浓度均在发酵过程中下降。这些研究结果与油菜蜂花粉酵素中挥发性成分的变化一致。

表5 油菜蜂花粉及其酵素的挥发性香气成分相对含量Table 5 Volatile aroma components and their relative contents of rape bee pollen and rape bee pollen jiaosu
各挥发性香气成分被感知到的最低浓度称为“气味阈值”,挥发性香气成分的含量与其阈值之比的大小反映该物质对整体香气的贡献程度[17],表6显示了发酵对油菜蜂花粉挥发性香气成分ROAV 的影响,共有7 种物质被鉴定为油菜蜂花粉酵素的关键性挥发性香气成分(ROAV≥1)。整体上,发酵前后的油菜蜂花粉中关键性挥发性香气成分有较大差异,其中异戊醇对油菜蜂花粉酵素的贡献度最大。据报道,异戊醇具有香甜气味,在酵母发酵的葡萄糖代谢途径中可以得到[29]。发酵前,油菜蜂花粉中醛类化合物的总ROAV 值最高,其中ROAV 值最高的醛类化合物为正己醛(64.96),其次是正辛醛(64.84),这些物质带有青草味[30]。此外,反式-2,4-庚二烯醛和正己酸分别带有令人不愉快鱼腥味和汗臭味[31-32]。经发酵后,反式-2,4-庚二烯醛和正己酸的ROAV 值降低,而苯乙醇、辛酸乙酯、庚酸乙酯和癸酸乙酯的ROAV值明显提高,表明发酵可有效降低令人不愉快的风味并增强油菜蜂花粉的水果香和玫瑰香气味[33-34]。此外,蔡秋萍[35]通过HS-SPME 提取与GC-MS 分析在油菜蜂花粉中共鉴定出40 种特征挥发性香气成分,同时结合在线嗅闻鉴定分析发现油菜蜂花粉具有甜奶脂味、花果香以及不良的膏脂油蛤味与腥味,与本实验结论基本一致。

表6 油菜蜂花粉及其酵素的挥发性香气成分ROAV 值Table 6 ROAV of volatile aroma compounds in rape bee pollen and rape bee pollen jiaosu
2.6 油菜蜂花粉及其酵素的抗氧化活性
通过蜜生假丝酵母LGL-2 发酵制得的油菜蜂花粉酵素采用DPPH、ABTS 和FRAP 方法分析。如表7 所示,其抗氧化活性当量分别为42.38±1.84、113.82±0.54 和89.90±0.91 μmol TE/g,相比于发酵前分别提高67.51%、13.90%和145.71%,且具有显著性(P<0.05)。Aylanc 等[36]对天然发酵的蜂花粉与未发酵的蜂花粉分别进行体外模拟消化,发现经天然发酵的蜂花粉在各个消化阶段均具有更高的抗氧化活性,本实验中经人工发酵制得的油菜蜂花粉酵素同样可观察到抗氧化活性增强的现象。研究表明,抗氧化活性与酚类物质含量呈正相关[37],推测油菜蜂花粉酵素抗氧化活性的提高可能与酚类化合物含量提高有关。
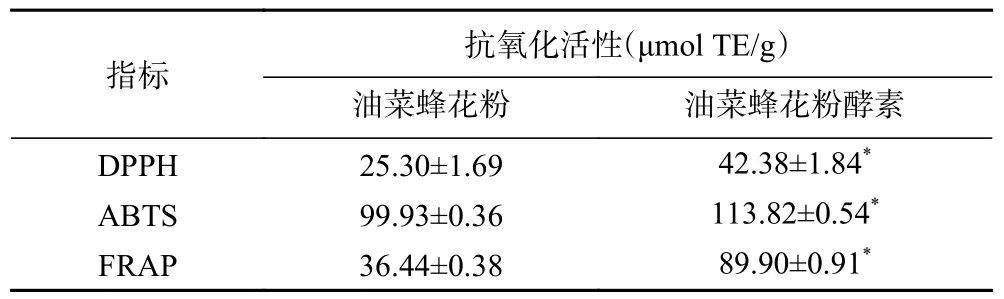
表7 油菜蜂花粉及其酵素的抗氧化活性Table 7 Antioxidant activity of rape bee pollen and rape bee pollen jiaosu
3 结论
本文对制备油菜蜂花粉酵素的工艺及品质进行研究,在采用单因素实验考察发酵时间、发酵温度、接种量和底物含量对油菜蜂花粉酵素总酚含量影响的基础上,对发酵工艺条件进行响应面优化试验,得到最优工艺条件:发酵时间48 h、发酵温度30 ℃、接种量20%、底物含量30%,此时总酚含量可达11.48 mg GAE/g。在此条件下发酵制备的油菜蜂花粉酵素中酚类化合物含量、挥发性酯类物质种类、醇类物质种类以及体外抗氧化活性均有所提高。此外,ROAV 值分析结果表明油菜蜂花粉经发酵后具有不良气味的成分ROAV 值下降,同时产生风味良好的物质。综上所述,本研究拓宽了蜜生假丝酵母LGL-2的应用场景,探究了油菜蜂花粉及其酵素的主要酚类化合物组成、挥发性风味成分以及抗氧化活性变化,为油菜蜂花粉酵素的研究及高附加值产品的开发利用提供理论依据,经蜜生假丝酵母LGL-2 发酵制得的油菜蜂花粉酵素营养价值更高、风味更佳,具有良好的开发、生产前景。目前,本文仅对油菜蜂花粉及其酵素的挥发性成分与体外抗氧化活性进行探究,为进一步阐明油菜蜂花粉酵素的风味成分及生物活性,未来可继续探究油菜蜂花粉发酵过程产生的非挥发性风味成分组成,并开展动物实验深入研究其体内活性。

