阿达木单抗治疗非全身型幼年特发性关节炎效果分析
彭倩倩 邱闪 陆倩 吕娟 李芳琳
幼年特发性关节炎(Juvenile idiopathic arthritis,JIA)是一种以关节滑膜炎为主要病理改变、高度异质性的儿童最常见的慢性风湿性疾病[1]。部分患儿由于诊断时机延误、治疗方案欠合理等原因,导致关节破坏、甚至致残及失明,给家庭及社会带来极大的疾病负担[2]。JIA 治疗存在窗口期,疾病早期的活动期积极抗炎治疗,可改善预后[3]。近年来生物制剂的出现,使JIA 患儿治疗策略和预防明显改善,致残率下降,达到临床疾病缓解,但仍有一半的患者在成年后仍需要积极治疗,而完全缓解的患者只有20%~25%[4]。非全身型JIA 患儿起病隐匿,容易出现诊断及治疗的延误,并且其具有高度异质性,即使经过积极治疗预后也不同。本研究回顾性分析我院收治的应用阿达木单抗治疗的非全身型JIA 患儿临床特点及预后,为JIA 临床诊治提供更多的参考依据。
1 材料与方法
1.1 研究对象选择2020 年12 月~2023 年5 月我院收治的非全身型JIA 并初次诊断的患儿40 例,分析治疗期间的临床资料及实验室数据。JIA 诊断均符合2001 年国际风湿病联盟制定的分类标准[5]。纳入标准:①明确诊断的非全身型JIA 患儿,所有患儿均有高危关节受累[2];②病情处于中重度活动期,首选阿达木单抗治疗的患儿;③定期随诊,数据资料全面的患儿。排除标准:①全身型JIA 患儿;②联合使用激素、托珠单抗治疗的JIA 患儿;③非甾体类抗炎药和(或)改善病情抗风湿药治疗控制效果欠佳,或停药后复发应用阿达木单抗的患儿;④对本研究药物过敏的患儿;⑤不遵医嘱、不规则用药及不定期随诊患儿和失访患儿。所有患儿选用阿达木单抗治疗时家长或监护人均签署知情同意书。本研究通过我院伦理委员会批准(伦理审查号:2022-06-01-K08)。
1.2 治疗方法40 例患儿均给予皮下注射阿达木单抗注射液(40mg/0.8mL 预充式注射器,国药准字:S20190038)。体重≤30kg 的患儿给予20mg/次,biw;>30kg 的患儿给予40mg/次,biw,治疗24 周后给药间隔为每4 周1 次;同时口服甲氨蝶呤(MTX,2.5mg/片,上海上药信谊药厂有限公司,国药准字:H31020644),每周10~15mg·kg-1·m-2。病初均口服非甾体抗炎药物,如:双氯芬酸钠肠溶片(25mg/片,北京诺华制药有限公司生产,国药准字:H11021640)1~2mg·kg-1·d-1或塞来昔布胶囊(0.2g/粒,辉瑞制药有限公司,国药准字:J20140072)0.2g/d。治疗期间所有患儿均口服叶酸片、钙剂、维生素D 滴剂。
1.3 评价指标
1.3.1 主要评价指标 ①临床表现:详细记录患儿关节肿痛及活动受限等临床特征;②观察药物治疗前和治疗后4、12、24、32 周患儿血清炎症指标,包括C 反应蛋白(CRP)、红细胞沉降率(ESR)水平;③记录患儿活动性关节数目及幼年关节炎疾病活动性评分(JADAS27)[6]。
1.3.2 次要评价指标 观察治疗后4、12、24、32 周患儿血白细胞计数(WBC)、血小板计数(PLT)、中性粒细胞计数(NEUT)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、尿素氮(BUN)、肌酐(Cr)水平。
1.3.3 安全性评价指标 ①观察药物的不良反应:对患儿进行血常规全项、肝肾功能评估;观察严重感染(包括肺炎、咽炎、肠炎、皮肤脓肿及泌尿道感染、带状疱疹、结核及肝炎感染)、胃肠道不适(恶心、呕吐、腹泻)、血液系统(白细胞减少、贫血、血小板减少)、皮肤过敏等不良反应;②每3 个月监测结核、肝炎及肿瘤指标筛查。
1.4 统计学方法应用SPSS 26.0 统计软件对数据进行分析。正态分布的计量资料以表示,非正态分布计量资料以M(P25,P75)表示,两组间比较采用t检验,多组间比较采用单因素重复测量方差分析,方差不齐时采用非参数检验,计数资料以例数(百分比)表示,采用卡方检验和Fisher 确切概率法分析。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料40 例患儿中女21 例,男19 例,年龄3.6~13.4 岁。根据疾病类型将患儿分为三组:类风湿因子阴性多关节炎型[RF(-)pJIA]组10 例,类风湿因子阳性多关节炎型[RF(+)pJIA]组12例,附着点炎相关性关节炎型(ERA)组18 例。三组患儿的发病年龄及性别占比差异有统计学意义(P<0.001),见表1。RF(-)pJIA 组以腕关节受累为主,RF(+)pJIA 组以掌指关节、腕关节受累为主,ERA 组以髋关节受累为主,差异有统计学意义(χ2=91.48,P=0.000),见表1、2。
2.2 三组JIA 患儿治疗前后活动性关节数目比较治疗前,RF(-)pJIA 组10 例患儿受累关节共62个(23.66%),RF(+)pJIA 组12 例患儿受累关节共120 个(45.81%),ERA 组18 例患儿受累关节共80 个(30.53%),RF(+)pJIA 组活动性关节数目高于RF(-)pJIA 组及ERA 组,差异有统计学意义(χ2=524.00,P=0.00);治疗4 周时三组患儿活动性关节数目较治疗前明显减少,24 周时活动性关节数目减少更明显,组内、组间比较差异均有统计学意义(P<0.05)。见表3。
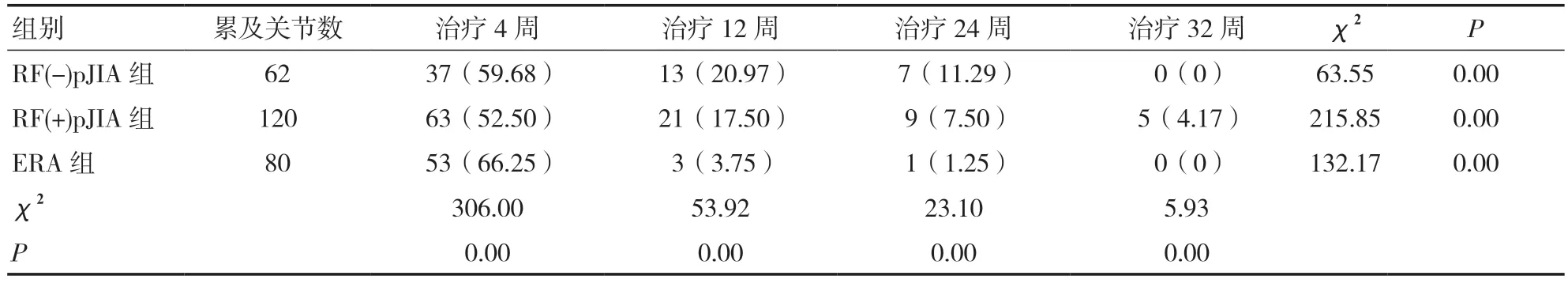
表3 三组JIA 患儿治疗前后活动性关节数目变化[n(%)]
2.3 三组JIA 患儿治疗前后CRP 水平比较治疗前,三组患儿CRP 水平均明显较高,但组间比较差异无统计学意义(P>0.05);治疗12 周时,三组CRP平均水平下降至正常范围内(<5mg/L),治疗24、32 周时CRP 水平均无升高,组内比较差异均有统计学意义(P<0.05),而组间比较差异无统计学意义(P>0.05)。见表4。
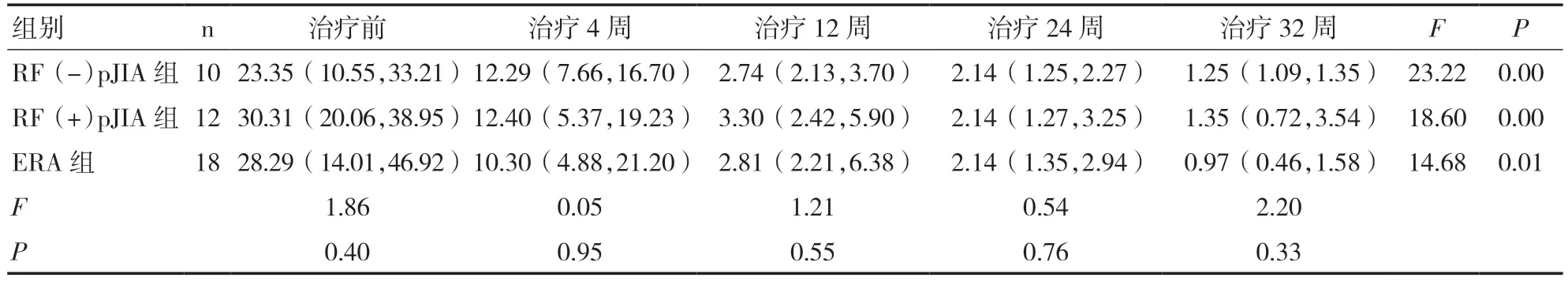
表4 三组JIA 患儿治疗前后CRP 水平比较(mg/L)
2.4 三组JIA 患儿治疗前后ESR 水平比较治疗前,三组患儿ESR 水平比较,差异无统计学意 义(P>0.05);治 疗4 周时,三组患儿ESR 水平较治疗前均有明显下降;ERA 组治疗12 周时ESR ≤20mm/h,RF(-)pJIA 组治疗24 周 时ESR ≤20mm/h,RF(+)pJIA 组ESR 有下降趋势,但24、32 周时仍高于20mm/h;三组患儿治疗前后组内比较差异均有统计学意义(P<0.05),治疗后组间比较差异均有统计学意义(P<0.05)。见表5。
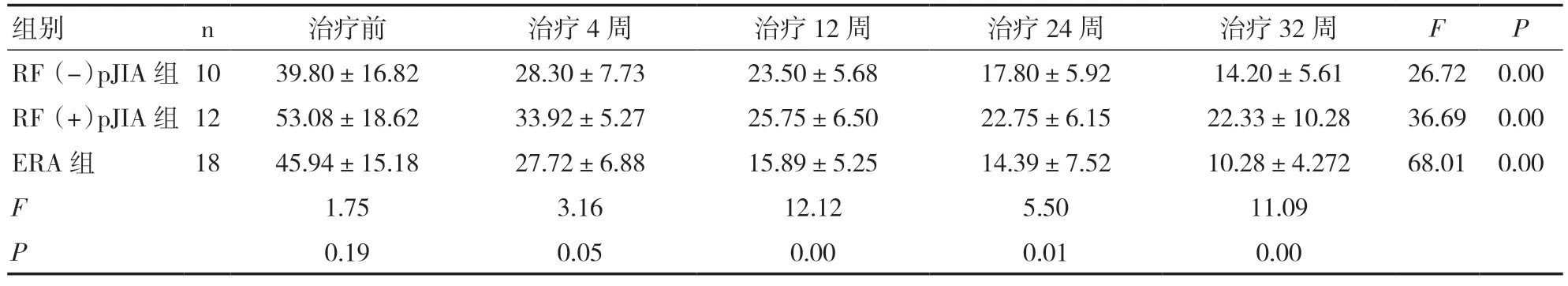
表5 三组JIA 患儿治疗前后ESR 水平比较(mm/h)
2.5 三组JIA 患儿治疗前后JADAS27 评分比较三组患儿治疗前JADAS27 评分均处于高疾病活动状态,差异无统计学意义(P>0.05);三组患儿治疗后不同时间点的JADAS27 评分与治疗前比较,差异均有统计学意义(P<0.01),而组间比较差异无统计学意义(P>0.05)。见表6。
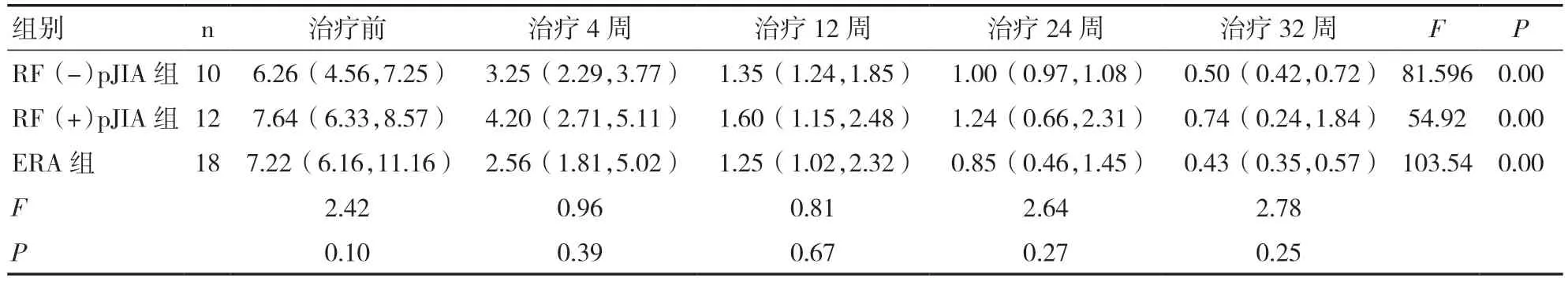
表6 三组 JIA 患儿治疗前后JADAS 27 评分比较(分)
2.6 JIA 患儿治疗前后血常规、肝功能、肾功能水平比较JIA 患儿治疗4 周后血WBC 较治疗前下降,Hb 升高,治疗后不同时间点比较差异有统计学意义(P<0.01)。治疗后不同时间点PLT、NEUT、ALT、AST、BUN、Cr 水平比较,差异无统计学意义(P>0.05)。见表7。
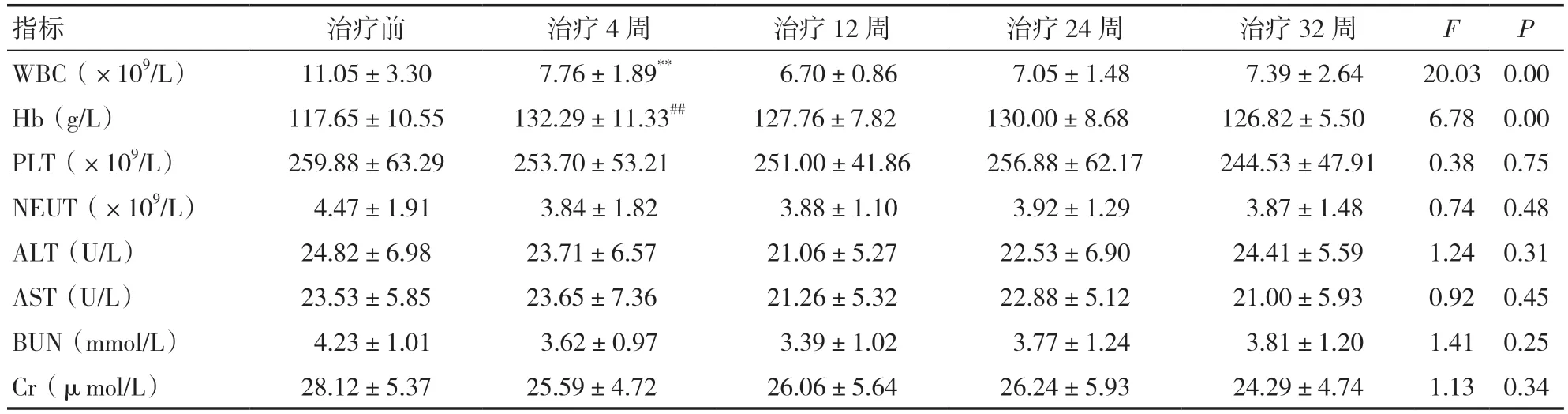
表7 JIA 患儿治疗前后血常规及肝肾功能比较
2.7 随访40 例患儿接受阿达木单抗治疗后均未出现不良反应。治疗24 周时,1 例患儿出现潜伏结核感染(PPD 试验阳性、胸部CT 及结核T 细胞亚群均阴性,无低热、消瘦等临床症状)。所有患儿筛查中无肝炎、EB 病毒感染,无新发肿瘤出现。所有患儿治疗期间均无呼吸道、消化道、皮肤感染及水痘、带状疱疹病毒等感染,无白细胞减少、肝肾功能损害。
3 讨论
JIA 仍然在儿童风湿性疾病中占主导地位,但非全身型JIA 由于早期以关节痛为主,容易被误诊为生长痛、滑膜炎,导致诊断延误,多数患儿就诊时已经处于中、重度疾病活动期。早期疾病活动期或合并不良预后因素时,若不积极治疗可导致病程迁延,缓解率不超过60%,且致残率高[7]。因此,早期积极治疗、尽快缓解患儿症状、减慢和阻止病情进展、尽快达标是JIA 治疗的主要目标,而JIA 的靶向治疗使早期达标成为可能。
肿瘤坏死因子-α(TNF-α)是JIA 发病机制中重要的细胞因子,可促进破骨细胞生成,促进滑膜细胞分泌白细胞介素(IL)-1β、IL-8、粒细胞-巨噬细胞集落刺激因子(GM-CSF),促进炎症反应,导致骨质破坏[8,9]。阿达木单抗为一种全人源化的单克隆抗TNF 抗体,可抑制炎症因子的释放、减低滑膜细胞的浸润、介入破骨细胞的活化、阻止血管翳的生成、阻止软骨及骨质进行性损害[10]。大量研究证实,阿达木单抗对多关节型JIA、少关节型JIA、儿童银屑病型关节炎有治疗价值,甚至在治疗JIA相关性葡萄膜炎中发挥重要作用[11~13]。
本研究40 例JIA 患儿中,RF(-)pJIA 10 例、RF(+)pJIA 12 例,均有腕关节、掌指关节、踝关节受累;ERA 18 例患儿以髋关节及骶髂关节受累为主,均处于疾病活动期同时伴有高危关节受累。早期均应用阿达木单抗治疗,治疗12 周时活动性关节数目及JADAS27 评分均有明显下降,同时血CRP、ESR、WBC 水平明显下降(P<0.001),患儿达到了低疾病活动状态,这与许瑛杰等[14]、Levall 等[15]报道的应用阿达木单抗治疗JIA 患儿的疗效均一致。因此,在JIA 患儿临床诊治中,对于有高危关节受累的非全身型JIA 并伴有血ESR 及CRP 炎症指标升高的患儿应早期启用阿达木单抗治疗,以尽快达到临床缓解,改善预后。
本研究发现RF(+)pJIA 组患儿血ESR 水平下降趋势低于ERA 组及RF(-)pJIA 组,治疗12 周时不同组间比较,差异有统计学意义(P<0.05),同时JADAS27 评分达到低疾病活动度需要的时间比ERA 组及RF(-)pJIA 组长。12 例RF(+)pJIA 患儿阿达木单抗治疗24 周时有2 例仍处于中度活动期,更换为托珠单抗治疗,考虑RF(+)pJIA 患儿机体B细胞产生RF 因子、抗CCP 抗体同时可产生一定的抗药抗体(Anti-drug antibody,ADA),从而降低阿达木单抗血药浓度,最终降低机体对药物的疗效应答,导致继发性治疗失败[16],而托珠单抗可通过IL-6 水平快速降低CRP、ESR 等炎症因子水平,降低疾病的活动度[17]。ERA 组患儿初期表现出高炎症反应,治疗12 周后均达标,治疗32 周时仍处于无疾病活动状态(P<0.001)。由于JIA 的高度异质性,阿达木单抗在治疗非全身型JIA 患儿时针对不同亚型,存在个体差异,在治疗效果欠佳时可更换不同机制的生物靶向药物。
本研究中RF(+)pJIA 患儿治疗前有轻度贫血,治疗后贫血纠正,考虑RF(+)pJIA 患儿疾病活动期T 细胞、巨噬细胞产生的TNF-α、IL-1、IL-6 等促炎因子可降低促红细胞生成素生成同时促进骨髓红系细胞凋亡,干扰铁离子代谢,导致贫血发生[18]。提示贫血可能与JIA 的疾病活动度有关。
本研究结果显示,在JIA 疾病活动早期使用阿达木单抗可迅速控制患儿症状及炎症指标,缩短治疗达标时间。本组患儿治疗24 周后,1 例(2.50%)出现潜伏结核感染,未出现局部皮肤过敏反应、胃肠道反应、肝肾功能损害及骨髓抑制,未出现肿瘤及感染乙肝、EB 病毒、水痘及带状疱疹。而Burmester 等[19]对23 458 例应用阿达木单抗治疗患者进行药物安全性分析,随访6 年半,发现JIA 患儿不良反应以阑尾炎及带状疱疹为主。Nicolai 等[20]报道85 例JIA 患儿应用阿达木单抗后11 例患儿并发水痘,2 例患儿合并带状疱疹。本研究提示在短期内应用安全性好,但治疗24 周时需评估结核感染,仍需长期随访和观察患儿治疗期间继发机会感染及肿瘤的发生率。就本次研究结果看,阿达木单抗治疗非全身型JIA 患儿疗效肯定,为患者的达标治疗提供全面支持。
综上所述,非全身型JIA 患儿疾病活动早期的积极治疗可改善预后,早期采用阿达木单抗治疗效果显著,可迅速控制炎症反应而达到临床缓解,安全性高。但阿达木单抗对JIA 不同亚型的疗效不一,本研究入组例数少,随访时间短,有待大样本及长期随访进一步的验证。

