长链非编码RNA ARAP1-AS1 在卵巢癌中的表达及作用机制研究
董冰 李翠萍 徐潇萌 王妍 李跃文 李兴媚
在女性生殖系统疾病中,卵巢癌是一种最常见的恶性肿瘤,由于疾病早期缺乏明显的影像学及生物学诊断指标,大部分患者在确诊时已进入晚期,且有研究证实卵巢癌的5 年生存率低于30%[1]。长链非编码RNA(lncRNA)是存在于细胞核或细胞质中并且长度超过200 个核苷酸的一组非编码RNA,主要功能是协助调控相关基因的表达。已有研究证明,lncRNA 的不同表达水平与各类肿瘤的生长或转移存在不同程度的相关性[2,3]。多项研究表明,不同的lncRNA 通过各自特定的信号通路参与多种肿瘤的发生、发展及侵袭[4,5]。有研究指出,lncRNA 的异常表达可通过相关信号通路定向调控与其相关的靶基因,从而参与卵巢癌的发病过程[6]。lncRNA ARAP1 反义AS1(ARAP1-AS1)是lncRNA家族中的一员,并且多项研究证明,在多种恶性肿瘤患者的血清中检测出ARAP1-AS1 表达水平异常,且与肿瘤恶性程度和病理分型均存在相关性[7,8],因此本研究多种试验方法对卵巢癌的病理分型及治疗预后进行分析,为卵巢癌的临床诊断及靶向治疗提供参考。本研究自2019 年1 月开始,于2021 年7 月结束,所有实验均在我院实验室进行并完成。
1 材料与方法
1.1 组织样本获得、培养及传代购买人正常卵巢表面上皮系细胞(IOSE-80)和4 个人卵巢癌细胞系(A2780、OVCAR3、CP70 和SKOV3),将细胞接种于RPMI1640 培养基,将上述细胞系放置于特定培养基,在37℃培养箱内进行培养,达到标准后,再经过消化、离心后继续培养。
1.2 细胞转染及MTT 测定使用特定试剂进行细胞转染,进一步建立ARAP1-AS1 或多态腺瘤样蛋白2(PLAGL2)敲除模型、miR-47353p 模拟物、抑制剂以及相应的对照。转染48h 后,完成细胞接种,在培养结束时,添加MTT 试剂,用微孔板分光光度计在570nm 处测定其吸光度。
1.3 逆转录-定量聚合酶链反应(RT-qPCR)完成RNA 分离后再将RNA 逆转录成cDNA。RT-qPCR采用SYBR 高级ExTaq Ⅱ轻型Cycler480 仪器,比较基因表达。验证人卵巢癌肿瘤组织及人正常卵巢上皮组织中ARAP1-AS1 表达差异。
1.4 细胞计数试剂盒-8(CCK-8)实验完成细胞转染后,进行细胞同步接种,再行恒温培养,加入CCK-8 后,测定各组细胞在450nm 处的吸光度值。
1.5 Transwell 迁移及侵袭实验用20μL 吸管尖端进行人工划痕,细胞培养后进行监测,刮痕采用跨孔膜法评价卵巢癌细胞的侵袭能力。将细胞转染并培养后,经4%多聚甲醛固定,苏木精染色,显微镜计数。
1.6 蛋白质印迹法(Western blot)用缓冲液提取细胞总蛋白,转移到PVDF 膜上。将蛋白样品进行聚丙烯酰胺凝胶电泳,在4℃下加入抗PLAGL2 的一抗体处理膜孵育过夜,采用电化学发光试剂盒检测条带信号的灰度值。
1.7 统计学方法所有计量资料均以均数±标准差()表示,所有实验重复进行3 次。使用SPSS 13.0 软件进行统计分析,采用矫正t检验和单因素变量方差分析法分别对两组内或两组间的结果进行比较分析。采用Pearson 进行相关性分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 ARAP1-AS1 和PLAGL2 在卵巢癌细胞系中的表达情况为了探究 ARAP1-AS1 和PLAGL2 在正常卵巢上皮细胞和卵巢癌细胞中的表达是否存在差异,我们采用 RT-qPCR 法检测发现,与正常卵巢上皮细胞IOSE-80 相比,ARAP1-AS1 在多种卵巢癌细胞系(A2780、OVCAR3、CP70 和SKOV3)中的表达水平均显著上调(见图1A)。同样,PLAGL2 也在卵巢癌细胞系中的表达水平显著上调(见图1B)。
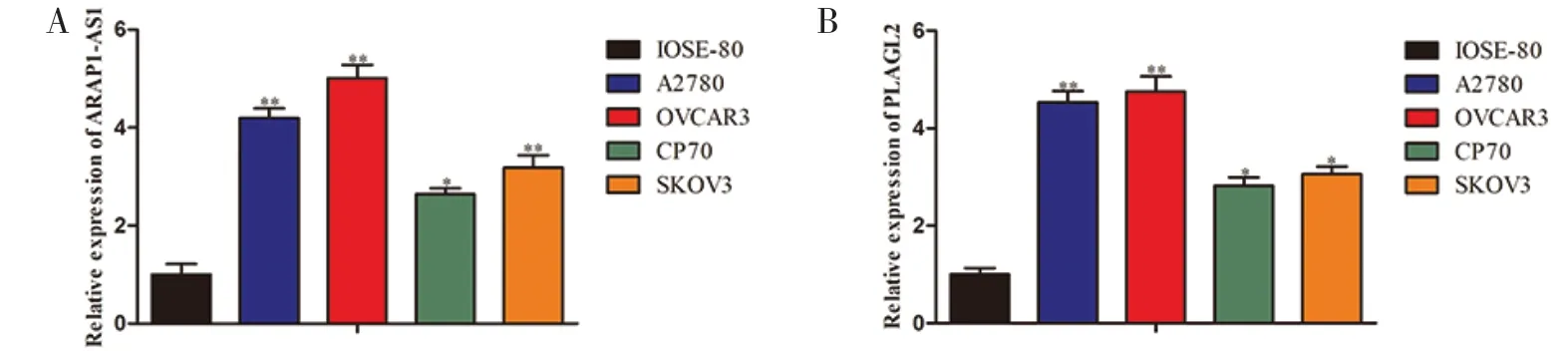
图1 ARAP1-AS1 和PLAGL2 在卵巢癌细胞系中的表达注:与IOSE-80 比较,*P<0.05,**P<0.01
2.2 沉默ARAP1-AS1 抑制卵巢癌细胞的增殖、迁移和侵袭RT-qPCR 实验证实ARAP1-AS1 表达沉默成功(见图2A);MTT 实验表明,ARAP1-AS1 的沉默导致了A2780 和OVCAR3 细胞活力显著下降(见图2B);集落形成实验结果显示,抑制 ARAP1-AS1 可抑制A2780 和OVCAR3 细胞的增殖(见图2C);由于ARAP1-AS1 的敲除,A2780 和OVCAR3细胞的迁移能力受到了抑制(见图2D);侵袭实验表明,ARAP1-AS1 下调导致卵巢癌侵袭细胞数量减少(见图2E)。
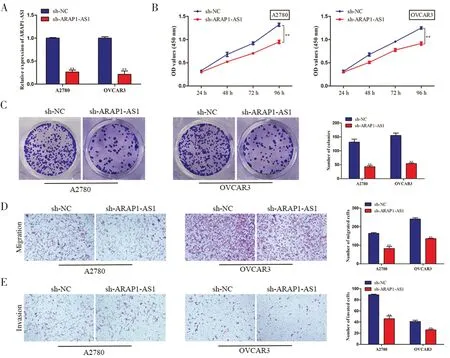
图2 沉默ARAP1-AS1 抑制卵巢癌细胞的增殖、迁移和侵袭
2.3 ARAP1-AS1 可 与miR-4735-3p/PLAGL2 相 互结合敲低ARAP1-AS1 后 PLAGL2 的表达水平明显下调(见图3A)。亚细胞定位发现,ARAP1-AS1在A2780 和 OVCAR3 两种细胞系的细胞质中呈现高表达状态(见图3B),表明ARAP1-AS1 主要定位于细胞质中。利用DIANA 和starbase 数据库进行生物信息学预测发现,ARAP1-AS1 和PLAGL2 与同一个miRNA 具有相互调节关系(见图3C)。荧光素酶报告实验显示,ARAP1-AS1 可结合miR-4735-3p,同时miR-4735-3p 可与PLAGL2 相互结合(见图 3D)。通过抗Ago2 和抗IgG RIP 实验进一步证明上述结论(见图3E)。
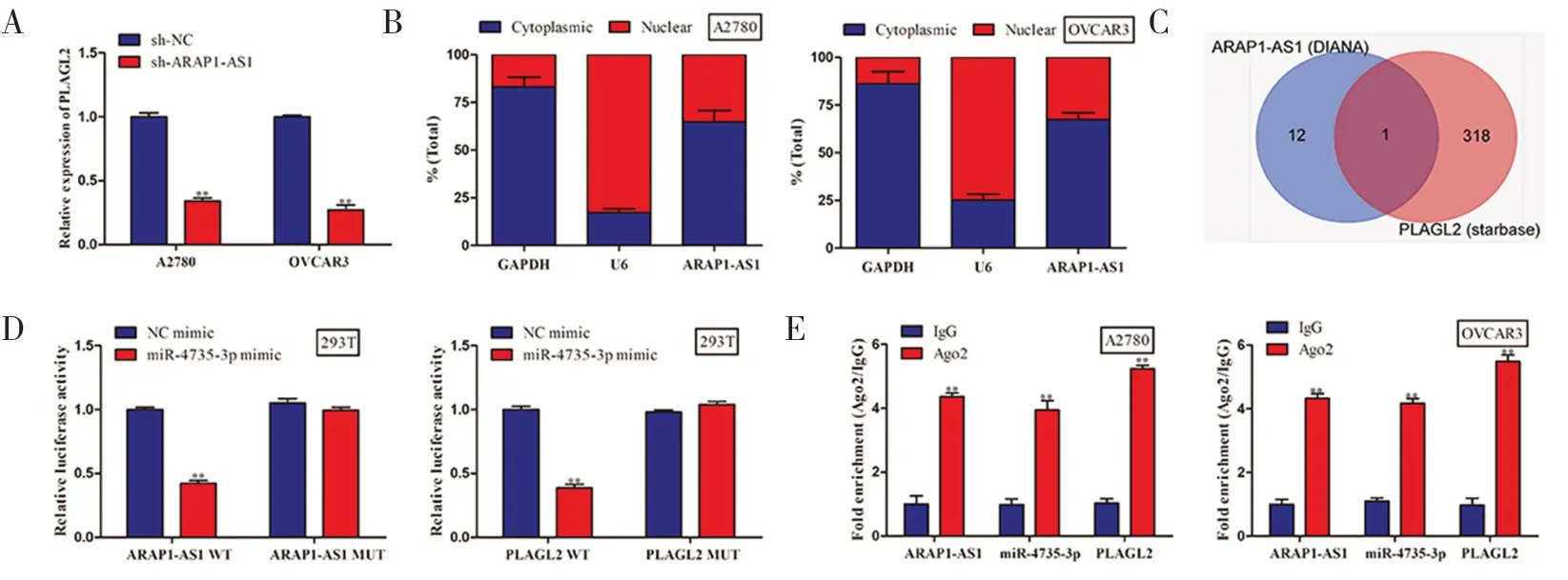
图3 ARAP1-AS1 可与miR-4735-3p/PLAGL2 相互结合
2.4 ARAP1-AS1 通过miR-4735-3p 调节PLAGL2的表达进一步实验表明,抑制miR-4735-3p 的表达可以明显上调PLAGL2 的表达,同时对ARAP1-AS1 进行敲减发现可以抵消部分miR-4735-3p 抑制物的作用,下调PLAGL2 的表达(见图4A)。进一步通过Western blot 实验对PLAGL2 的蛋白水平进行验证,结果与mRNA 水平保持一致。表明miR-4735-3p 可以调节PLAGL2 的表达,同时 ARAP1-AS1 可进一步对miR-4735-3p/PLAGL2 通路进行调节(见图4B)。
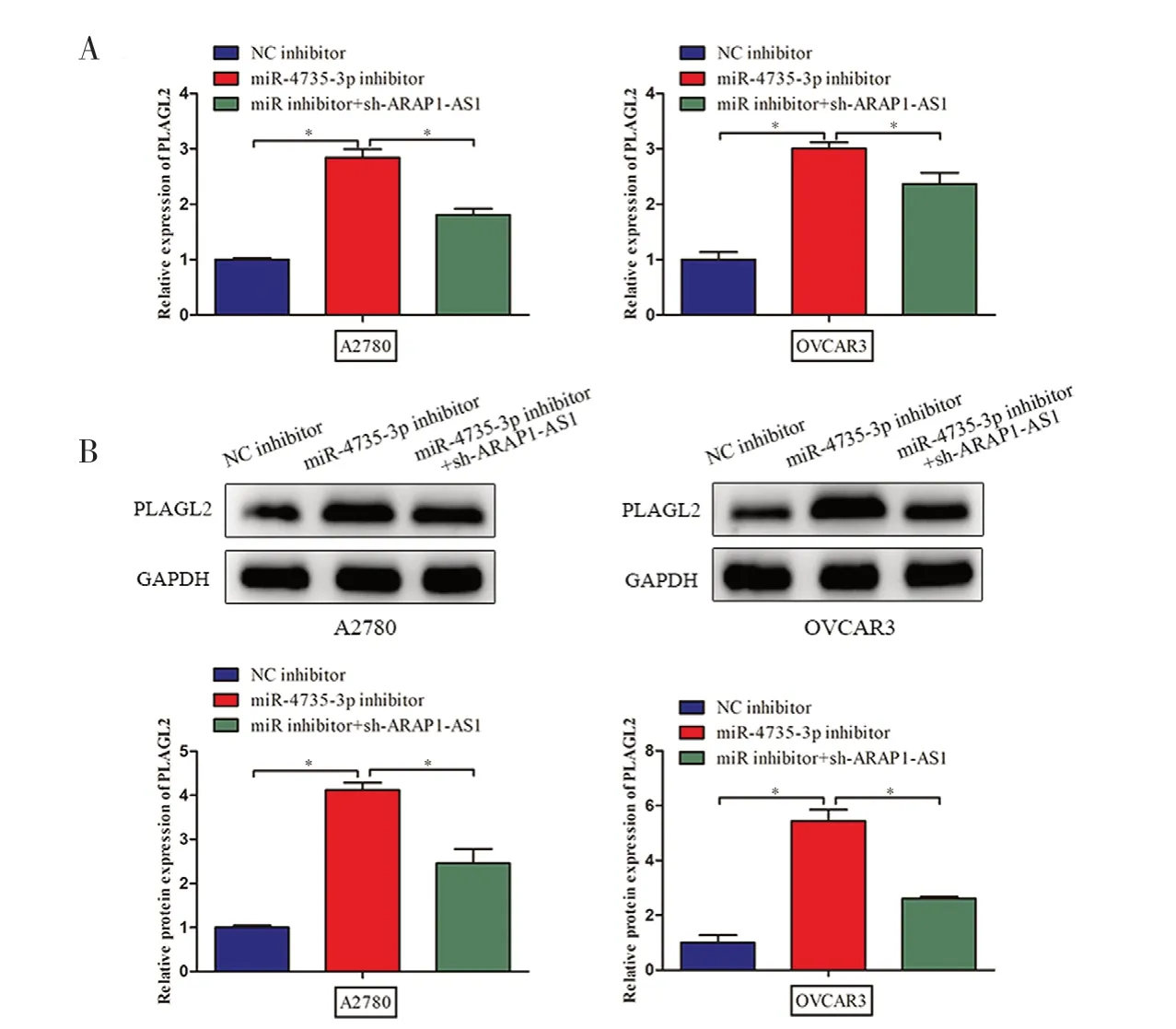
图4 ARAP1-AS1 通过miR-4735-3p 调节PLAGL2 的表达
2.5 ARAP1-AS1 通过miR-4735-3p/PLAGL2 通路在卵巢癌中发挥致癌作用我们敲低OVCAR3 细胞中ARAP1-AS1 的表达,抑制miR-4735-3p 的表达,同时进一步敲低PLAGL2,并通过RT-qPCR 分析验证了转染效率(见图5A)。MTT 实验显示,miR-4735-3p 抑制物逆转了sh-ARAP1-AS1 对细胞增殖的抑制作用,并在PLAGL2 沉默后恢复(见图5B)。集落形成实验表明,抑制miR-4735-3p 的表达可以增强OVCAR3 细胞的增殖能力,同时敲低 ARAP1-AS1 后OVCAR3 细胞的增殖能力下降(见图5C)。同样,抑制miR-4735-3p 的表达可以增强OVCAR3 细胞的迁移和侵袭能力,同时敲低ARAP1-AS1 后OVCAR3细胞的迁移和侵袭能力下降(见图5D)。
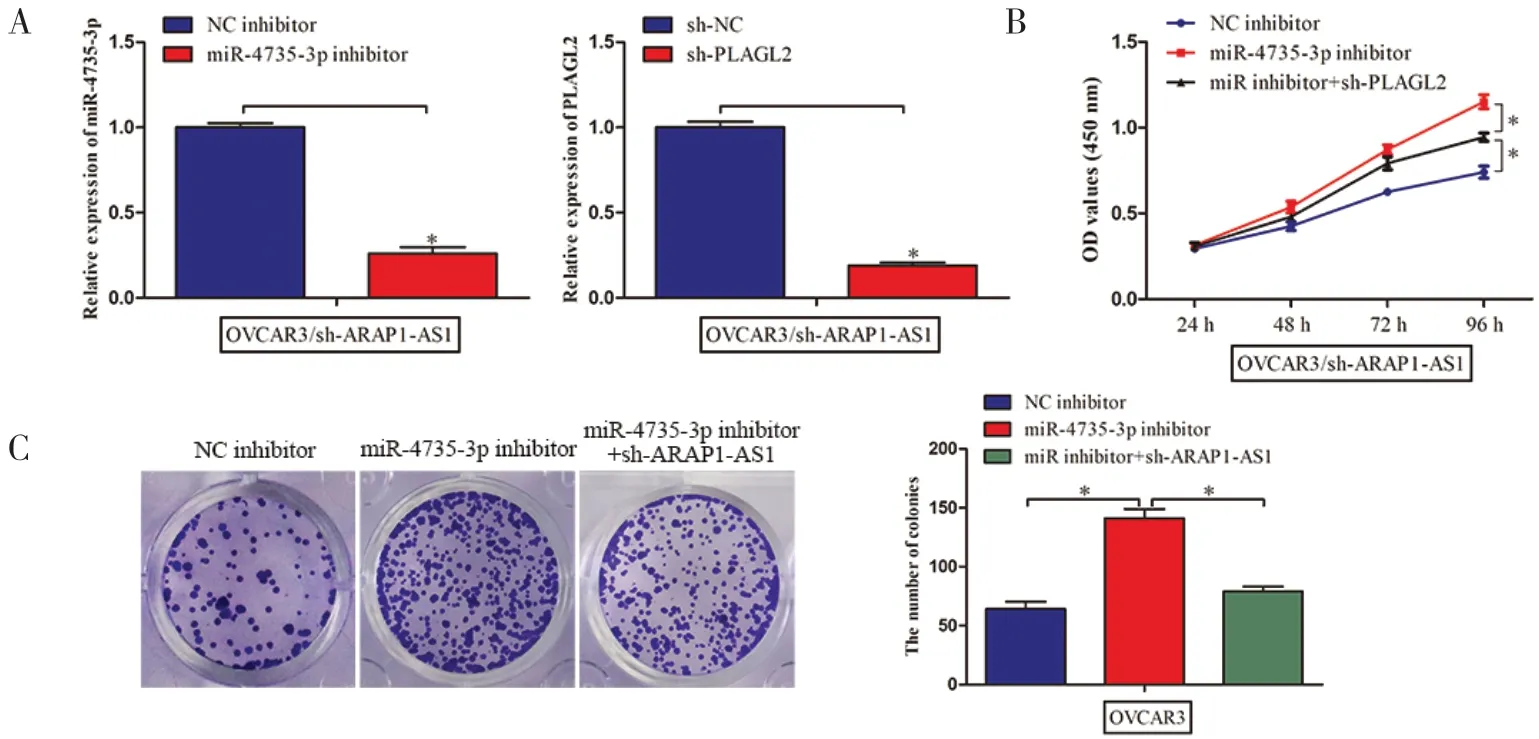
图5 ARAP1-AS1 通过miR-4735-3p/PLAGL2 轴在卵巢癌中发挥致癌作用
3 讨论
卵巢癌是女性生殖系统中最常见的肿瘤之一,也是全球女性癌症死亡的主要原因[9]。据报道,卵巢癌的死亡率在所有妇科癌症中排名第一[10]。大多数卵巢癌患者由于术后复发率高、预后较差等因素,造成晚期卵巢癌疗效不理想[11,12]。近年来,针对卵巢癌的发病情况及诊疗特点,有学者发现lncRNAs 在表观遗传、转录或转录后水平上调控基因的表达[13],同时异常表达的lncRNAs 在肿瘤发生和进展中扮演致癌基因或肿瘤抑制因子的角色[14]。lncRNAs 可以调控基因表达,进而影响许多重要的生理过程,可以作为染色质修饰因子以及转录调节因子和转录后调节因子等。本研究发现ARAP1-AS1 在卵巢癌细胞中高表达。
经过RT-qPCR 检测ARAP1-AS1 在卵巢癌细胞系和正常卵巢内皮细胞系中的表达水平,结果显示,ARAP1-AS1 在卵巢癌中的表达水平明显高于正常细胞,提示ARAP1-AS1 可能在卵巢癌中扮演着促癌角色。前期有研究证实lncRNA ARAP1-AS1 被认为是膀胱癌的促癌因子[15]。同时,TCGA数据库和实验也证实lncRNA ARAP1-AS1 在宫颈癌和子宫癌中表达上调[16]。在泛癌种中的研究表明,ARAP1-AS1 可能在肿瘤的发生发展中扮演着至关重要角色,基于此,靶向 ARAP1-AS1 可能是一种有效抑制肿瘤的治疗策略。我们通过MTT 及Transwell 实验表明,敲低ARAP1-AS1 对卵巢癌细胞增殖具有明显的抑制作用。
PLAGL2 具有高度保守的结构,可使转录因子PLAGL2 促进特异性基因转录的激活[17]。多个学者研究也证明,PLAGL2 在多种恶性肿瘤中表现出致癌功能,如结直肠癌、乳腺癌、前列腺癌、胶质瘤和卵巢癌[18~20]。在此,本研究结果揭示了PLAGL2在卵巢癌细胞中的表达水平高于正常卵巢内皮细胞系。ARAP1-AS1 主要分布在细胞质中,由于ARAP1-AS1 和PLAGL2 均在卵巢癌细胞中高表达,表明ARAP1-AS1 可能通过 ceRNA 机制在卵巢癌中发挥作用。结合生信分析和实验验证,揭示了ARAP1-AS1 通过受体化miR-4735-3p 来提高PLAGL2 水平,在卵巢癌中起致癌作用。具体为抑制miR-4735-3p 削弱了敲除ARAP1-AS1 所导致的增殖抑制作用,同时敲除PLAGL2 可以减弱上述效应。敲除 ARAP1-AS1 可以减弱miR-4735-3p 抑制物导致的促增殖和迁移作用。同样的调控关系也在膀胱癌中得到证实,即ARAP1-AS1 可以通过ceRNA 机制调节miR-4735-3p/NOTCH 轴的表达[15]。
综上,通过本项研究我们阐明了ARAP1-AS1通过靶向miR-4735-3p/PLAGL2 通路诱导卵巢癌细胞的恶性行为,这为ARAP1-AS1 可能作为卵巢癌治疗的新靶点提供了强有力的证据。

