银腺杨生长素受体基因PagFBL3 对茎生长发育的影响*
左雯腾 孟佳慧 卢孟柱 王留强,2
(1.林木遗传育种全国重点实验室 国家林业和草原局林木培育重点实验室 中国林业科学研究院林业研究所 北京 100091;2.南方现代林业协同创新中心 南京林业大学 南京 210037;3.省部共建亚热带森林培育国家重点实验室浙江农林大学林业与生物技术学院 杭州 311300)
在植物次生生长中,植物激素起着重要的调节控制作用。其中,生长素是一类具有极性运输特性的天然植物内源激素,普遍存在与低、高等植物中,处于植物生长发育的调控中心(Leyser, 2018)。它主要在茎尖、根尖及其它幼嫩组织合成后,以形态学上端向下端的极性运输方式成为长距离运输的信息携带者,通过一系列的信号转导途径调节植物生长发育的诸多生理过程,如维管组织形成、根伸长、不定根的形成、顶端优势、向性反应、胚胎发生以及维持叶片和花的形态建成等(Bowmanet al., 2008)。研究表明,顶端分生组织产生的生长素不仅参与维管组织的分化和生长,还能促进形成层细胞的增殖(Smetanaet al., 2019;Zhenget al., 2021)。Nilsson 等(2008)发现在转基因杂交山杨(Populus tremula×P.tremuloides)中,生长素浓度的降低导致木质部细胞分裂减少,同时还发现,生长素响应基因PttHB8以及生长素/吲哚乙酸(Aux/IAA)家族基因的表达模式与生长素浓度有着密切的关系。Baba 等(2011)还发现杂交山杨在休眠期间由于形成层对生长素响应能力降低,致使形成层细胞停止分裂。Hu 等(2022)揭示了生长素和赤霉素通过破坏DELLAARF7-AUX/IAA 三元复合体,释放ARF7 对下游基因WOX4、PIN1的转录调控,进而协同调控形成层活动。因此,认为一定浓度的生长素是形成层活动和次生维管组织发育所必须的,且发挥重要的调控作用。
生长素在植物生长发育中通过信号转导途径来发挥重要的调控作用,而生长素信号转导至少需要3个蛋白家族的成员进行调控:生长素运输抑制剂F-box家族的TIR1/AFB 蛋白,生长素转录抑制因子Aux/IAA以及生长素应答因子ARF(auxin response factor)(Yuet al., 2013)。其中,生长素受体是该信号转导途径的关键因子,TIR1(transport inhibitor response 1)在拟南芥(Arabidopsis thaliana)中首次被鉴定出来,是一个含有F-box 的蛋白质(Rueggeret al., 1998)。在植物体内,当生长素浓度较低时,TIR1 不能与转录抑制因子Aux/IAA紧密结合,而Aux/IAA 与ARF 结合,抑制了ARF 的转录活性;当生长素浓度较高时,细胞核中的IAA 与SCFTIR1复合体(泛素连接酶3)中的TIR1 结合,可以促进SCFTIR1复合体与Aux/IAA 蛋白识别,形成SCFTIR1-Aux/IAA 复合体,启动Aux/IAA 蛋白的泛素化过程,最终被26S 蛋白酶体降解,使ARF 启动或抑制生长素下游响应基因的转录,进而调控植物的生长发育(Salehinet al., 2015)。另 外,AFB1、AFB2、AFB3 与TIR1 具有类似的作用,都能够作为生长素受体和生长素结合后,再与SCF 结合形成复合物,从而导致Aux/IAA 与之结合,参与生长素调节的反应(Dharmasiriet al., 2005)。
1 材料与方法
1.1 试验材料
银腺杨杂种无性系84K 杨用于基因克隆、基因表达分析和遗传转化。所有植物材料均由中国林业科学研究院林木遗传育种全国重点实验室保存并繁殖。杨树组培苗于生根培养基(1/2 MS 基础培养基,0.05 mg·L-1IBA,0.02 mg·L-1NAA,5 g·L-1琼 脂 粉 和30 g·L-1蔗糖,pH 5.8~6.0)中培养,置于人工气候室(25 ℃,16 h/8 h 光照/黑暗,50 μmol·m-2s-1光照强度)。生长20 天后,将其移栽至装有营养土(土壤∶珍珠岩 =3∶1,V/V)的花盆(口径×底径×盆高=12 cm × 8 cm ×15 cm)中,置于同等条件下的培养室中继续培养。选取了培养60 天、生长状态良好、且长势一致的非转基因84K 杨植株进行PagFBL3基因组织表达特异性分析,所需的根、幼叶(顶端第3 片叶)、成熟叶(顶端第7 片叶)、1/2 株高处茎部、木质部、维管形成层和韧皮部分别取自5 个独立非转基因84K 杨植株。选取了培养30 天、生长状态良好、且长势一致的转基因株系和非转基因84K 杨植株,定量分析PagFBL3基因在不同基因型植株中的表达情况,所用的幼苗顶端第5片叶取自各5 个独立植株。以上试验均重复取样3 次,样品液氮速冻置于-80 ℃保存用于RNA 提取。
本氏烟草(Nicotiana benthamiana)用于瞬时转化。种子表面消毒后播撒于1/2 MS 固体培养基中,1 周后移栽至营养土(土壤与珍珠岩体积比为 3∶1)中,置于培养室(25 ℃,16 h/8 h 光照/黑暗)中继续培养20 天后,取健康且平展的成熟叶片用于瞬时转化农杆菌(Agrobacterium tumefaciens),研究基因亚细胞定位。
1.2 载体和试验试剂
本研究所使用的中间载体pDNOR207、植物过表达载体pMDC32、大肠杆菌(Escherichia coli)DH5α 及农杆菌GV3101 菌种均由本实验室保存。PCR 引物合成和序列测序由生工生物工程(上海)股份有限公司完成。高保真扩增酶Primer STAR HS、普通扩增酶PCR-Mix、定量试剂盒(SYBR Premix Ex TaqTM Kit)、反转录试剂盒(PrimeScriptTM RT reagent Kit)、DNA marker 均为Takara 公司产品。胶回收试剂盒、PCR 产物纯化试剂盒和质粒小量提取试剂盒均为Omega 公司产品。
1.3 试验方法
1.3.1 生物信息学分析 利用ExPASy(https://web.expasy.org/protparam/)分析PagFBL3 蛋白的理化性质。利用Phytozome 网 站(https://phytozome.jgi.doe.gov/pz/portal.html)获得拟南芥和毛果杨(Populus trichocarpa)生长素受体家族FBL 的氨基酸序列;同时,利用NCBI 网站(https://www.ncbi.nlm.nih.gov/)查找获取不同物种中FBL3 蛋白的氨基酸序列。利用DNAMAN和MEGA11 软件分析FBL 蛋白氨基酸序列相似性和系统进化关系。系统进化树采用邻接法(neighborjoining method)构建,节点旁的数字表示基于1 000 次重复次数的自展值(bootstrap)。
1.3.2 RNA 提取、cDNA 合成以及RT-qPCR 分析采用CTAB(cetyltrimethylammonium bromide)法提取上述不同杨树组织样品的总RNA。利用RQ1 RNasefree DNase(Promega,Madison,WI,USA)处理总RNA去除DNA 污染。利用反转录试剂盒(PrimeScriptTM RT reagent Kit)合 成cDNA。使 用SYBR Premix Ex TaqTMⅡ试剂盒(TaKaRa,Dalian,China),在实时荧光定量PCR 仪器Light Cycler 480(Roche Applied Science,Penzberg,Upper Bavaria,Germany)上进行RT-qPCR 分析,以2 个84K 杨PagActin基因作为内参,每个试验均设有3 次生物学重复和4 次技术重复,相对表达量根据2-ΔΔCT方法进行计算。用于RT-qPCR 的基因特异性引物使用Primer 5 软件设计,其序列见表1。

表1 引物序列Tab.1 Primer sequences
1.3.3 基因克隆、载体构建和84K 杨遗传转化 以84K 杨cDNA 为模板,利用特异性引物,扩增PagFBL3基因编码区序列,通过Gateway BP 反应重组进入中间载体pDNOR222 后,再通过Gateway LR 反应亚克隆至终载体pMDC32,电击转化农杆菌GV3101,以农杆菌介导的叶盘法转化84K 杨(Liuet al., 2014)。简言之,在含有200 mg·L-1特美汀和3 mg·L-1潮霉素的芽分化培养基上筛选抗性芽,随后在含有同样浓度抗生素的生根培养基上诱导生根。摘取幼苗叶片,提取基因组总DNA 和总RNA,利用PCR 技术对其进行分子鉴定。
1.3.4 亚细胞定位分析 通过Gateway LR 反应,将PagFBL3基因编码区序列(不含终止子)亚克隆至pEarleyGate 101 载体上,构建35S::PagFBL3-GFP 融合表达载体,电击转化农杆菌GV3101。利用农杆菌介导的遗传转化瞬时侵染烟草叶片,黑暗培养48 h 后,在蔡司LSM510 共聚焦显微镜(Carl Zeiss,Oberkochen,Germany)下观察烟草表皮细胞内的GFP 荧光信号。
1.3.5 转基因杨树的表型鉴定和组织切片分析 选取20 天左右、生长状态良好且长势一致的转基因和非转基因84K 杨组培苗移栽至装有营养土的塑料盆中,置于温室中继续培养60 天后,对各个植株的株高、地径和节间数进行测定。每次试验至少3 次生物学重复,每次至少测量9 株材料。
尹军平还表示,随着“三通一达”、顺丰、德邦等的陆续上市,整合大幕实际上已然拉开,而且行业内并购标的也在快速增加,一方面第一代物流企业家已到退休年龄,而很多二代不太愿意接班;另一方面,80、90年代出生的企业家家族观念没那么强,很多企业家创业成功后并不介意通过并购退出。
同时,截取培养60 天的杨树自顶端向下第6、12、15 节间中部(约0.5~1 cm)的茎部材料,将其放置固定于样品架上,通过震荡切片机(LEICA VT1000)进行横切(切片厚度为50 μm)。将切片置于0.05%甲苯胺蓝O(Toluidine blue O,TBO)溶液中染色后,用Olympus BX51 显微镜进行观察并及时拍照,并利用Image J 软件测量照片中木质部的宽度,每次试验至少3 次生物学重复,每次至少测量3 个不同区域。
1.4 数据统计
应用Microsoft Excel 和SPSS Statistics 24 软件对数据进行处理,并使用t检验法分析差异显著水平。
2 结果与分析
2.1 PagFBL3 基因克隆和序列分析
以84K 杨cDNA 为模板,使用特异引物通过PCR扩增获得PagFBL3基因编码区序列。系统进化关系分析结果表明,PagFBL3基因与拟南芥、毛果杨的FBL3 同属于一个系统发育分支,系统关系较近(图1A)。多序列比对结果显示,PagFBL3基因与拟南芥、毛果杨、柳树(Salix babylonica)等物种的FBL3基因序列相似度较高(图1B),其中与拟南芥和毛果杨核酸序列相似度分别为71.4%和98.48%,蛋白序列相似度为72.96%和97.72%,一些区域存在着明显的保守序列,可能是重要的功能结构域。PagFBL3基因编码区全长1 716 bp,可编码571 个氨基酸残基的蛋白质,蛋白分子量约为64.14 kDa,理论等电点(pI)为6.51。
2.2 PagFBL3 的组织表达和亚细胞定位分析
为了研究PagFBL3基因的组织表达特异性,采用RT-qPCR 技术分析了PagFBL3基因在84K 杨根、幼叶(顶端第3 片叶)、成熟叶(顶端第7 片叶)、1/2 株高处茎部、木质部、维管形成层和韧皮部中的表达。结果显示,PagFBL3基因在各组织中均有表达,并在成熟叶、次生茎及其次生木质部中具有较高表达,在维管形成层和韧皮部中也有一定的表达量,相对较低(图2A)。
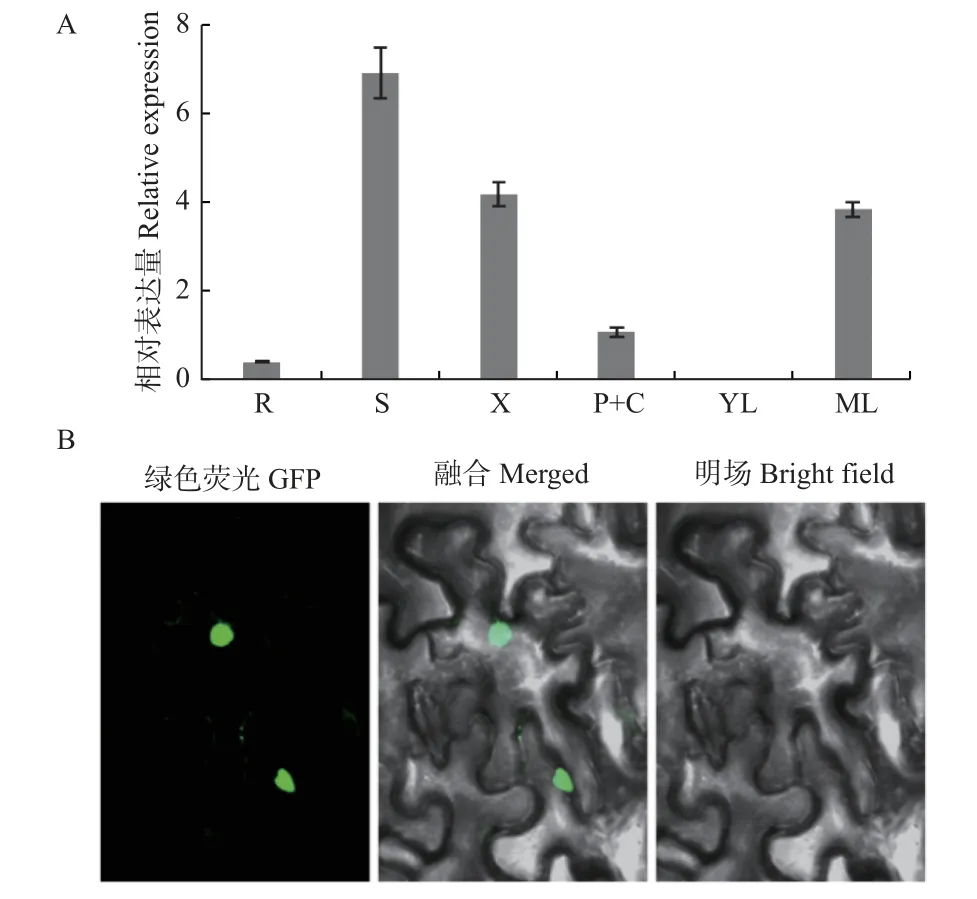
图2 PagFBL3 基因在84K 杨不同组织中的表达(A)及PagFBL3 的亚细胞定位分析(B)Fig.2 Expression of PagFBL3 in different tissues of 84K poplar(A) and subcellular localization (B) of PagFBL3
构建35S::PagFBL3-GFP 融合表达载体,通过瞬时转化本氏烟草叶片,并检测叶片中的GFP 信号。结果发现,GFP 荧光信号分布于细胞核,表明PagFBL3 是一个核定位蛋白质(图2B)。
2.3 过表达PagFBL3 转基因杨树的获得及其表型鉴定
为了进一步研究PagFBL3基因在杨树生长发育中的作用,构建了植物过表达载体35S::PagFBL3,通过农杆菌介导的叶盘法创制转基因杨树,并通过再生芽、抗生素筛选和基因组DNA 分子检测鉴定阳性转基因植株,共鉴定了11 个独立转基因株系(OE1-OE11)(图3A-D),进一步采用实时定量PCR 检测PagFBL3基因在各转基因和非转基因84K 杨中的相对表达水平,与非转基因84K 植株相比,PagFBL3在各转基因株系中的相对表达量水平均有不同程度的提高,表明PagFBL3已成功转入84K 杨中,并能够过量表达(图3E)。从中选取2 个表达量较高的独立转基因株系(OE5 和OE7)用于后续的表型比较和功能分析。
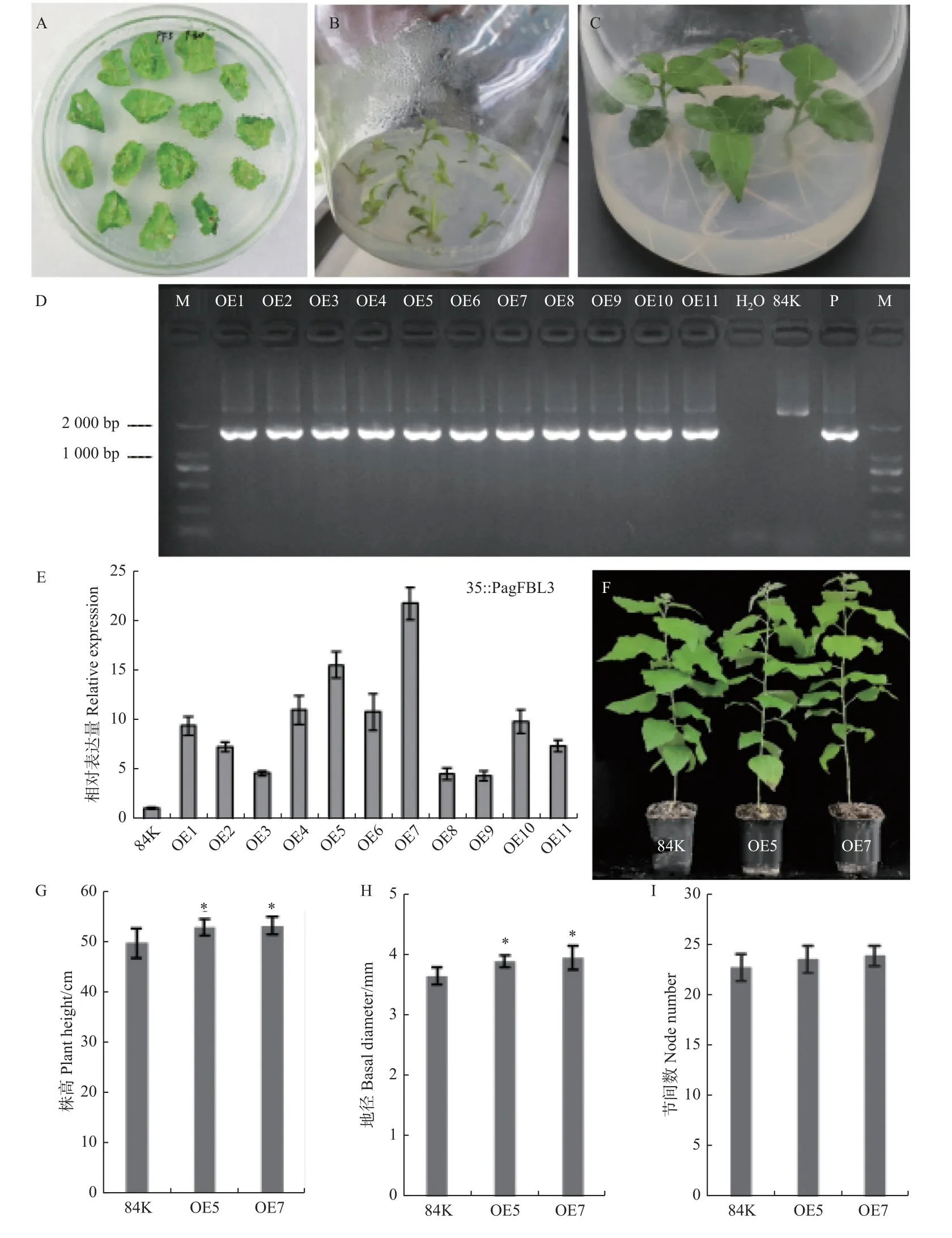
图3 过量表达PagFBL3 转基因杨树表型分析Fig.3 Phenotypes of transgenic plants overexpressing PagFBL3 gene
将20 天的生长状态良好且长势一致的过表达(OE5 和OE7)转基因和非转基因84K 杨(对照)组培苗移栽至装有人工土的塑料盆中,置于温室培养60天后,观察其表型变化,并测定其株高、地径和节间数。与非转基因84K 杨相比,两个过表达转基因的叶片形态结构没有差别,长度和宽度以及长宽比也没有显著差异(图3F)。株高和节间的统计结果显示,过表达PagFBL3转基因植株的株高均显著高于非转基因84K 杨6.3%和6.9%,且差异随着植株生长更加明显,而二者的节间数则无明显差异(图3G,I);地径的统计结果显示,过表达PagFBL3转基因植株的地径均大于非转基因84K 杨,且存在显著差异,分别增加了6.7%和8.5%(图3H)。以上结果表明,PagFBL3基因参与了84K 杨茎部的次生生长和发育。
2.4 过表达PagFBL3 对杨树生长和木质部发育的影响
为进一步揭示PagFBL3基因在杨树茎部生长发育中的作用,对生长60 天过表达PagFBL3转基因和非转基因84K 杨茎段的第6、12 和15 节间进行解剖分析,并统计木质部宽度。结果显示,木质部细胞的形态学特征也没有明显差异,但过表达转基因植株的第12 和15 节间木质部宽度明显大于非转基因84K杨(图4A)。其中,过表达PagFBL3转基因第12 节间的木质部宽度比非转基因84K 杨高出11.6%和15.7%,第15 节间差异更显著,高达17.3%和19.9%(图4B)。以上结果表明过表达PagFBL3基因影响了植株次生生长,主要表现在株高、地径和茎部木质部发育方面。
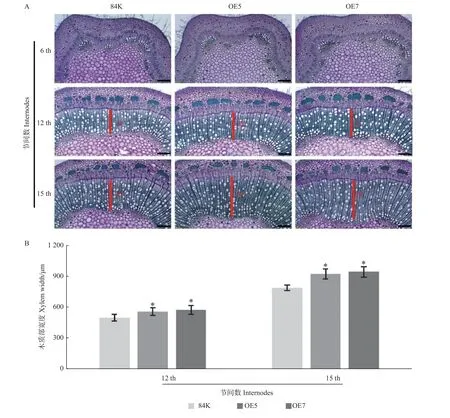
图4 过表达PagFBL3 对转基因杨树木质部发育的影响Fig.4 Effects of PagFBL3 gene on xylem development of transgenic poplar
3 讨论
生长素与生长素受体结合是研究生长素信号传导途径的一个关键环节,生长素信号的传导离不开生长素受体参与,作为生长素信号通路最上游的调控因子,控制着生长素信号传导开关(Peer, 2013)。生长素受体基因(TIR1/AFBs)介导的生长素信号通路在植株生长发育过程中起着重要作用,如调控植物器官发生、子叶和根系发育,响应生物逆境胁迫和非生物逆境胁迫,维持植株的正常发育等(Chenet al., 2015)。在本研究中,生长素受体基因PagFBL3能够促进转基因杨树木质部发育,显著增加了木质部宽度,提高了转基因杨树的径向生长,同时增强了转基因杨树的高生长。因此,开展生长素受体相关研究对于揭示生长素在树木次生生长中的作用机制具有重要意义。
目前,对于植物生长素受体基因的研究多集中在不定根发育方面。拟南芥TIR1基因明显增加了侧根的数量(Lakehalet al., 2019),AtAFB3可特异地响应硝酸盐信号调控主根长度及侧根发生密度(Vidalet al.,2010),afb4缺失型突变体侧根的数量明显少于野生型幼苗(Huet al., 2012)。水稻TIR1和AFB2受miR393调控下调表达,导致主根和根冠增长,而过表达OsTIR1基因显著促进转基因水稻不定根和侧根的发生,增加不定根数目和侧根密度(Guoet al., 2021)。然而,对于植物地上部分的生长发育,尤其是次生生长研究较少。拟南芥生长素受体TIR1/AFB 通过参与生长素信号通路影响植株的叶片发生数目及子叶生长的偏上性状(Si-Ammouret al., 2011)。水稻OsTIR1基因促进分蘖,显著增加转基因植株地上部生物量(Guoet al., 2021)。在木本植物杨树中,生长素受体FBL基因家族成员FBL1的较高表达促使转基因杨树比非转基因植株具有了更宽的韧皮部、木质部和更多的形成层细胞层;此外,过表达PagFBL1基因不仅能够增加转基因84K 杨的根系生物量(Shuet al., 2019),还能够影响转基因植株的株高、地径和地上部分生物量等(舒文波等, 2015),以上结果表明,FBL1 介导的生长素信号转导系统对木本植物生长发育具有重要的影响。
本研究克隆了银腺杨生长素受体家族基因PagFBL3,序列分析和系统发育进化树分析表明,该基因与毛果杨、拟南芥的FBL3基因序列相似度较高。实时荧光定量PCR 研究发现,PagFBL3基因主要在成熟叶和次生茎中表达量较高,且编码蛋白定位于细胞核,这与前人的研究结果一致(Shuet al., 2015),该结果表明PagFBL3基因可能参与茎的次生生长发育中发挥重要作用。为了进一步探究PagFBL3对茎生长发育的影响,本研究创制了过表达PagFBL3基因的转基因杨树,并比较了生长60 天的转基因植株盆栽苗的生长和木质部发育情况。与非转基因84K 杨相比,过表达PagFBL3转基因杨树株高明显高于非转基因杨树,说明了PagFBL3对杨树高生长起着正调控作用(图3)。同时,过表达PagFBL3促进转基因杨树木质部发育,显著增加了木质部宽度,提高了转基因杨树的径向生长(图4)。
以上结果表明PagFBL3 与PagFBL1 虽然是杨树生长素受体不同的成员,但都可能作为生长素信号通路最上游的调控因子,通过过量表达增强生长素信号转导途径,引起了下游相关基因表达(如Aux/IAA、ARF 等),促进了杨树茎段的次生生长。生长素能够诱导杨树Aux/IAA9-ARF5 模块,直接激活两个HDZIP III 转录因子基因的表达,启动维管形成层细胞向次生木质部的分化,从而促进木材形成(Xuet al.,2019),但生长素受体PagFBL3 是否与Aux/IAA9 或其它Aux/IAA 相互作用,又影响哪些下游相关基因的表达,进而调控树木次生生长尚不清楚;另外,本文仅对生长60 天以内的转基因植株盆栽苗进行了生长和木质部发育检测,对全生长季及多年生植株的表现尚不明确,且分子作用机制尚未探索,包括PagFBL3基因受哪些上游转录因子调控,其具体上游分子调控机制有待解析,这些研究结果将对全面了解生长素受体在次生生长中的作用机制提供帮助,也为我国林木木材品质遗传改良提供相应的理论基础。
4 结论
本研究从银腺杨‘84K’中克隆了一个生长素受体基因PagFBL3,该基因编码区全长1 716 bp,编码571个氨基酸残基的核定位蛋白质。PagFBL3基因在根、茎和叶中均有表达,并在成熟叶和次生茎中表达量较高。与非转基因杨树相比,过表达PagFBL3转基因杨树株高明显高于非转基因杨树,说明了PagFBL3对杨树高生长起着正调控作用。同时,过表达PagFBL3促进转基因杨树木质部发育,显著增加了木质部宽度,提高了转基因杨树的径向生长。以上研究结果表明,PagFBL3基因介导的生长素信号转导途径对木本植物生长发育具有重要的影响,但其调控机制有待进行深入解析。

