东北鼠李雌雄异株个体对种间竞争响应的性别差异*
张 琦 叶尔江·拜克吐尔汉 王 娟
(1.北京林业大学森林资源与生态系统过程北京市重点实验室 北京 100083;2.新疆农业大学林学与园艺学院 乌鲁木齐 830052)
生物繁殖行为有2 个相悖的假说。一个是代谢燃料假说,假设个体在资源不足或受其他压力影响时放弃繁殖,并将其有限的资源投资于与繁殖无关的行为(Wadeet al., 1992; Wadeet al., 1996);另一个是不惜一切代价的繁殖假说,假设当面临资源供应不足时,个体会继续繁殖或增加其繁殖行为(Boonstraet al.,2001)。植物通过产生果实和种子进行繁殖,将基因传递给下一代(Vergottiet al., 2019)。然而,繁殖对植物来说代价高昂,受气候、植食和竞争等压力的影响(Vergottiet al., 2019; le Roncéet al., 2020)。在受到食草动物攻击后,植物可能会延迟繁殖或者减少繁殖产量(Kersch-Beckeret al., 2012)。可利用资源的减少也会导致植物繁殖产量的下降(Wanget al., 2016)。如植物受到落叶等损害后,会通过减少繁殖来维持叶片产量(Tulleret al., 2018)。此外,林分密度对树木的生长和繁殖力也有负面影响(Guariguata, 1999)。研究发现当环境恶化时资源分配更有利于繁殖(Kellyet al.,2002; Pearseet al., 2016)。那么在相邻异种的竞争影响下,植物会选择降低繁殖产量还是增加繁殖产量,值得进一步探讨。
相邻异种间的相互关系可以是积极促进作用,也可以是消极抑制作用(Krnaet al., 2009)。邻体竞争是相邻个体间为争夺生存条件而产生的相互抑制作用(Harperet al., 1961)。来自相邻异种的竞争会影响树木的资源获取,从而改变树木的生物量分配,同时对植物生长产生抑制作用(Yanget al., 2019)。在对柚木(Tectona grandis)的研究中发现,邻体竞争抑制柚木胸径生长(Hitsumaet al., 2021)。日益激烈的邻体竞争也会给树木繁殖带来不利影响(Songet al., 2021)。一些研究认为同种邻居比异种邻居更具竞争力(Pretzschet al., 2009),种内竞争导致树木胸径生长受到抑制(Yanget al., 2019)。另一些研究则认为同种邻居对生长没有显著影响,而异种邻居对生长具有很强的负面影响(von Oheimbet al., 2011)。这意味着植物个体能否在野外成功生长不只取决于种内个体竞争程度,也取决于种间竞争结果(Sánchez-Vilaset al., 2011)。特别是对于雌雄异株植物,雌雄间生态位的分化使种内竞争得到缓解(Zhanget al., 2009),所以种间竞争显得尤为重要。研究显示植物种间竞争比种内竞争更强烈,同种邻居对雌雄植株的生长没有影响,但异种邻居却对其有抑制作用(Pérez-Llorcaet al., 2019)。比如,Sánchez-Vilas 等(2011)认为雌雄植株的生长更多是受种间竞争的抑制。
雌雄异株是雌雄性别功能在个体水平上分离的一种性系统。在许多雌雄异株植物中都发现了性别二态性,雌树和雄树的形态、生理、生活史和防御特征等都存在性别差异,这通常与雌性和雄性功能相关的繁殖成本差异有关(Dawsonet al., 1999; Obeso, 2002;Barrettet al., 2013)。普遍认为雌树在繁殖上比雄树投入更多资源,尽管某些植物的雄树由于大量的花粉投资使其在开花期间的繁殖成本高于雌树,但雌树为满足其果实生长用于繁殖的资源最终将多于雄树(Lloydet al., 1977; Obeso, 2002; Juvanyet al., 2015)。由于雌树的繁殖成本比雄树更高,竞争对雌树生长的负向影响更大(Lloydet al., 1977)。然而,一些研究并未显示雌树的繁殖投入高于雄树(Delphet al., 2005)。雌雄异株植物成功繁殖所需要的资源不同,资源需求差异也可能使雌雄植株在受竞争影响时具有响应差异(Sánchez-Vilaset al., 2011; Tonnabelet al., 2017)。在发现雌雄植株具有竞争响应差异的研究中,雌树受到竞争更多的负面影响(Sánchez-Vilaset al., 2011)。一般来说,性别间的特异性生理差异最可能发生在繁殖阶段(Delph, 1999)。雌雄异株植物性别分离的生理构造对研究繁殖阶段的性别差异提供了理想范式。目前,雌雄异株植物在形态差异、性别比例、性别分化、生殖分配、生态适应和环境胁迫响应等方面的研究较多。然而,这些与性别相关的研究很少考虑到竞争这一生物因素。此外,大多数与雌雄异株植物竞争相关的研究都着眼于种内竞争,鲜有关于不同性别个体对种间竞争的响应研究。因此,研究雌雄异株植物对种间竞争响应的性别差异具有重要意义。
以雌雄异株植物东北鼠李(Rhamnus schneiderivar.manshurica)为研究对象,探究种间竞争对繁殖和营养生长状况的影响。拟解决以下科学问题:1)东北鼠李对种间竞争的响应是否存在性别差异,雌树是否比雄树受到竞争的更多负面影响?2)在种间竞争影响下,东北鼠李是保持繁殖还是放弃繁殖?3)随着雌树繁殖投入增加,种间竞争对雌树是否有更大的负面影响?在此基础上,检验雌雄异株植物对种间竞争响应的性别差异性,以期对理解竞争胁迫下不同性别个体的生活史策略差异提供理论依据。
1 研究区概况
研究区位于吉林省蛟河林业实验区管理局(127°35′—127°51′E, 43°51′—44°05′N), 海 拔 为459~517 m。该地区属于温带大陆性季风气候,年均气温为3.8 ℃,最热月7 月的平均气温21.7 ℃,最冷月1 月的平均气温-18.6 ℃,年均降水量700~800 mm,多集中在夏季。土壤类型为山地暗棕色森林土,土层厚度20~100 cm。属长白山系张广才岭山脉,植被类型为天然针阔混交林。林分类型属典型次生针阔混交林,是原始阔叶红松(Pinus koraiensis)林经采伐干扰后形成的近熟林。 乔木树种包括水曲柳(Fraxinus mandshurica)、色木槭(Acer mono)、胡桃楸(Juglans mandshurica)、白牛槭(Acer mandshuricum)、大果榆(Ulmus macrocarpa)、春榆(U.davidianavar.japonica)、裂叶榆(U.laciniata)、红松、紫椴(Tilia amurensis)和稠李(Padus racemosa)等。灌木树种包括簇毛槭(Acer barbinerve)和毛榛(Corylus mandshurica)等。
2 研究方法
2.1 样地设置
2009 年7 月建立1 块660 m×360 m(面积23.76 hm2)的永久性固定监测样地,为方便木本植株定位,将样地划分为594 个20 m×20 m 的样方,再将每个20 m×20 m 的样方划分为16 个5 m×5 m 的小样方,调查样地中所有胸径≥1 cm 的木本植物的胸径、树高、枝下高、冠幅,标记位置坐标并挂牌定位。分别于2014 年7 月和2019 年7 月复测样地内所有胸径≥1 cm 的木本植物。2019 年固定样地中共调查到74 种共计44 470 株木本植物,样地树种组成如表1 所示。
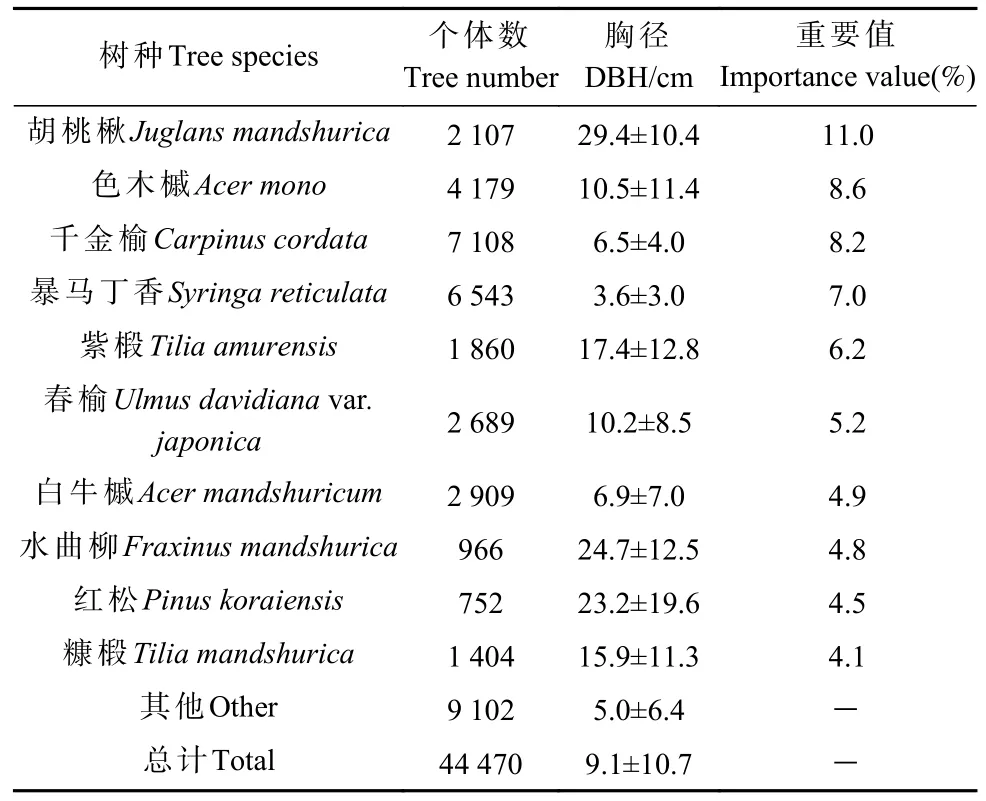
表1 样地树种组成①Tab.1 Sample site tree species composition
2.2 研究对象
研究对象东北鼠李为鼠李科(Rhamnaceae)鼠李属植物,为典型的雌雄异株植物。枝互生,小枝暗紫色或黄褐色,幼枝绿色。叶互生或簇生在短枝上,呈椭圆形或圆形,纸质或近膜质;上面绿色,被白色糙伏毛,下面浅绿色,无毛。花4 基数,有花瓣,黄绿色;单性花,雌花花柱2 浅裂。核果黑色,无毛,倒卵状球形或圆球形。花期5—6 月,果期7—10 月。主要分布于吉林、辽宁、河北、山西、山东等地,多生于阳向山坡或灌丛中。有较高的园林价值和经济价值,其含油脂和蛋白质的种子可用于榨油,制作润滑油、油墨和肥皂等,是我国重要的造林树种(中国科学院中国植物志编辑委员会, 2004)。
2.3 调查取样方法
2009—2019 年通过繁殖状况持续观测东北鼠李的性别。2019 年花期(5 月末)和果期(8 月初)在样地内随机选取一定数量的东北鼠李雌雄植株进行调查,以比较他们在不同生殖阶段(花期和果期)对种间竞争的响应差异。为进一步比较年际间的结实差异,在2020 年果期(8 月初)进行调查,以横向对比2 年果期之间对种间竞争的响应差异,为减少其他因素影响,2年果期调查时间一致。在各生殖阶段调查时均测定植株胸径,同时统计植株上的花(果)、叶的数量和新生枝长度,并采集对应的花(果)、叶和枝样品以计算各组分生物量。
2.4 生物量组分测定
在样地中选择生长良好的东北鼠李雌雄植株,每株标记5~10 个能代表植株平均状况的枝条,在花期和果期统计枝条上的花、果、叶的数量、新生枝长度和总的枝条数量,计算得到植株的花、果、叶总数和总新生枝长度。采集对应的花、果、叶和新生枝样品,在70 ℃的烘箱中烘干至恒质量后,用万分位天平称其质量,得到单花、单果、单叶生物量和单位长度的新生枝生物量。与植株的花、果、叶总数和总新生枝长度相乘得到植株的花、果、叶生物量和新生枝生物量,当年的新生枝生物量与叶生物量合计得到营养生物量,花、果数和花、果生物量代表繁殖投入的程度。
2.5 数据分析
竞争指数包括两大类,其一是与距离无关的竞争指数,另一个是与距离相关的竞争指数(Bella, 1971;Hegyi, 1974; Martinet al., 1984)。利用Hegyi 指数计算种间竞争强度,公式如下(Hegyi, 1974):
式中:CIi为目标个体的竞争指数,该值越大,竞争强度越大;Dj为异种竞争个体的胸径(cm);Di为目标个体的胸径(cm);Lij为目标个体和竞争个体之间的距离(m);n为竞争个体的数量。根据样地中林木的坐标位置,即可计算出目标个体和竞争个体之间的距离。通过固定样圆法,以目标个体为圆心、半径为5 m 的圆内除东北鼠李外的其他树木作为竞争个体(邹春静等,2001;段光爽等,2020),计算每个竞争个体对目标个体的竞争指数。再将n个竞争个体对目标个体的竞争指数累加,其和为该目标个体受到的种间竞争强度。
采用线性回归方法对竞争强度与胸径及各生物量组分的关系进行分析,利用方差分析检验2019 年果期和2020 年果期雌树繁殖投入之间的差异。数据分析及作图采用R 软件完成。
3 结果与分析
3.1 2019—2020 年东北鼠李调查情况
于2019 年花期(5 月末)、果期(8 月初)和2020年果期(8 月初)测定样地内选取的东北鼠李雌雄植株的胸径,不同生殖阶段的调查株数和存活树木的平均胸径数值如表2 所示。其中,2019 年花期共有植株54 株,由于部分东北鼠李濒死或死亡使调查样本量减少,2019 年果期和2020 年果期分别剩余植株43 和41 株。

表2 2019—2020 年的东北鼠李调查情况Tab.2 Survey of Rhamnus schneideri var.manshurica in 2019—2020
3.2 种间竞争对繁殖投入的影响
种间竞争对雌雄个体的繁殖过程影响不大(图1)。无论是在花期还是在果期,雌树的花、果数和花、果生物量都与竞争强度没有显著相关性;雄树的花数和花生物量随着竞争强度增大而增加,但没有显著的相关关系(P>0.05)。
3.3 种间竞争对营养生长的影响
不同性别个体的胸径大小对种间竞争的响应不同。雌树胸径大小与竞争强度呈显著负相关(P<0.05),而雄树胸径大小与竞争强度没有显著相关性(P>0.05),这反映了雌树胸径大小受到种间竞争的显著抑制,而雄树胸径大小受种间竞争的影响不显著(图2)。3 个生殖阶段调查的雌雄植株胸径与种间竞争强度均显示同样的相关关系,因此只对其中一个生殖阶段作出展示。
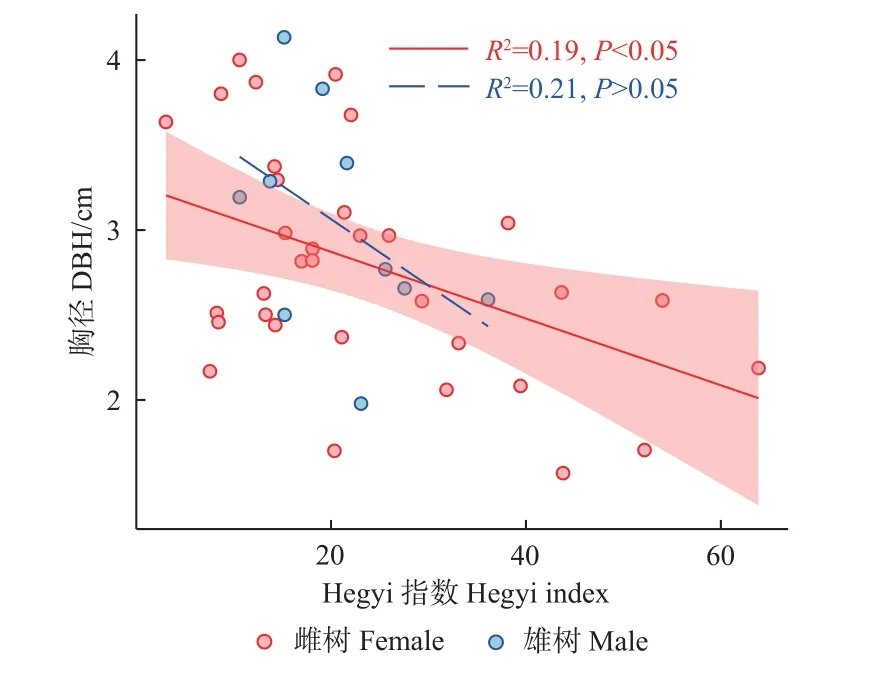
图2 2019 年种间竞争强度与果期胸径之间的关系Fig.2 The relationship between the intensity of interspecific competition and DBH at fruit period in 2019
在花期,雌树的新生枝和叶生物量与竞争强度呈显著负相关(P<0.05),而雄树与竞争强度不显著相关(P>0.05)。在果期,雌雄植株的新生枝生物量及叶生物量与竞争强度均不存在显著相关(P>0.05)。因此,雌树的枝叶生长在2019 年花期时受种间竞争显著抑制,在2019 年果期时受种间竞争影响不显著;雄树的枝叶生长在花期和果期均不受种间竞争显著抑制(图3)。
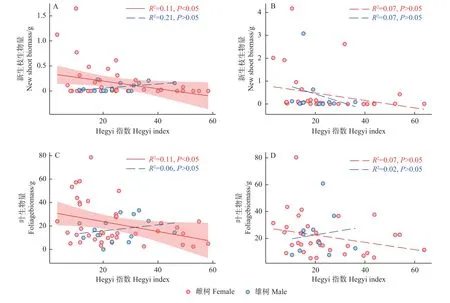
图3 种间竞争强度与新生枝生物量、叶生物量之间的关系Fig.3 The relationship between the intensity of interspecific competition and the biomass of new shoots and foliage
3.4 营养生长对种间竞争响应的年际差异
为对比东北鼠李雌树果期繁殖投入的年际差异,统计2019 年、2020 年果期的果数和果生物量(表3)。方差分析结果显示,雌树在2 年间的果数和果生物量存在显著差异,2020 年的果数和果生物量显著大于2019 年(P<0.05)。这反映了雌树连续2 年果期投入到繁殖中的资源量存在差异,即2020 年果期投入繁殖的资源量显著高于2019 年。
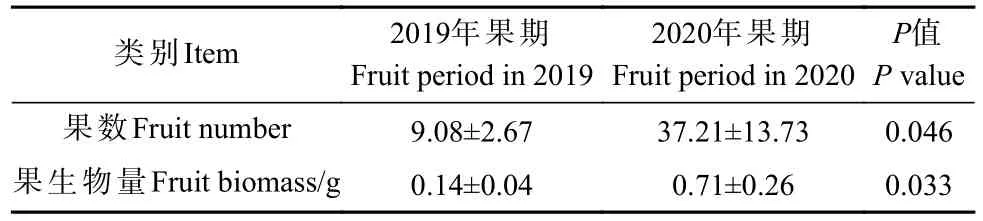
表3 雌树果数和果生物量的年际差异①Tab.3 Interannual differences in fruit number and fruit biomass of female trees
2019 年果期,雌雄植株的营养生物量与竞争强度均相关不显著(P>0.05)。2020 年果期,雄树的营养生物量与竞争强度相关不显著(P>0.05),而雌树的营养生物量与竞争强度显著负相关(P<0.05) (图4)。因此,雄树的营养生物量均不受种间竞争的显著影响,而雌树的营养生物量在2020 年果期受到种间竞争的显著抑制。这种营养生长对竞争响应的年际差异是由果期繁殖投入变化引起的(表3)。
4 讨论
4.1 种间竞争对繁殖投入的影响
竞争会改变植物的生殖分配过程(Waiteet al.,1982)。在激烈的竞争环境中,植物将较少的生物量分配给繁殖器官,而将更多生物量分配给茎和叶等器官(Weiner, 2004)。例如,竞争对雌性山靛的繁殖具有显著影响(Hesseet al., 2011)。有研究表明,竞争同时降低了植物的营养生长和繁殖投入(Vargaet al.,2012)。本研究发现不管是雌树还是雄树,东北鼠李的花、果数和花、果生物量都不受竞争影响。这反映了无论受到的来自相邻异种的竞争压力有多强烈,东北鼠李的繁殖均未受任何影响。该结果支持了不惜一切代价的繁殖假说,即在种间竞争的压力下,雌雄植株采取的均是保持繁殖对策。这与Pérez-Llorca 等(2019)的研究结果相似,他们发现在地下激烈竞争和地上快速生长的情况下,雌树可能会在当前生长中投入更多资源来维持繁殖,而不是分配给营养生长。Shetti 等(2018)也发现刺柏(Juniperus communis)雌树在恶劣环境中为了保障结实而在繁殖中投入大量资源。繁殖是植物生活史中的重要过程,一些雌雄异株植物会优先对繁殖进行投资。与雌雄同株植物相比,雌雄异株植物由于雄树存在而造成的种子(果实)损失,会通过雌树保持或增加繁殖来进行补偿(Bruijninget al., 2017)。
大量研究显示雌雄异株植物具有明显的性别差异。比如Hesse 等(2011)研究发现只有雌性植株的繁殖受到竞争影响,而雄性植株不受竞争影响。然而本研究显示东北鼠李雌雄植株间的繁殖对竞争的响应并未出现两性差异。这与前人的一些研究结果相似(Wardet al., 2002; Uenoet al., 2003)。上述分歧并不让人意外,雌雄异株植物表现出的性别差异往往具有高度的物种特异性,某些物种中雌树比雄树的承压能力更大,而在其他物种中则相反(Juvanyet al., 2015)。这可能与每个物种不同的生活史对策和特定的生存环境有关。环境和竞争同时作用于植物,雌雄植株是否出现性别差异往往受环境影响。有研究显示雌树生长速度在有利环境下比雄树快,而在不利环境下没有性别差异(Dawsonet al., 1993)。本文中雌雄植株的繁殖对种间竞争的响应没有差异,可能是因为雌树能从优越环境中吸取到足够资源用于繁殖,使得其繁殖受影响较小。有研究支持了这一观点,雌树相较于雄树在较好生境中占据优势,其可从环境中获得足够多的资源用于结果,所以在竞争影响下并未显示出性别差异(Rozaset al., 2019)。然而,环境因素并不是影响性别二态性的主要因素,因为雌雄植株的资源需求以及资源分配方式存在不同。如Nowak 等(2021)研究显示,由于雌雄植株投资策略不同,不利环境并不能使两性差异更显著。Hesse 等(2011)的研究同样表明,两性植株生物量的差异不受土壤养分有效性的影响,因为植物会根据环境变化改变自身资源分配。
4.2 种间竞争对营养生长的影响
植物的生存、生长和繁殖都受竞争影响(Belsky,1992)。以往研究显示在面对干旱、食草动物胁迫时,雌树受到的影响通常比雄树更严重(Zhanget al., 2019)。本研究显示种间竞争会对东北鼠李的胸径大小产生一定影响。然而只有雌树的胸径大小受到种间竞争的显著抑制,雄树的胸径大小没有受到种间竞争显著影响。这可能是因为雌树往往比雄树更脆弱,在生长过程中受到种间竞争带来的负面影响更大。
生物量是植物积累能量的主要表现,生物量的增加在一定程度上反映了植物对外部资源的捕获(Yanget al., 2019)。本文的研究对象东北鼠李老枝和树干虽然每年也有增粗现象发生,但增粗量并不明显,因此本研究只关注营养生物量增长较为显著的新生幼枝和叶生物量,探讨邻体竞争对营养生长的影响。有研究发现竞争显著减少了不同性别植物的生物量积累(Harriset al., 2021)。本研究也得到类似结果,2019 年花期雌树的新生枝和叶生物量受到竞争的显著抑制,2020 年果期竞争强度对雌树的营养生物量也有显著影响。除此之外,本研究也发现了显著的两性差异,即只有雌树会受到竞争显著影响,雄树新生枝、叶和营养生物量无论在哪个生殖阶段都未受到竞争的显著抑制。一些学者的研究同样表明种间竞争对雌树营养生物量的影响大于对雄树的影响(Graffet al.,2013)。Cranston 等(2012)指出,雌树比雄树更容易受到来自邻居的负面影响。Hesse 等(2011)也发现竞争只对雌树的生殖分配有影响,而对雄树没有影响。出现两性差异的原因可能是雌雄植株的资源需求有差异,雄树往往比雌树投入更多的氮元素用于产生大量花粉,而雌树产生果实需要大量的碳元素,这种性别特异性资源需求可能是雌雄植株的竞争响应差异的原因。前人研究同样表明,由于雌树和雄树成功繁殖所需要的资源不同,它们在受竞争影响时表现也不同,在竞争的影响下显示出性别二态性(Sánchez-Vilaset al., 2011; Yuet al., 2022)。此外,同一性别在不同的生殖阶段对种间竞争的响应也具有差异,雌树的新生枝和叶生物量在2019 年花期受种间竞争显著抑制,在2019 年果期却受竞争影响并不显著。这可能是因为雌树在果期增加了自身对有限资源的吸收。有研究表明,不同生殖阶段植物获取资源的能力是动态变化的,在需要大量资源的生殖阶段,雌树往往会进化出某种补偿机制以提高自身获取资源的能力(王俪玢等,2020)。
植物将获取的有限资源用于不同的生命过程(Cody, 1966),在一个过程中增加投资,相应地就会对另一个过程产生负面影响(Bogdanowiczet al., 2011)。雌树较高的繁殖努力往往与其较低的生长率、较保守的用水以及受到胁迫时更高的负向影响有关(Dudley,2006; Zunzuneguiet al., 2006; Xuet al., 2008; Rozaset al., 2009)。前人研究显示,当繁殖努力更高时,植物对营养生长的投入将减少(Millaet al., 2006)。Nowak等(2021)的研究也显示繁殖成本降低会使得雌树拥有更高的营养生长速率。本研究发现在果期这个关键阶段,2020 年雌树的繁殖投入显著高于2019 年;而2020 年繁殖投入增加,使雌树的营养生长受到种间竞争更多抑制。表明当雌树繁殖投入增加时,竞争对雌树的负面影响增大。这可能是因为2019 年果期雌树的繁殖投入较少,雌树获取到的资源可以满足自身生长和繁殖;而2020 年果期繁殖投入增加,雌树为满足果实生长,使营养生物量受到种间竞争显著抑制。繁殖投入较少时的雌树生长受到负面影响相对较小,即在繁殖方面投入相对较少时在生长方面具有竞争优势(Lloydet al., 1977)。由于繁殖对植物来说代价高昂,往往无法兼顾自身的繁殖和生长(Bergeret al.,2017)。雌树较高的繁殖成本可能不利于自身营养生长,故而其在生长方面更易受外界环境的影响(Dawsonet al., 1999; Delph, 1999; Liuet al., 2021)。然而,出现这种年际差异也可能与气候等环境因子有关,同时也需要结合植物关于营养生长和繁殖的权衡综合考虑。在未来研究中,还需进行长期监测,才能明确繁殖投入变化是如何影响竞争对营养生长的影响作用大小。
5 结论
本试验验证了东北鼠李雌雄异株个体的性别二态性,虽然繁殖对种间竞争的响应没有性别差异,但营养生长对种间竞争的响应具有显著的性别差异;雌树的胸径大小、新生枝和叶生物量均会受到种间竞争的显著抑制,而雄树则不受种间竞争显著抑制。面对种间竞争胁迫时,雌雄植株均采取了保持繁殖的策略,无论花期还是果期,雌雄植株的繁殖均不受种间竞争影响。此外,年际间的对比发现雌树增加果期繁殖投入时,其营养生长会受到更强的种间竞争抑制作用。研究发现不同性别个体对种间竞争的响应具有性别差异。

