苹果树木质部及韧皮部组织基因组DNA的提取及质量检测
刘钰娇+杨金凤+赵璐+王亚南+胡同乐+王树桐+曹克强

摘要:苹果树木质部及韧皮部中含有大量的酚类、多糖等次生代谢物质,严重影响基因组DNA提取的得率和纯度。采用3种不同方法,即改良的CTAB法、快速盐提法、试剂盒法,从苹果树木质部及韧皮部提取基因组DNA,并通过琼脂糖凝胶电泳和紫外分光光度法检测所提取基因组DNA的质量。结果表明,改良的CTAB法提取的组织基因组DNA不论是浓度、质量还是随机引物PCR扩增效果均能够满足进一步分子试验需要,而改进的快速盐提法和试剂盒法提取得率太低,不能用于分子生物学研究。因此改良的CTAB法是适合苹果树木质部及韧皮部组织基因组DNA提取的最佳方法。
关键词:苹果;韧皮部;木质部;基因组DNA;提取
中图分类号: S436.611 文献标志码: A
文章编号:1002-1302(2015)04-0036-03
收稿日期:2014-06-25
基金项目:公益性行业(农业)科技专项(编号:201203034、200903004);国家苹果现代产业技术体系项目(编号:CARS-28)。
作者简介:刘钰娇(1988—),女,河北无极人,硕士研究生,主要从事植物病害流行与综合防治研究。Tel:(0312)7520192;E-mail:liuyujiaolong@126.com。
通信作者:王亚南,女,博士,副教授,主要从事分子植物病理学研究。Tel:(0312)7528157;E-mail:wyn3215347@163.com。
苹果属于蔷薇科(Rosacea)仁果亚科(Pomoidea)苹果属(Malus Mill.)植物,在我国有悠久的栽培历史。最新的统计数据显示,2012年,我国苹果栽培面积达到206万hm2,产量3 700万t,我国已经成为世界上最大的苹果生产国[1]。我国苹果上的枝干病害如苹果树腐烂病、轮纹病等严重影响苹果树的生长及产量,从分子水平研究枝干病害对病害的正确诊断、病菌的分布以及有效防治策略的制定有十分重要的意义。植物DNA的提取方法在很多文献中都有大量报道[2-5],而苹果树木质部及韧皮部中含有大量的酚类、多糖等次生代谢物质,严重影响基因组DNA提取的得率和纯度。本试验对改良的CTAB法、快速盐提法、试剂盒法这3种提取总DNA的方法进行比较分析,试图确立适于苹果树木质部及韧皮部基因组DNA提取的最佳方法,以便于进行枝干病害的分子生物学研究。
1 材料与方法
1.1 试验材料
苹果木质部及韧皮部材料采自河北农业大学植物病害流行与综合防治试验园,分别取富士苹果树的主干、1年生枝条、2年生枝条和3年生枝条的木质部及韧皮部,放入保鲜袋中并尽快带回实验室,放于-80 ℃超低温冰箱中保存,备用。
1.2 方法
1.2.1 改良的CTAB法[6] 将样品加入适量的石英砂,加液氮研磨,取适量植物组织粉状装入2 mL无菌的离心管中备用。向离心管中加入65 ℃预热的2% CTAB 抽提缓冲液[14 mol/L NaCl,1 mol/L Tris-HCL(pH值8.0),20 mmol/L EDTA,2% CTAB,2% PVPP,2%β-巯基乙醇]650 μL,涡旋混匀,65 ℃水浴1 h,每隔10 min轻轻颠倒离心管1次,使研磨后的粉末和抽提缓冲液充分混匀。向离心管中加入 650 μL 的酚-氯仿-异戊醇(体积比25 ∶ 24 ∶ 1),涡旋混匀,并于4 ℃、12 000 r/min离心15 min。将上清液转移至一个新的离心管中,向其中加入等体积的氯仿混均匀,于4 ℃、12 000 r/min 离心10 min。吸取上清液转移至另一新的离心管中,向其中加入60 μL的3 mol/L NaAc,和200 μL异丙醇,混合均匀,-20 ℃放置1 h,12 000 r/min离心10 min,倒出上清液。用300 μL冷冻保存70%乙醇清洗沉淀2次,无水乙醇冲洗1次,最后于室温条件下干燥,向离心管中加入 100 μL TE(pH值8.0),4 ℃放置过夜待DNA完全溶解,于 -20 ℃ 保存备用。
1.2.2 改进的快速盐提法[7] 在样品中加入适量的石英砂,加液氮研磨,取适量粉状植物组织装入2 mL无菌的离心管中备用。每管加入提取缓冲液(1.0 mol/L NaCl,100 mmol/L Tris-HCl,pH值8.0),50 mmol/L EDTA(pH值8.0)400 μL,用塑料棒旋转碾碎后加40 μL 20%SDS,振荡混匀30 s。将样品放于65 ℃水中温育2 h,向每管加入300 μL 6 mol/L NaCl,振荡混匀30 s。12 000 r/min离心10 min,将上清转入干净的离心管中,加入等体积预冷的异丙醇,轻柔混匀后-20 ℃冰箱放置1 h。12 000 r/min离心10 min,小心将上清液倒出,分别用70%乙醇和纯乙醇各洗1次后,晾干。将DNA样品溶解于100 μL灭菌的蒸馏水中,-20 ℃保存,备用。
1.2.3 试剂盒法 采用植物组织基因组DNA提取试剂盒(Easy Pure Plant Genomic DNA Kit,北京全式金生物公司)进行木质部和韧皮部组织基因组DNA的提取,严格按照试剂盒说明书上提供的方法进行操作,最后提取的基因组DNA于-20 ℃ 保存,备用。
1.3 DNA的质量检测
1.3.1 DNA浓度的测定和纯度检测 采用K5500超微量紫外分光光度计进行浓度测定及纯度检测。DNA样品的浓度一般可根据其在260 nm的吸光度来确定,纯度检测通过D260 nm/D280 nm来确定。
1.3.2 DNA质量的琼脂糖凝胶电泳检测 分别取5 μL DNA样品和1 μL的6×Loading buffer,混匀后经1.2%琼脂糖凝胶电泳检测,检测使用Marker为宝生物工程(大连)有限公司的DL2000 DNA Marker,电泳电压为110 V,时间为 40 min。电泳结束后进行溴化乙锭(EB)染色,最后经 SYNGENE 凝胶成像仪观察照相。
1.3.3 随机引物PCR扩增 随机引物扩增反应使用30 μL反应体系(2×EsTaq MasterMix 15 μL,引物1 μL,DNA模板 1 μL,ddH2O 13 μL)。其中,随机引物为上海生工生物工程技术服务有限公司2 000多条引物中随机挑选的1条。扩增程序:94 ℃预变性5 min;94 ℃变性30 s,35 ℃退火30 s,72 ℃延伸90 s,共40个循环;最后72 ℃延伸10 min,4 ℃保存。
2 结果与分析
2.1 DNA浓度的测定和纯度检测
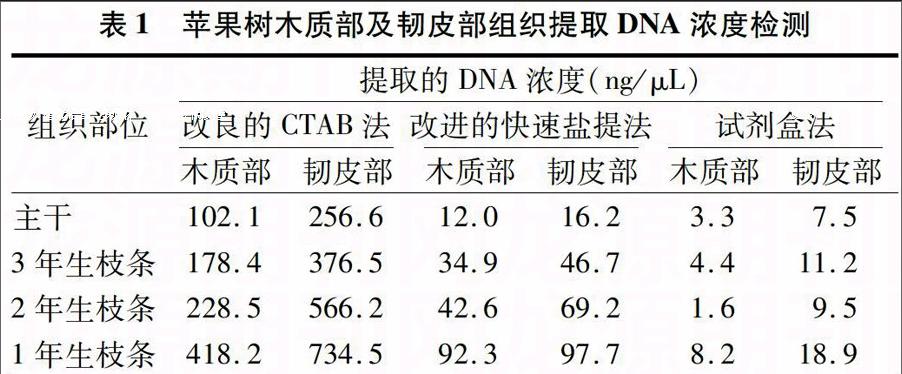
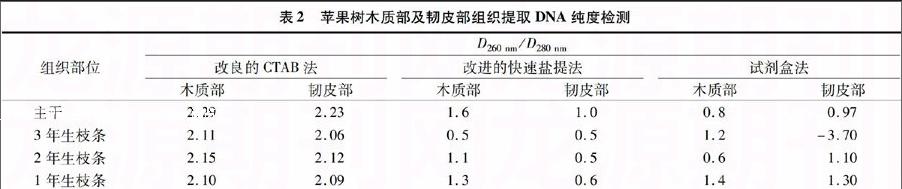
由表1可以看出,改良的CTAB法提取DNA的浓度基本能满足PCR要求,而改进的快速盐提法和试剂盒法提取效果很差,提取DNA得率太低或无法提出,因而无法进行后续的分子生物学试验。从表2可以看出,改良的CTAB法提取DNA的D260 nm/D280 nm为2.06~2.29,这表明DNA受损程度不高且比较纯,蛋白质、酚类及多糖等杂质去除效果较好,但 D260 nm/D280 nm 大于1.9,表明可能有RNA,要求严格的分子生物学试验可以加一步去除RNA的操作。改进的快速盐提法和试剂盒法提取DNA的D260 nm/D280 nm均小于1.6,甚至有的为负数,这表明蛋白质或酚类污染严重,或是未提出DNA。综上,改良的CTAB法是适合苹果树木质部及韧皮部组织基因组DNA提取的最佳方法。
表1 苹果树木质部及韧皮部组织提取DNA浓度检测
组织部位
提取的DNA浓度(ng/μL)
改良的CTAB法 改进的快速盐提法 试剂盒法
木质部 韧皮部 木质部 韧皮部 木质部 韧皮部
主干 102.1 256.6 12.0 16.2 3.3 7.5
3年生枝条 178.4 376.5 34.9 46.7 4.4 11.2
2年生枝条 228.5 566.2 42.6 69.2 1.6 9.5
1年生枝条 418.2 734.5 92.3 97.7 8.2 18.9
表2 苹果树木质部及韧皮部组织提取DNA纯度检测
组织部位
D260 nm/D280 nm
改良的CTAB法 改进的快速盐提法 试剂盒法
木质部 韧皮部 木质部 韧皮部 木质部 韧皮部
主干 2.29 2.23 1.6 1.0 0.8 0.97
3年生枝条 2.11 2.06 0.5 0.5 1.2 -3.70
2年生枝条 2.15 2.12 1.1 0.5 0.6 1.10
1年生枝条 2.10 2.09 1.3 0.6 1.4 1.30
2.2 DNA质量的琼脂糖凝胶电泳检测
从图1可以看出,用改良的CTAB法提取的组织基因组DNA可以看到均有大于2 000 bp的条带,但条带亮度均比Marker要暗,说明所提基因组DNA浓度均偏低,从条带亮度也大致可以看出主干的木质部以及韧皮部的基因组DNA提取质量低于枝条组织;而改进的快速盐提法以及试剂盒法提取的基因组DNA均未有明显条带,有的泳道可以隐约看到条带,说明提取质量太差或未成功提取到。
2.3 随机引物PCR扩增
从图2可以看出,用改良的CTAB法提取的苹果树木质部及韧皮部组织基因组DNA进行随机引物的PCR反应获得了清晰稳定的条带,进行重复试验,均获得了较好的扩增,表明该方法提取的基因组DNA适合进一步的分子分析。从图3可以看出,改进的快速盐提法提取的组织基因组DNA进行随机引物的PCR反应,部分组织也获得了条带,但条带模糊且重复性不好,因而不太适合进一步的分子分析。从图4可以看出,试剂盒法提取的组织基因组DNA进行的随机引物PCR反应均未获得任何条带,表明此方法可能未提取到DNA。
3 讨论
高质量DNA要求尽量保持核酸分子完整性、高分子量,无明显降解现象;还要求纯度高,尽量去除酚类等严重干扰酶作用的杂质;此外要求获取效率高,能够达到试验要求的浓度[8]。苹果树木质部及韧皮部中含有大量的酚类、多糖等次生代谢物质,严重影响基因组DNA提取的得率和纯度。CTAB提取液中加入的PVPP具有酰胺键,可吸附多酚分子上的氢氧基从而形成氢键,可以吸附多酚,其中加入的β-巯基乙醇是一种还原剂,可防止细胞内物质发生褐变,因此,本试验采用的改良的CTAB法获得了较好的提取效果,此外泳道下边无拖尾,无小片段产物,说明未有RNA污染,这可能是因为提取完DNA后未及时进行电泳检测,RNA可能已经降解。改进的盐提法中加入的1.0 mol/L NaCl在减少DNA降解的同时可以清除严重降解的DNA[9];EDTA可以螯合金属离子,酶不能与金属离子结合,否则就失去了活性,核酸酶类也是如此,所以EDTA可避免提取DNA时核酸酶类污染造成DNA的降解。但该方法依旧未获得高质量的DNA,虽避免了使用酚/氯仿抽提,减少了酚/氯仿对试验人员的伤害,但提取效果不佳,不建议使用该方法进行苹果树木质部及韧皮部的基因组DNA提取。试剂盒法为公司开发的便捷型产品,对一般植物组织可能通用性较强,但是对于苹果树的木质部和韧皮部针对性太差,无法提取到高质量的基因组DNA。
杨英军等采用CTAB法和SDS法从落叶果树韧皮部提取DNA,认为SDS法总体上优于CTAB法[10],但王富荣等[11]以及王飞等[12]分别采用CTAB法提取桃韧皮部DNA和果梅休眠枝韧皮部DNA均获得了良好的提取效果,这可能是因为不同的果树组织中的代谢产物有差别。本试验采用3种不同的提取方法进行比较,最终确定改良的CTAB法是较适合苹果树木质部及韧皮部组织基因组DNA提取的方法,但是该方法所采用的试剂如β-巯基乙醇、酚/氯仿等均对人体有轻微伤害,因此在提取DNA过程中,一定要注意佩戴口罩和手套,尽量减小对试验人员的伤害。
参考文献:
[1]Faostat. The agricultural production indices[EB/OL]. [2014-06-08]. http://faostat3.fao.org/faostat-gateway/go/to/download/Q/QC/E.
[2]卢扬江,郑康乐. 提取水稻DNA的一种简易方法[J]. 中国水稻科学,1992,6(1):47-48.
[3]汤文开,谭 新,张 辉,等. 一种快速简单高效提取植物DNA的方法[J]. 华中师范大学学报:自然科学版,2007,41(3):447-449.
[4]张 磊,任 贤. 枸杞基因组DNA的提取及RAPD反应体系的优化[J]. 安徽农业科学,2009,37(30):14611-14613,14634.
[5]邹喻苹,汪小全,雷一丁,等. 几种濒危植物及其近缘类群总DNA的提取与鉴定[J]. 植物学报,1994,36(7):528-533,578.
[6]Zang R,Yin Z Y,Ke X W,et al. A nested PCR assay for detecting Valsa mali var. mali in different tissues of apple trees[J]. Plant Disease,2012,96(11):1645-1652.
[7]Aljanabi S M,Martinez I. Universal and rapid salt-extraction of high alitygenomic DNA for PCR-based techniques[J]. Nucleic Acids Research,1997,25(22):4692-4693.
[8]李登科,黄丛林,田建保,等. 高质量枣树基因组DNA提取方法的研究[J]. 分子植物育种,2005,3(4):579-583.
[9]彭玉华,王晓琳. 以PCR为目的的大豆叶片DNA快速分离方法[J]. 中国油料,1996,18(4):34-36.
[10]杨英军,耿 森,李爱江. 从落叶果树韧皮部提取DNA[J]. 分子植物育种,2006,4(增刊2):142-146.
[11]王富荣,何华平,赵剑波,等. 适于AFLP分析用的桃韧皮部DNA提取方法[J]. 安徽农业科学,2011,39(16):9503-9504,9521.
[12]王 飞,沈玉英,佟兆国,等. 一种果梅休眠枝韧皮部DNA提取方法[J]. 上海农业学报,2011,27(1):55-59.

