视黄酸相关孤儿受体α对阿霉素诱导心肌损伤的改善作用及机制研究
付 莉,黄 晶,苗 娜,王志强
(1.新疆医科大学第一附属医院病理科,新疆 乌鲁木齐 830054;2.新疆医科大学第二附属医院,新疆 乌鲁木齐 830054)
心脏损伤在临床上比较常见,多指心肌损害后继发的心脏大小、结构、形状的任何改变,病理特征表现为病理性心肌细胞肥大、心肌细胞外基质过度沉积[1-4]。阿霉素(Doxorubicin,DOX)属于蒽环类药物,是白血病、淋巴瘤、乳腺癌、肺癌、卵巢癌等多种疾病的有效化疗药物,但是长期服用DOX可导致严重的副作用,尤其是心脏毒性最为明显[5-6]。主要表现为心肌活性氧簇(Reactive oxygen species,ROS)增加,心肌细胞凋亡,心肌能量代谢受损,线粒体功能障碍[7-8],但机制并不清楚。视黄酸相关孤儿受体(Retinoic acid receptor-related orphan receptor,ROR)是一种核受体,包括RORα、RORβ和RORγ[9]。RORα不仅是调节生物节律的重要分子,而且在胚胎发育和生物代谢中也发挥重要作用[10-14]。RORα表达于心肌组织,并且参与心肌细胞的凋亡、自噬、氧化应激和炎症反应等生理病理过程[15],但是其在DOX诱导的心肌损伤研究并未报道。因此,本研究通过建立心脏RORα过表达模型,探讨RORα在DOX诱导的心肌损伤中的改善作用及机制。
1 材料与方法
1.1 实验动物 雄性C57/BL6J小鼠80只,6~8周龄,18~22 g,购于新疆医科大学基础医学院。所有小鼠均在相同的温度和湿度下喂养,环境温度保持在(24±3)℃,湿度保持在33%~68%,小鼠可自由饮食。
1.2 主要试剂 慢病毒(LV-GFP)和RORα过表达慢病毒(LV-RORα)购于汉恒生物技术公司;DOX(批号:H33021980)购于上海翊圣生物公司;兔抗MnSOD(批号:R910708)和RORα(批号:R910708)抗体购于美国CST公司;DAPI染色液(批号:D796852)购于上海翊圣生物公司;辣根过氧化物酶(HPR)标记二抗(批号:7074)购于天津三箭生物公司;TUNEL试剂盒购于美国罗氏公司;血浆肌酸激酶(CK)(批号:C0023)、乳酸脱氢酶(LDH)检测试剂盒(批号:C0016)和ROS检测试剂盒(批号:CA1410)购于上海碧云天生物公司。
1.3 实验方法
1.3.1 小鼠心肌RORα过表达模型建立和实验分组:将NC慢病毒和RORα过表达慢病毒2×107TU采用尾静脉注射的方法注射到小鼠体内。2周后检测心肌RORα表达,心肌RORα高表达为模型建立成功。随机将小鼠分为NC组、RORα过表达组、DOX组和RORα过表达+DOX组,每组20只。其中,DOX组和RORα过表达组一次性给予15 mg/(kg·d)DOX腹腔注射;NC组和RORα过表达组给予同等体积0.9%氯化钠溶液腹腔注射。
1.3.2 小鼠心功能检测:将小鼠平躺于实验台上,异氟烷吸入麻醉,根据小鼠体重计算麻醉深度。取少量螯合剂涂于小鼠胸前,超声探头对着小鼠心前区采集M型超声图像并保存。分析M型超声图像结果,评估心功能,计算小鼠左心室射血分数(LVEF)和左心室短轴缩短率(LVFS)。
1.3.3 血浆心肌酶CK和LDH活性检测:各组小鼠颈静脉取血,血液置于EP管中,800 r/min离心。后续步骤按照CK和LDH试剂盒的要求进行,记录相关数据。
1.3.4 心肌凋亡水平检测:常规处死小鼠,迅速取出小鼠心脏,在预冷的PBS中将小鼠心脏血液洗掉,吸水纸吸干心脏上的PBS。将心脏置于4%多聚甲醛中固定,常规石蜡包埋切片,脱蜡入水。使用Triton-X100进行破膜后用PBS清洗,利用TUNEL染色剂和DAPI常规进行染色,最后封片。荧光显微镜下随机选取10个视野观察,计算凋亡率。
1.3.5 线粒体形态观察:常规处死小鼠,迅速取出小鼠心脏,在预冷的PBS中将小鼠心脏血液洗掉,吸水纸吸干心脏上的PBS。将左室心肌切成1 mm×1 mm×1 mm的小块,置于2.5%磷酸缓冲液配制的固定液中固定。梯度脱水后,常规包埋和固化,切片,3%醋酸铀和柠檬酸铅双染。透射电镜下进行观察,采集图片并保存。
1.3.6 心肌ROS蛋白表达检测:使用比色法检测心肌ROS含量。裂解心肌后提取蛋白,采用ROS检测试剂盒进行检测。
1.3.7 RORα和MnSOD蛋白表达检测:迅速分离小鼠心脏,将心脏血液用预冷的PBS洗掉,RIPA裂解液裂解心肌组织,提取组织蛋白。使用BCA法定量蛋白。加入相应体积的5×上样缓冲液,煮5 min。配胶,上样,电泳,转膜,牛奶封闭,孵育兔抗RORα一抗(1∶800)和兔抗MnSOD一抗(1∶800)过夜。次日孵育相应二抗(1∶50000)和ECL显影,保存并分析图片。
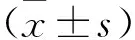
2 结 果
2.1 各组小鼠心肌RORα蛋白表达比较 见图1。与NC组比较,DOX组RORα蛋白表达水平降低,RORα过表达组和RORα过表达+DOX组RORα蛋白表达升高(均P<0.05)。
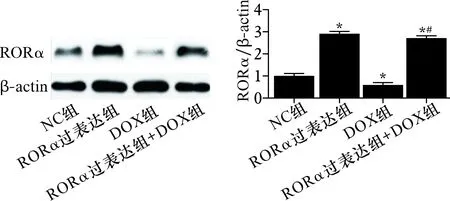
注:左图为各组小鼠心肌RORα蛋白电泳结果。右图中,与NC组比较,*P<0.05;与DOX组比较,#P<0.05
2.2 各组小鼠LVEF和LVFS比较 见图2。与NC组比较,DOX组LVEF和LVFS降低(均P<0.05)。与DOX组比较,RORα过表达+DOX组LVFS和LVEF升高(均P<0.05)。NC组和RORα过表达组LVFS和LVEF比较差异统计学意义(均P>0.05)。
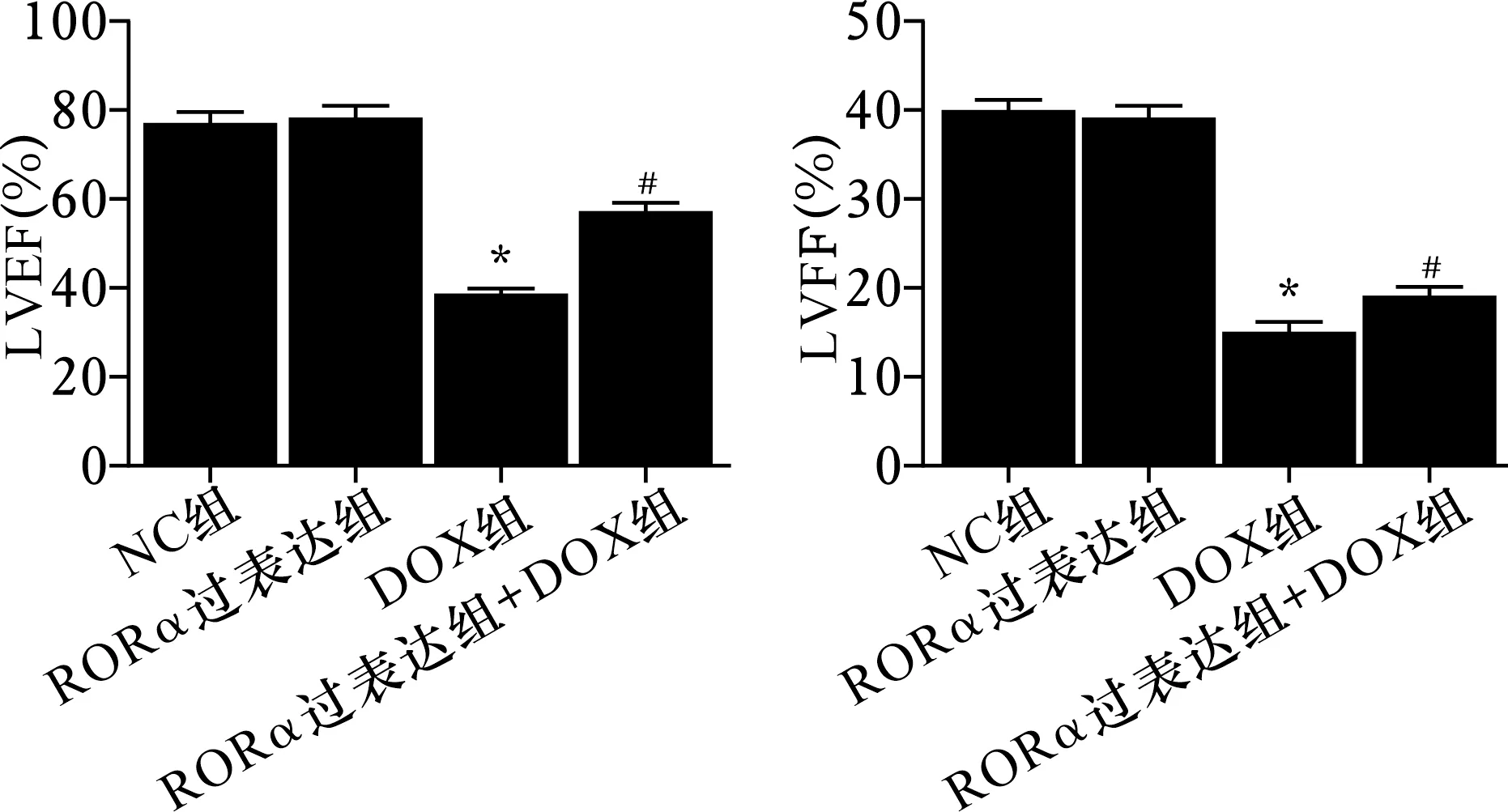
注:与NC组比较,*P<0.05;与DOX组比较,#P<0.05
2.3 各组小鼠血浆CK和LDH活性比较 见图3。与NC组比较,DOX组CK、LDH活性增加(均P<0.05)。与DOX组比较,RORα过表达+DOX组CK、LDH活性降低(均P<0.05)。NC组和RORα过表达组CK、LDH活性比较差异统计学意义(均P>0.05)。
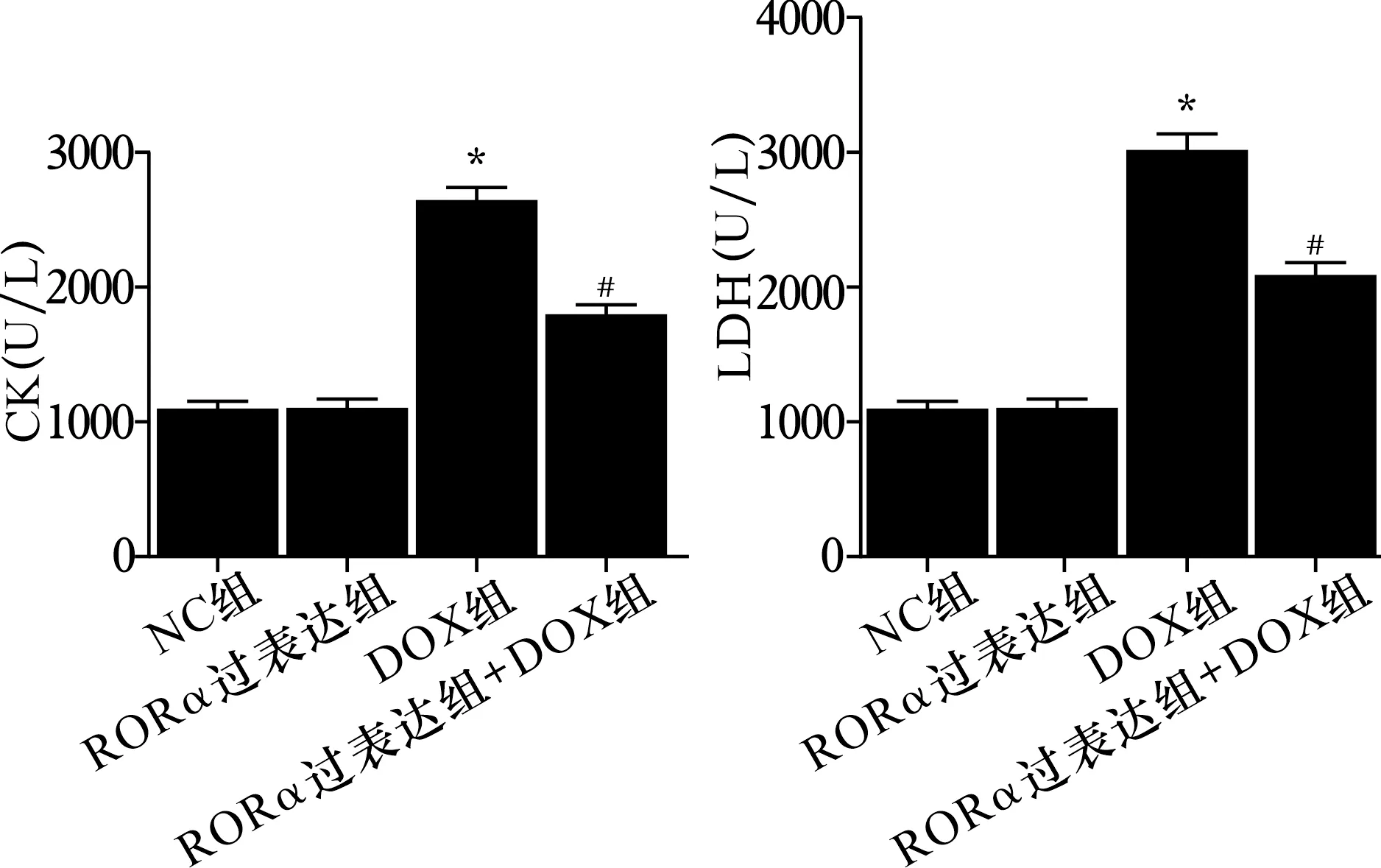
注:与NC组比较,*P<0.05;与DOX组比较,#P<0.05
2.4 各组小鼠心肌凋亡水平比较 见图4。与NC组比较,DOX组TUNEL阳性心肌细胞增加(P<0.05)。与DOX组比较,RORα过表达+DOX组TUNEL阳性心肌细胞减少(P<0.05)。NC组和RORα过表达组TUNEL阳性心肌细胞数比较差异统计学意义(均P>0.05)。

注:左图为各组小鼠心肌细胞染色结果(TUNEL染色,×20;DAPI染色,×400)。右图中,与NC组比较,*P<0.05;与DOX组比较,#P<0.05
2.5 各组小鼠心肌线粒体形态比较 见图5。NC组和RORα过表达组心肌纤维排列整齐,肌小节清晰可见,线粒体均匀分布于心肌纤维内,线粒体嵴及其边缘清晰,大小形态正常。DOX组肌纤维杂乱,肌小节裂解,线粒体肿胀,线粒体嵴断裂,个别线粒体已经成为空泡状,有明显的线粒体损伤。RORα过表达+DOX组肌纤维形态尚可,肌小节模糊不清,线粒体稍肿胀,线粒体边缘和线粒体嵴模糊。
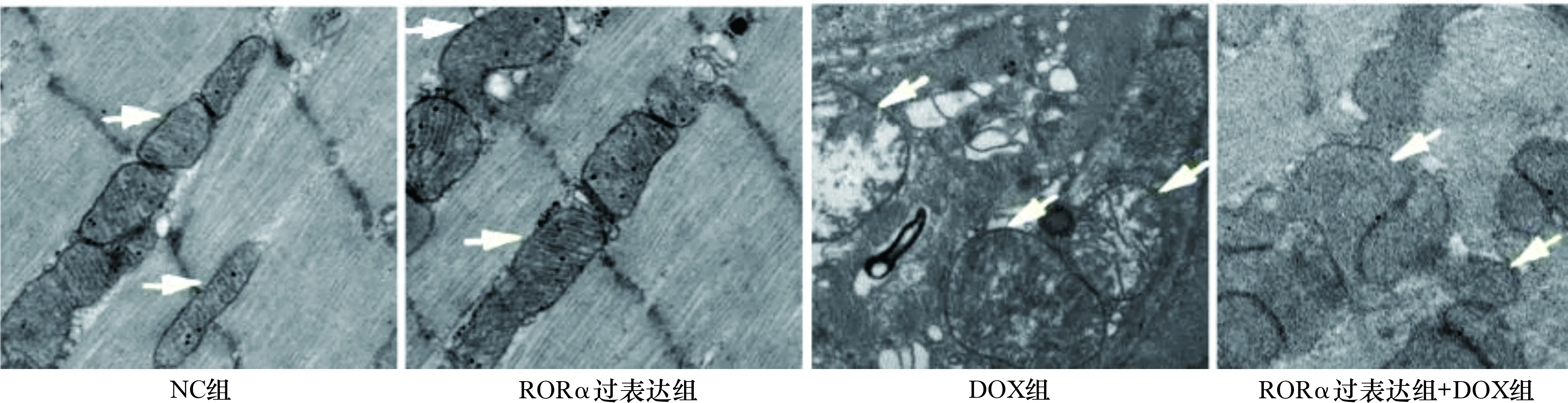
图5 各组小鼠心肌线粒体形态透射电镜图(×30000)
2.6 各组小鼠心肌ROS和MnSOD表达比较 见图6。与NC组比较,DOX组心肌ROS水平增加,MnSOD蛋白表达降低(均P<0.05)。与DOX组比较,RORα过表达+DOX组心肌ROS水平降低,MnSOD蛋白表达增加(均P<0.05)。
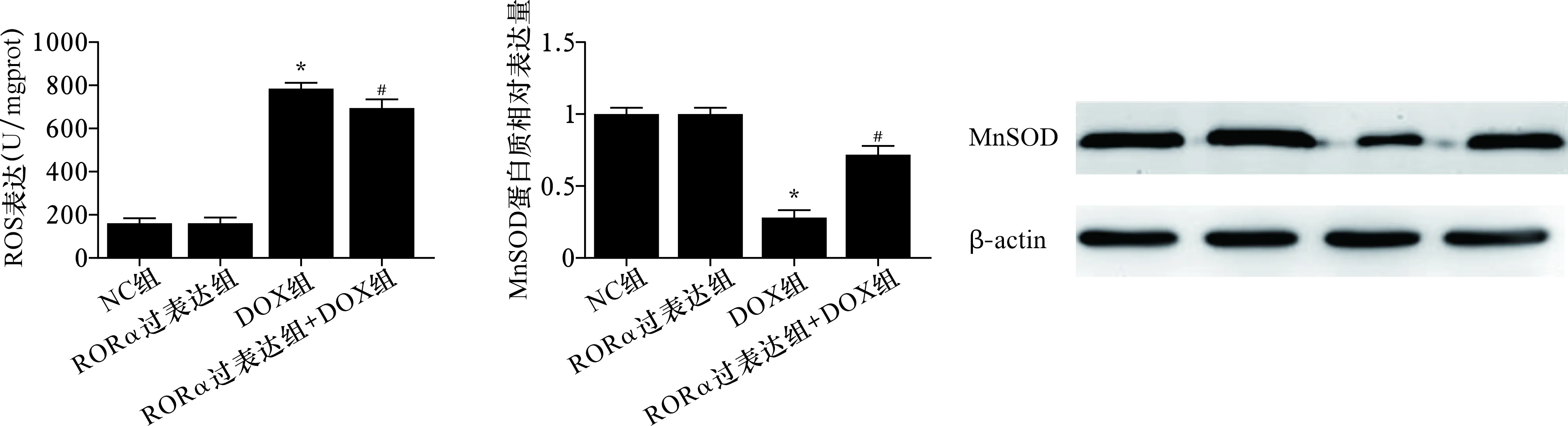
注:与NC组比较,*P<0.05;与DOX组比较,#P<0.05
3 讨 论
DOX是一种重要的细胞毒性化疗药物,有着较为广泛的抗肿瘤谱,已广泛应用于乳腺癌、肺癌、甲状腺癌以及其他实体癌和血液癌的治疗,但是心脏毒性限制了其临床应用[16-17]。其抗肿瘤活性的机制是插入DNA碱基对以及抑制癌细胞中拓扑异构酶Ⅱ导致DNA损伤和细胞死亡。但研究[18]表明,蒽环类药物衍生物引起的心脏毒性占化疗相关心脏毒性的30%以上,因此需要一种特定的方法来预防和减轻心脏不良反应。有研究[19]发现,在接受DOX治疗的肿瘤患者中,DOX心脏毒性可达到60%,严重影响了DOX的临床适应证的扩大。越来越多的研究发现,多种机制及分子参与了DOX所诱发的心肌损伤,ROS的过多产生、心肌细胞凋亡、能量代谢损伤、钙超载以及线粒体功能障碍可能都与其相关。
相关研究发现,RORα在生物周期调节、生物发育、代谢调节和肿瘤发生等生理病理以及昼夜节律调节和褪黑激素效应调节中起着关键性的作用。RORα表达于心脏组织、心肌细胞和血管,可能在心血管保护中也发挥着重要的作用,但其作用机制目前尚不清楚。
研究发现,与正常小鼠比较,糖尿病小鼠心肌组织中RORα表达降低;与野生糖尿病小鼠比较, RORα敲除糖尿病小鼠心功能显著降低,而RORα过表达糖尿病小鼠心功能有显著改善。Beak等[20]研究发现,在血管紧张素Ⅱ诱导的心肌肥大模型中,模型小鼠的心肌组织中RORα表达水平较正常小鼠显著降低。本研究中,与NC组比较,DOX组RORα蛋白表达水平显著降低,RORα过表达组和RORα过表达+DOX组RORα蛋白表达水平显著升高,提示RORα可能是一种新的特异性保护因素,可能成为重要的心血管保护靶点。
Zhao等[21]研究发现,RORα可以通过激活单磷酸腺苷激活蛋白激酶/过氧化物酶体增殖物激活受体γ辅激活因子α(AMPK/PGCα)信号通路和改善线粒体合成对高脂诱导的心肌损伤起到保护作用。本研究中,RORα过表达+DOX组肌纤维形态尚可,肌小节模糊不清,线粒体稍肿胀,线粒体边缘和线粒体嵴模糊,提示过表达RORα可改善DOX诱导的心肌线粒体损伤。
有文献显示,氧化应激参与了DOX诱导的心肌损伤过程,抗氧化酶MnSOD可能发挥着重要的作用。在本研究中我们首次发现,过表达RORα可减少心肌ROS水平,同时增加了MnSOD表达,提示过表达RORα可改善DOX诱导的氧化应激,RORα可能通过调控MnSOD表达降低心肌ROS水平而发挥心肌保护作用。
综上所述,本研究通过尾静脉注射RORα病毒建立小鼠心肌RORα过表达模型,初步验证了RORα过表达对DOX诱导的心肌损伤中的影响,RORα可能通过激活MnSOD抑制氧化应激而发挥保护作用。RORα可能是DOX诱导的心肌损伤的重要靶点,研制针对此靶点的治疗药物可能对于增加DOX的安全性和扩大DOX的临床应用范围具有重要而现实的意义。本研究也有一定的不足之处:一是只在动物实验中验证了RORα在DOX诱导的心肌损伤中的作用,未在RORα细胞实验中验证;二是RORα可能激活MnSOD抑制氧化应激的机制尚不清楚,还需要进一步验证。

