含SH2结构域蛋白酪氨酸磷酸酶2表达变化对肝纤维化大鼠肝组织中细胞外信号调节激酶1/2活性的影响
郝礼森,潘恩亮,季景秀,苗笑佳,蒋美钰,王 薇,刘 甜,高莹莹
(华北理工大学附属医院消化内科,河北 唐山 063000)
肝纤维化是肝脏受到损伤后的修复反应,可进展为肝硬化,而肝星状细胞是参与肝纤维化的最重要细胞[1-3]。含SH2结构域的蛋白酪氨酸磷酸酶2(Src homology 2-containing protein tyrosine phosphatase 2,SHP2)是具有促癌作用的蛋白酪氨酸磷酸酶,其过表达可通过增强细胞外信号调节激酶1/2(Extracellular signal-regulated kinase1/2,ERK1/2)的活性促进肿瘤细胞增殖,参与多种肿瘤的病理过程[4]。近年来研究发现,SHP2除在多种肿瘤的病理过程中发挥重要作用外,也参与了某些非肿瘤性疾病的病理过程。研究发现,在四氯化碳诱导的大鼠肝纤维化病程中,肝组织SHP2表达逐渐升高[5-6];下调体外活化大鼠肝星状细胞SHP2表达可显著抑制其增殖[7]。另有研究[8]发现,ERK1/2信号通路参与了对活化肝星状细胞增殖的调控。目前,SHP2表达变化对纤维化肝组织中ERK1/2的影响尚不清楚。因此,本研究探讨SHP2过表达及低表达对肝纤维化大鼠肝组织中ERK1/2活性的影响。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠160只,体重350~400 g,购自北京华阜康生物科技股份有限公司,质量合格证编号:11501300046788。所有大鼠均按照清洁级要求饲养,自由饮食和进水。实验动物伦理经华北理工大学实验动物伦理委员会审批。
1.2 主要试剂 表达绿色荧光蛋白(GFP)的空病毒Ad-GFP、表达野生型SHP2及GFP的腺病毒Ad-SHP2、表达GFP及靶向SHP2的RNA干扰序列——短发夹RNA(shRNA)的腺病毒Ad-shRNA/SHP2由上海汉恒生物科技公司协助构建;兔抗SHP2多克隆抗体(批号:ET1611-35,武汉Abclonal公司);小鼠抗磷酸化ERK1/2(p-ERK1/2)单克隆抗体(批号:16443-1-AP,北京安诺伦生物科技有限公司);小鼠抗ERK1/2单克隆抗体(批号:381050,北京安诺伦生物科技有限公司)。
1.3 实验方法
1.3.1 大鼠肝纤维化模型构建:160只健康雄性SD大鼠随机分为对照组、模型组、Ad-GFP组、Ad-SHP2组和Ad-shRNA/SHP2组,每组32只。将50%四氯化碳橄榄油混合液腹腔注射入模型组、Ad-GFP组、Ad-SHP2组及Ad-shRNA/SHP2组大鼠,每次1 ml/kg,2次/周,共8周[9]。对照组腹腔注射等量0.9%氯化钠溶液。每周将滴度为2×109pfu/ml的Ad-GFP、Ad-SHP2及Ad-shRNA/SHP2腺病毒自大鼠尾静脉分别注射入Ad-GFP组、Ad-SHP2组及Ad-shRNA/SHP2组大鼠[10]。在造模第2、4、6、8周,每组选取8只大鼠取适量肝组织,一部分用于Western blot及实时荧光定量PCR检测,另一部分于4%多聚甲醛固定后用于Masson三色及HE染色和免疫组织化学染色。
1.3.2 HE染色和Masson三色染色:采用HE染色观察大鼠肝组织病理学变化。采用Masson三色染色观察大鼠肝组织胶原沉积。
1.3.3 实时荧光定量PCR检测SHP2和ERK1 mRNA表达:提取肝组织总RNA,反转录合成cDNA。SHP2、ERK1及内参3-磷酸甘油醛脱氢酶(GAPDH)引物序列由赛默飞世尔科技公司合成。其中,SHP2正向引物序列为5’-CTTGGTGAGTGAGTAGAT-3’,反向引物序列为5’-CTTACGGCAGAACATTAG-3’;ERK1正向引物序列为5’-GGCTCACCCTTACCTGGAAC-3’,反向引物序列为5’-GTCCAAAAGGACAGGGGGT-3’;GAPDH正向引物序列为5’-GAAAGCCTGCCGGTGACTAA-3’,反向引物序列为5’-AGGAAAAGCATCACCCGGAG-3’。在PCR仪上定量扩增,采用2-ΔΔCt法计算大鼠肝组织SHP2、ERK1 mRNA相对表达量[11]。
1.3.4 免疫组化染色检测SHP2蛋白表达水平:采用SP法进行SHP2免疫组织化学染色,阴性对照用PBS代替一抗,棕褐色为阳性表达。用Image Pro Plus 6.0软件分析染色图像,以积分光密度值 (IOD)表示SHP2阳性表达水平。
1.3.5 Western blot法检测ERK1和p-ERK1蛋白表达:取约100 mg大鼠肝组织剪碎,置于EP管中,加入1 ml改良PIPA裂解缓冲液震荡研匀,提取蛋白。测定蛋白含量后取一定量蛋白,添加适量上样缓冲液,经10% SDS-PAGE凝胶电泳后,用水浴式电转仪转至硝酸纤维素膜上,加封闭液4 ℃封闭2 h。分别加入小鼠抗GAPDH单克隆抗体(1∶5000稀释)、小鼠抗ERK1/2单克隆抗体(1∶500稀释)和小鼠抗p-ERK1/2单克隆抗体(1∶500稀释),4 ℃过夜。TPBS漂洗后加入HRP标记的山羊抗鼠IgG二抗(1∶5000稀释),37 ℃孵育2 h。TPBS漂洗后加入ECL显影液显色成像,采用Image J 图像处理软件分析,ERK1及p-ERK1蛋白表达量用二者的IOD与GAPDH的IOD比值表示。
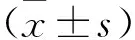
2 结 果
2.1 各组大鼠肝组织病理形态学及胶原沉积变化 见图1。HE及Masson三色染色结果显示,对照组大鼠肝组织无炎症细胞浸润,肝细胞及肝小叶正常,汇管区及小叶间隔有少量纤维沉积,肝小叶中央静脉壁可见纤维染色;模型组、Ad-GFP组、Ad-SHP2组以及Ad-shRNA/SHP2组大鼠肝组织随时间延长逐渐出现炎症细胞浸润、细胞变性坏死、正常肝小叶结构消失,甚至出现假小叶,胶原沉积逐渐增加。在同一造模时间点比较,模型组与Ad-GFP组间上述变化无明显差异;与模型组及Ad-GFP组比较,Ad-SHP2组上述病理变化及胶原沉积更明显,而Ad-shRNA/SHP2组减轻。

图1 各组大鼠造模第6周肝组织HE染色及Masson三色染色结果(×400)
2.2 不同造模时间点各组大鼠肝组织SHP2表达变化 见表1、2(图2)。在不同造模时间点(第2、4、6、8周)对各组大鼠肝组织SHP2 mRNA表达及蛋白阳性表达IOD比较,模型组、Ad-GFP组、Ad-SHP2组及Ad-shRNA/SHP2组在各造模时间点明显高于对照组(均P<0.05),Ad-GFP组与模型组在各造模时间点比较差异无统计学意义(均P>0.05),Ad-SHP2组在各造模时间点较Ad-GFP组及模型组升高(均P<0.05),而Ad-shRNA/SHP2组在各造模时间点较Ad-GFP组及模型组降低(均P<0.05)。

表1 各组大鼠肝组织不同造模时间点SHP2 mRNA表达比较

表2 各组大鼠肝组织不同造模时间点SHP2蛋白阳性表达IOD比较
2.3 不同造模时间点各组大鼠肝组织ERK1表达变化 见表3、4。在不同造模时间点(第2、4、6、8周)比较,模型组、Ad-GFP组、Ad-SHP2组及Ad-shRNA/SHP2组ERK1 mRNA及蛋白表达高于对照组(均P<0.05);但上述四组间比较差异无统计学意义(均P>0.05)。

表3 各组大鼠肝组织不同造模时间点ERK1 mRNA表达比较

表4 各组大鼠肝组织不同造模时间点ERK1蛋白表达水平比较
2.4 不同造模时间点各组大鼠肝组织p-ERK1蛋白表达变化 见表5(图3)。在不同造模时间点(第2、4、6、8周)对各组大鼠肝组织p-ERK1蛋白表达比较,模型组、Ad-GFP组、Ad-SHP2组及Ad-shRNA/SHP2组在各造模时间点高于对照组(均P<0.05),Ad-GFP组与模型组在各造模时间点比较差异无统计学意义(均P>0.05),Ad-SHP2组在各造模时间点较Ad-GFP组及模型组升高(均P<0.05),Ad-shRNA/SHP2组在各造模时间点较Ad-GFP组及模型组降低(均P<0.05)。

表5 各组大鼠肝组织不同造模时间点p-ERK1蛋白表达比较

图3 各组大鼠肝组织p-ERK1蛋白电泳图
3 讨 论
ERK是丝裂原活化蛋白激酶(MAPK)家族的重要成员,MAPK/ERK信号通路是一种进化保守的信号级联,在细胞存活、分化、增殖及凋亡的调控中发挥重要作用,其活化可促进细胞增殖,抑制细胞凋亡[12-14]。本研究利用腺病毒载体将靶向SHP2的shRNA及外源性野生型SHP2基因导入四氯化碳诱导的肝纤维化大鼠,发现SHP2低表达及过表达对大鼠纤维化肝组织中ERK1/2的表达没有影响,但SHP2低表达使大鼠纤维化肝组织中p-ERK1/2的表达下降,而SHP2过表达使p-ERK1/2的表达升高。因为p-ERK1/2为ERK1/2的活化形式,上述结果提示SHP2表达变化影响了大鼠肝纤维化过程中肝组织ERK1/2的活性,即SHP2低表达使大鼠纤维化肝组织中ERK1/2的活性减弱,SHP2过表达使ERK1/2的活性增强。SHP2是由原癌基因编码的具有促癌作用的蛋白酪氨酸磷酸酶,其在肿瘤领域的研究[4,15-18]显示,在多种恶性肿瘤如乳腺癌、肝癌、口腔鳞状细胞癌组织中过表达,通过增强ERK1/2活性促进肿瘤细胞增殖及抑制肿瘤细胞凋亡参与肿瘤的病理过程,而下调SHP2表达可抑制肿瘤细胞ERK1/2的活性。本研究结果与SHP2在肿瘤领域的研究结果一致,提示肝组织SHP2表达变化可能通过调控ERK1/2的活性影响肝纤维化。
肝纤维化的病理特征是以胶原为主的细胞外基质在肝内的异常沉积。本研究应用Masson三色染色检测了大鼠肝组织胶原沉积的变化,发现SHP2低表达使大鼠肝组织的胶原沉积减轻,而SHP2过表达则加重了大鼠肝组织的胶原沉积。这提示SHP2表达变化可通过调控胶原沉积影响肝纤维化。已有研究[8,19-20]发现,在大鼠肝纤维化病程中,肝组织p-ERK1/2的表达升高,ERK1/2信号通路活性增强,抑制ERK1/2信号通路则可抑制肝星状细胞增殖,促进肝星状细胞凋亡,减轻大鼠肝纤维化。结合本研究中SHP2表达变化对大鼠纤维化肝组织ERK1/2的影响,表明ERK1/2参与了SHP2对肝纤维化的影响,即肝组织中SHP2低表达可通过抑制ERK1/2活性使肝纤维化减轻,SHP2过表达可通过增强ERK1/2活性使肝纤维化加重。肝组织由肝细胞、肝窦内皮细胞、肝星状细胞、枯否细胞等多种细胞组成,其中肝细胞是主要细胞,而在肝纤维化病程中发挥重要作用的肝星状细胞仅占约15%[21]。尽管已有研究[7]发现,体外活化大鼠肝星状细胞HSC-T6的SHP2表达下调时细胞增殖明显受到抑制,但SHP2表达变化是通过影响肝脏哪种细胞的ERK1/2信号参与肝纤维化尚需进一步探讨。
综上所述,大鼠肝纤维化组织中SHP2过表达可通过促进ERK1/2磷酸化增强ERK1/2活性,而SHP2低表达则可通过抑制ERK1/2磷酸化降低ERK1/2活性。
- 陕西医学杂志的其它文章
- 骨髓间充质干细胞来源外泌体对大鼠脊髓损伤的改善作用及对脊髓组织胞浆型磷脂酶A2、水通道蛋白4和水通道蛋白9的影响实验研究
- 肉瘤滤过性毒菌致癌同源体B1 V600E基因及生长分化因子15表达变化与甲状腺乳头状癌患者淋巴结转移及预后关系研究
- 积雪草酸对大鼠绝经后骨质疏松症的治疗作用及机制研究
- 微小RNA-214靶向调控PTEN对成骨细胞MC3T3-E1增殖、分化、矿化的影响及机制研究
- JS-K对口腔鳞状细胞癌H157和CAL-27细胞增殖与凋亡的影响及机制实验研究
- O-GlcNAc转移酶介导的Kruppel样因子5 O-GlcNAc糖基化修饰调控细胞周期素D1参与结直肠癌发生、发展实验研究

