肉瘤滤过性毒菌致癌同源体B1 V600E基因及生长分化因子15表达变化与甲状腺乳头状癌患者淋巴结转移及预后关系研究
叶宗媛,许 雪,胡 娟
(合肥市第一人民医院病理科,安徽 合肥 230061)
甲状腺癌为头颈部常见恶性肿瘤之一[1]。甲状腺乳头状癌(Papillary thyroid carcinoma,PTC)为甲状腺癌主要病理类型,其相对懒惰特性使患者10年生存率超过90%,但是在发病早期较易出现淋巴结转移[2-4]。研究[5-6]显示,淋巴结转移是PTC患者肿瘤远处转移及预后不良的重要危险因素,因此研究者一直致力于尽早发现淋巴结转移,并予以针对性干预治疗,以改善患者预后。肉瘤滤过性毒菌致癌同源体B1(V-raf murine sarcoma viral oncogene homolog B1,BRAF)基因作为RAF蛋白家族组成重要成员之一,被激活后可以磷酸化丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK),进而激活下游促有丝分裂信号细胞外调节蛋白激酶(Extracellular regulated protein kinase,ERK),其突变是导致多种恶性肿瘤发生及进展的重要原因之一[7]。研究[8]显示,单一BRAF V600E基因突变出现在超过95%恶性肿瘤中,而PTC患者病灶中存在BRAF V600E基因突变,但是其是否与PTC患者淋巴结转移及预后不良有关尚需要进一步研究证实。生长分化因子15(Growth differentiation factor 15,GDF-15)是转化生长因子家族重要组成成员之一,可能与恶性肿瘤细胞增殖与侵袭关系密切,已被证实与多种恶性肿瘤发生关系密切[9-10]。基于此,本研究探究BRAF V600F基因及GDF-15表达变化与PTC患者淋巴结转移及预后的关系,为后期PTC患者病情评估及预后改善提供参考。
1 对象与方法
1.1 研究对象 收集2020年1月至2022年12月本院病理科确诊的出现淋巴结转移的PTC患者60例为研究组,收集同期无淋巴结转移的PTC患者53例为对照组。研究组中,男性29例,女性31例;年龄22~73岁,平均(42.13±14.74)岁。对照组中,男性13例,女性40例;年龄23~70岁,平均(47.00±12.07)岁。两组患者一般资料比较差异无统计学意义(均P>0.05)。病例纳入标准:患者病情依据甲状腺结节和分化型甲状腺癌诊治指南[11]及术后病理检测确诊;淋巴结是否转移依据淋巴结清扫术后病理予以证实;患者精神意识正常,可以配合研究中各项调查;患者知情同意。排除标准:合并其他类型肿瘤者;其他病理类型甲状腺癌者。研究进行获得患者知情同意,且符合《赫尔辛基宣言》中伦理学标准。
1.2 研究方法
1.2.1 资料收集:收集研究组患者性别、年龄、肿瘤直径、病理分型、包膜浸润等临床特征资料。
1.2.2 样本收集:手术获得样本常规制片,行HE染色后光学显微镜下观察。在显微镜下标记肿瘤病灶部位,选择肿瘤部位进行切片,尽可能避开钙化及出血部位,切下蜡膜(厚度5 μm)后转移至洁净离心管中待测。
1.2.3 BRAF V600E基因检测:肿瘤组织中BRAF V600E基因突变情况采用实时荧光定量聚合酶链式反应进行测定。收集石蜡组织采用DNA提取试剂盒[批号:20190625,天根生化科技(北京)有限公司]提取DNA。DNA纯度及浓度采用紫外分光光度计进行测定。DNA稀释至5 μg/L后采用BRAF V600E基因突变检测试剂盒(批号:20191019,厦门艾德生物医药科技有限公司)进行测定,所有步骤严格按照试剂说明书进行。荧光定量聚合酶链式反应仪测定参数:95 ℃条件下预变性处理10 min;95 ℃条件下退火处理15 s,60 ℃条件下延伸处理60 s,共进行40个循环。获得结果后依据Ct值大小判断是否出现基因突变,若是Ct值≤35则表示出现基因突变。
1.2.4 GDF-15表达检测:采用EnVision二步法试剂盒[批号:20190822,赛默飞世尔科技(中国)有限公司]进行测定。石蜡切片脱蜡后采用抗原修复液修复15 min,双氧水(0.3%)封闭3 min,一抗孵育后置于4 ℃环境中过夜。第2天弃去一抗并冲洗后滴加二抗,室温环境下孵育30 min,随后添加DAB室温显色5 min,苏木素复染处理后应用中性树胶封闭。免疫组化结果由2位高年资高职称医师以双盲法予以判定,随机统计5个高倍镜视野中100个肿瘤细胞中阳性细胞占比,参照切片中阳性染色程度与阳性细胞数占比综合评定染色结果[12],阳性细胞为细胞膜或者细胞质中有清晰淡黄色颗粒或者棕褐色颗粒。阳性细胞占比计分:阳性细胞数占比<5%、5%~25%、26%~50%、51%~75%、>75%分别为0、1、2、3、4分。细胞染色程度计分:无阳性染色、淡黄色、棕黄色、棕褐色分别计分0、1、2、3分。两项相乘后评分≥2分为阳性。
1.2.5 预后随访:所有患者均接受随访以评估预后,随访终末期为2023年1月30日或者患者病情进展甚至死亡。患者病情进展甚至死亡为预后不良,否则为预后良好。
1.3 观察指标 比较两组患者BRAF V600E基因及GDF-15阳性表达差异;分析两指标与淋巴结转移患者临床特征之间关系;分析两指标对PTC患者淋巴结转移的预测价值,以及两指标与PTC患者预后间的关系。
1.4 统计学方法 采用SPSS 20.0统计学软件分析数据。计数资料以[例(%)] 表示,行χ2检验;预测价值应用受试者工作特征(ROC)曲线进行分析;预后应用Kaplan-Meier生存曲线进行分析;P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者BRAF V600E基因突变及GDF-15阳性表达情况比较 见表1。研究组患者BRAF V600E基因突变率及GDF-15阳性表达率高于对照组(均P<0.05)。
2.2 BRAF V600E基因突变及GDF-15阳性表达与淋巴结转移患者临床特征的关系 见表2。BRAF V600E基因突变、GDF-15阳性表达与淋巴结转移患者肿瘤直径、是否包膜侵犯有关(均P<0.05),而与患者性别、年龄、病灶类型无关(均P>0.05)。
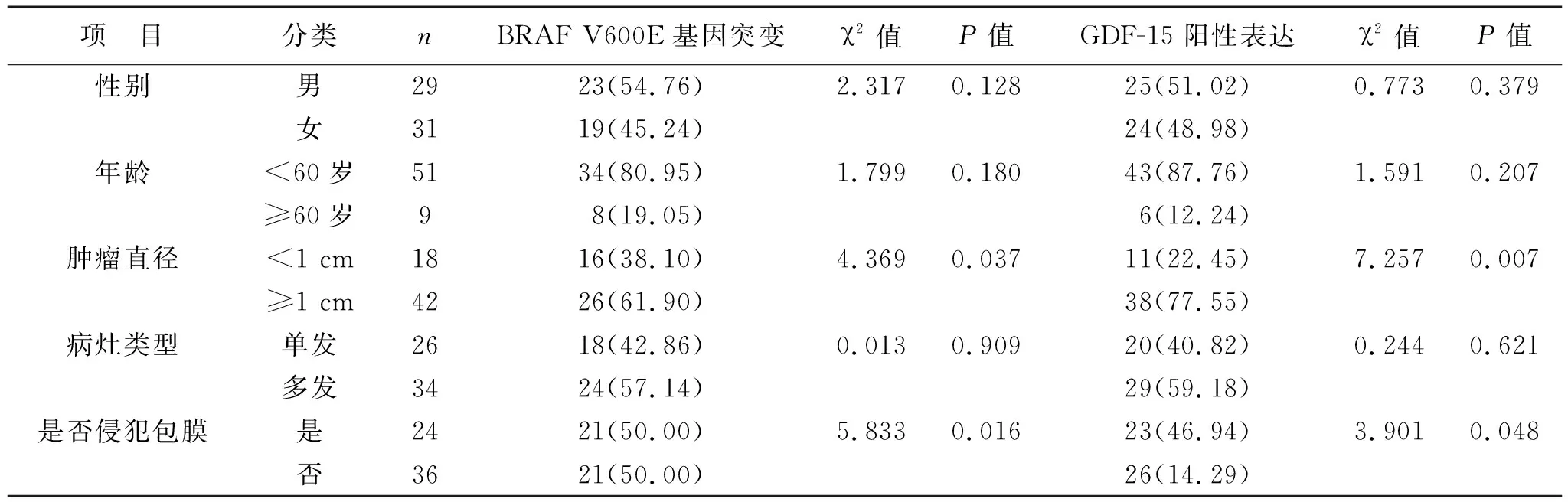
表2 BRAF V600E基因突变及GDF-15阳性表达与淋巴结转移患者临床特征的关系[例(%)]
2.3 BRAF V600E基因突变及GDF-15阳性表达对淋巴结转移的预测价值 见表3。ROC曲线分析显示,BRAF V600E基因突变及GDF-15阳性表达对PTC患者淋巴结转移均具有一定的预测价值,两项联合的预测价值更高(均P<0.05)。
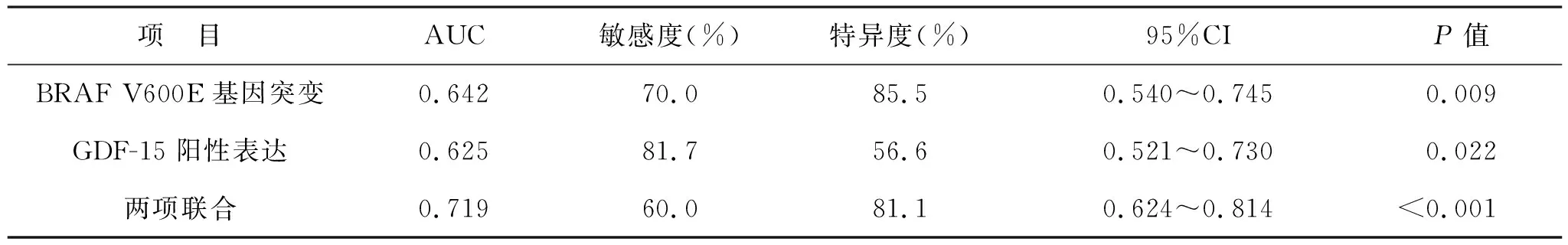
表3 BRAF V600E基因突变及GDF-15阳性表达对淋巴结转移的预测价值
2.4 BRAF V600E基因及GDF-15表达与PTC患者预后间的关系 见图1。60例PTC患者中,失访2例,余58例患者随访时间为11~35个月,中位随访时间为19.3个月。随访期间6例患者死亡,19例患者病情进展,即预后不良患者25例,预后良好患者33例。Kaplan-Meier生存曲线分析结果显示,BRAF V600E基因突变患者累积无进展生存率低于BRAF V600E基因未突变患者(Log-Rank χ2=10.555,P<0.05),GDF-15阳性表达患者累积无进展生存率低于GDF-15阴性表达患者(Log-Rank χ2=9.213,P<0.05)。
3 讨 论
BRAF突变多发生于外显子11与15,其突变类型主要为T1799A突变,嘌呤嘧啶取代处于1799位点位置的胸腺嘧啶,导致对应蛋白质中600位点中赖氨酸被谷氨酸替代而发生BRAF V600E突变[13-14]。本研究结果显示,研究组患者BRAF V600E基因突变率较对照组高,表明PTC患者淋巴结转移可能与BRAF V600E基因突变有关。分析认为,BRAF V600E基因突变导致BRAF基因结构出现变化,无需RAS基因作用即可不断激活MAPK/ERK,导致PTC患者病情进一步恶化而发生淋巴结转移[15-17]。研究[18]显示,PTC患者BRAF V600E突变率相对较高,其高侵扰性生物学行为是导致患者淋巴结转移风险增加的主要原因,因此该研究将BRAF V600E突变作为淋巴结转移独立预测因子,以便为患者手术淋巴结清扫提供合适参考依据。本研究中,BRAF V600E基因预测患者淋巴结转移的AUC为0.642,显示BRAF V600E基因突变用于预测PTC患者淋巴结转移有一定价值,间接证明BRAF V600E基因突变与PTC患者淋巴结转移关系密切。
Zhou等[18]研究显示,当PTC患者肿瘤直径≥5 mm时,BRAF V600E突变阳性患者的中央区淋巴结转移发生率显著升高,显示BRAF V600E突变是中央区淋巴结转移发生的独立危险因素,与本研究结果相似。本研究还发现,BRAF V600E基因突变与淋巴结转移患者肿瘤直径、是否包膜侵犯有关,显示BRAF V600E基因突变可能与患者临床特征关系密切,参与了PTC发生、进展过程,但是其具体作用机制尚需要进一步研究予以证实。国外研究[19]显示,野生型BRAF淋巴结转移的死亡风险没有增加,但具有BRAF突变的淋巴结转移患者死亡风险相对较高,与本研究中不同BRAF V600E基因突变情况患者累积无进展生存率分析结果一致。
GDF-15在炎症、缺氧以及肿瘤发生等病理过程中经由多种途径影响细胞免疫应答过程。此外,其还可以在肿瘤发生早期抑制肿瘤细胞生长,在晚期促进肿瘤生长[20-21]。研究[22-23]显示,结直肠癌、肾细胞癌患者体内血清GDF-15水平明显上升,参与了肿瘤细胞增殖、侵袭及转移等多种恶性生理学过程。本研究结果显示,相对于无淋巴结转移PTC患者,存在淋巴结转移的PTC患者GDF-15阳性表达率较高,显示淋巴结转移与患者体内GDF-15表达有关,这可能与GDF-15导致原癌基因受体络氨酸酶激活从而促进肿瘤发生与进展有关[24]。国外研究[25]认为,肿瘤患者体内GDF-15促癌或者抑癌作用主要由细胞所处环境及状态决定,正常情况下其可以抑制肿瘤细胞生长,而肿瘤发生晚期其表达则会促进肿瘤干细胞形成、对治疗敏感性降低及免疫逃逸发生。倪志强等[26]研究显示,GDF-17在转移病灶中高表达,且与肿瘤直径、临床分期等临床特征关系密切,与本研究结果一致。本研究结果显示,GDF-15阳性表达患者累积无进展生存率显著低于GDF-15阴性表达患者,显示GDF-15表达与患者预后关系密切,GDF-15表达阳性患者肿瘤直径大,患者病情严重,预后不良风险相对较高。Kang等[27]研究显示,GDF-15高表达所致肿瘤侵袭性是患者预后不良的主要原因,认为GDF-15是一种线粒体应激诱导甲状腺癌肿瘤细胞产生的有丝分裂因子,GDF-15诱导的转录活化因子3激活决定了甲状腺癌病情进展,可能是导致患者预后不良主要原因。
此外,本研究还发现,BRAF V600E基因突变联合GDF-15阳性表达预测PTC患者淋巴结转移的AUC为0.719,高于两项指标的预测价值,提示两者可能在淋巴结转移中发挥协同作用,但是其具体作用机制尚需要后续研究进一步证实,
综上所述,PTC患者BRAF V600E基因及GDF-15表达变化与PTC患者淋巴结转移及预后关系密切,均可能参与了PTC病情发生及进展过程,可以作为患者病情评估及预后的预测指标。

