微小RNA-214靶向调控PTEN对成骨细胞MC3T3-E1增殖、分化、矿化的影响及机制研究
方 宇,董重阳,高斌礼,李明宇,李 伟,郭 文,焦志超
(1.内蒙古医科大学附属医院骨科,内蒙古 呼和浩特 010050;2.内蒙古医科大学中医学院,内蒙古 呼和浩特 010107;3.内蒙古医科大学第二附属医院影像中心,内蒙古 呼和浩特 010010)
随着老龄化加剧,近些年我国骨质疏松(Osteporsis,OP)发病率呈递增趋势。OP是一种代谢性的全身性骨骼疾病,多发于老年人及绝经后妇女等群体,主要临床特征是骨组织中骨量减少、骨微观结构受损、骨强度降低等,随着疾病进展,骨脆性增加,骨折风险也急剧增加,导致患者出现骨骼疼痛、变形等不适症状,严重影响了患者的生活质量[1-4]。目前研究[5-6]认为,OP的发生发展与雄性激素、营养和其他物理因素引起的骨代谢失衡密切相关,在骨代谢中成骨细胞扮演着重要角色,其增殖和分化能力决定骨量多少。微小RNA(microRNA,miR)由约22个核苷酸组成,主要通过调控多个靶基因表达,从而参与调控疾病进程[7]。有研究[8]在小鼠尾悬吊诱导的骨丢失模型中发现,骨组织中的miR-214表达量明显升高。然而,miR-214是否通过调控成骨细胞参与OP进程的相关研究较少。作为经典的信号通路,磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinases,PI3K)/蛋白激酶B(Protein kinase B,AKT)信号通路参与多种疾病发生与发展,近些年来发现PI3K/AKT可以在第10号染色体丢失性磷酸酶及张力蛋白同源基因(Phosphatase and tensin homolog deleted on chromosome ten,PTEN)介导下参与到骨代谢进程。生物信息学分析显示miR-214能够靶向调控PTEN。因此,本研究选取成骨细胞MC3T3-E1为研究对象,观察miR-214调控PTEN对成骨细胞的作用及机制。
1 材料与方法
1.1 实验细胞 成骨细胞MC3T3-E1和工具细胞HEK 293T购自中国科学院上海细胞研究所。
1.2 主要试剂 α-MEM培养基(批号:11965012)、链霉素/青霉素(批号:15070117)、高容量cDNA反转录试剂盒(批号:4368845)、TRIzol试剂(批号:15596035)、链霉素亲和偶联磁珠(批号:88392)、胎牛血清(批号:16140324)购自美国Thermo Fisher公司;miR-124模拟物(mimic)和阴性对照(NC)、pcDNA3.1-PTEN由广州源井生物科技有限公司提供;CCK-8试剂盒(批号:C0038)购自上海碧云天生物技术有限公司;骨钙素放射免疫试剂盒(批号:NJ0432)、碱性磷酸酶试剂盒(批号:NJ18723)购自南京建成生物科技有限公司;兔抗PTEN(批号:A2784)、Ⅰ型胶原蛋白(Col Ⅰ,批号:A5432)、骨桥蛋白(OPN,批号:A1137)、p-PI3K(批号:A4233)、p-AKT(批号:A4234)购自武汉爱博泰克生物科技有限公司。
1.3 实验方法
1.3.1 细胞培养与转染:复苏MC3T3-E1细胞,使用含10%胎牛血清与100 mg/ml链霉素/青霉素的α-MEM培养基,恒温培养箱中培养,条件设置为饱和湿度、温度37 ℃、5% CO2。待融合达到80%后,加入胰蛋白酶消化、传代。取对数生长期MC3T3-E1细胞,根据Lipofectamine 2000试剂盒说明书进行转染,将细胞分为miR-124 mimic组、miR-124 NC组、pcDNA3.1-PTEN组、miR-124 mimic+pcDNA3.1-PTEN组,48 h后收集各组细胞备用。
1.3.2 实时荧光定量聚合酶链式反应(RT-qPCR)检测细胞miR-124和PTEN mRNA表达:采用TRIzol试剂提取各组细胞总RNA,用反转录试剂盒转录成cDNA。PCR反应体系:上下游引物各0.5 μg、1 μg cDNA模板和SYBR Premix Ex Taq Ⅱ试剂盒,配制20 μl。反应条件:95 ℃预变性2 min;95 ℃ 15 s,60 ℃ 60 s,循环40次。引物序列见表1。采用2-ΔΔCt法计算miR-124、PTEN mRNA相对表达水平。
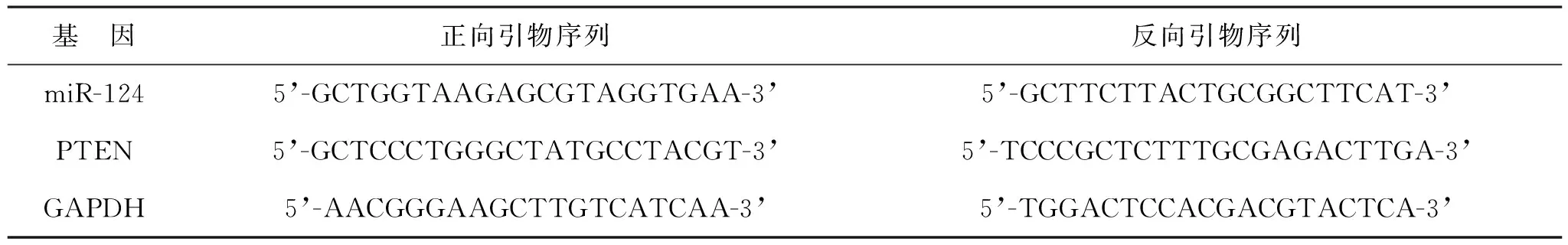
表1 各基因引物序列
1.3.3 双荧光素酶报告基因检测miR-124与PTEN靶向结合:miR-124与PTEN结合位点使用生物信息学数据库Target Scan Human预测。构建突变型psiCheck2-PTEN-MUT-Luc和野生型psiCheck2-PTEN-WT-Luc荧光质粒,与阴性对照和miR-124模拟物共转染至HEK 293T细胞,检测荧光信号强度。
1.3.4 CCK-8法检测细胞增殖:取各组对数生长期细胞,加入胰蛋白酶消化计数。按照2×104个/孔接种于96孔板中,置于恒温箱(37 ℃、5% CO2)中培养48 h后,将10 μl CCK-8分别加入各组孔中,培养2 h,酶标仪检测450 nm处的吸光度值(A)。细胞增殖率=(A样品-A空白)/A空白×100%。
1.3.5 碱性磷酸酶活性检测:取各组对数生长期细胞,加入胰蛋白酶消化计数,按照2×104个/孔接种于24孔板中,置于恒温箱(37 ℃、5% CO2)中培养。待细胞贴壁后,弃去培养基,加入含有成骨诱导剂(0.15 mmo/L抗坏血酸、10-8mmol/L地塞米松以及10 mmol/L β-甘油磷酸钠)的培养基,放回培养箱,然后继续培养7 d,按照试剂盒说明书检测。
1.3.6 骨钙素水平检测:取各组对数生长期细胞,加入胰蛋白酶消化计数,按照2×104个/孔接种于24孔板中,置于恒温箱(37 ℃、5% CO2)中培养,等到细胞贴壁,将培养基去除,然后将含有矿化诱导剂(50 mg/L抗坏血酸和10 mmol/L β-甘油磷酸钠)的培养基加入进去,返回培养箱当中,继续培养21 d,按照骨钙素放射免疫试剂盒说明书步骤检测。
1.3.7 茜素红染色:取各组对数生长期细胞,加入胰蛋白酶消化计数,按照5×103个/孔接种于96孔板中,置于恒温箱(37 ℃、5% CO2)中培养。待细胞贴壁后,弃去培养基,加入含有矿化诱导剂的培养基,继续培养21 d。取各组细胞加入70%乙醇,固定1 h后,然后加入浓度为10%的茜素红,置于恒温箱中,设置温度37 ℃,继续培养30 min,然后加入浓度为10%的西吡氯胺,室温静置10 min,取出并用PBS液冲洗2遍,镜下观察,在低倍镜下任选5个视野,采用NIH Image 1.31软件进行分析,根据钙化面积与总面积比值计算矿化率,即矿化率=钙化面积/总面积×100%。
1.3.8 Western blot检测蛋白表达:加入适量预冷裂解液至各组细胞匀浆,于冰上孵育30 min。离心(4 ℃下10000 r/min)10 min后,取上清液,BCA定量后制样。电泳、转模、切胶片后,加入5%脱脂奶粉配置的封闭液,置于摇床中封闭1 h。加入一抗[PTEN(1∶1000稀释)、Col Ⅰ(1∶500稀释)、OPN(1∶500稀释)、p-PI3K(1∶500稀释)、p-AKT(1∶500稀释)],摇匀置于恒温箱(4 ℃)中过夜,洗膜,加入二抗(1∶5000稀释),室温孵育2 h。洗膜添加显色液,避光5 min,采用Image J分析。
2 结 果
2.1 生物信息学分析及双荧光素酶报告基因检测结果 见图1、2。在线生信(http://www.targetscan.org/vert_72/)预测显示miR-124和PTEN存在结合位点。双荧光素酶报告基因结果发现,miR-124 mimic组野生型PTEN的荧光素酶活性明显低于miR-124 NC组(均P<0.05),miR-124 mimic组与突变型PTEN的荧光素酶活性比较差异无统计学意义(P>0.05)。
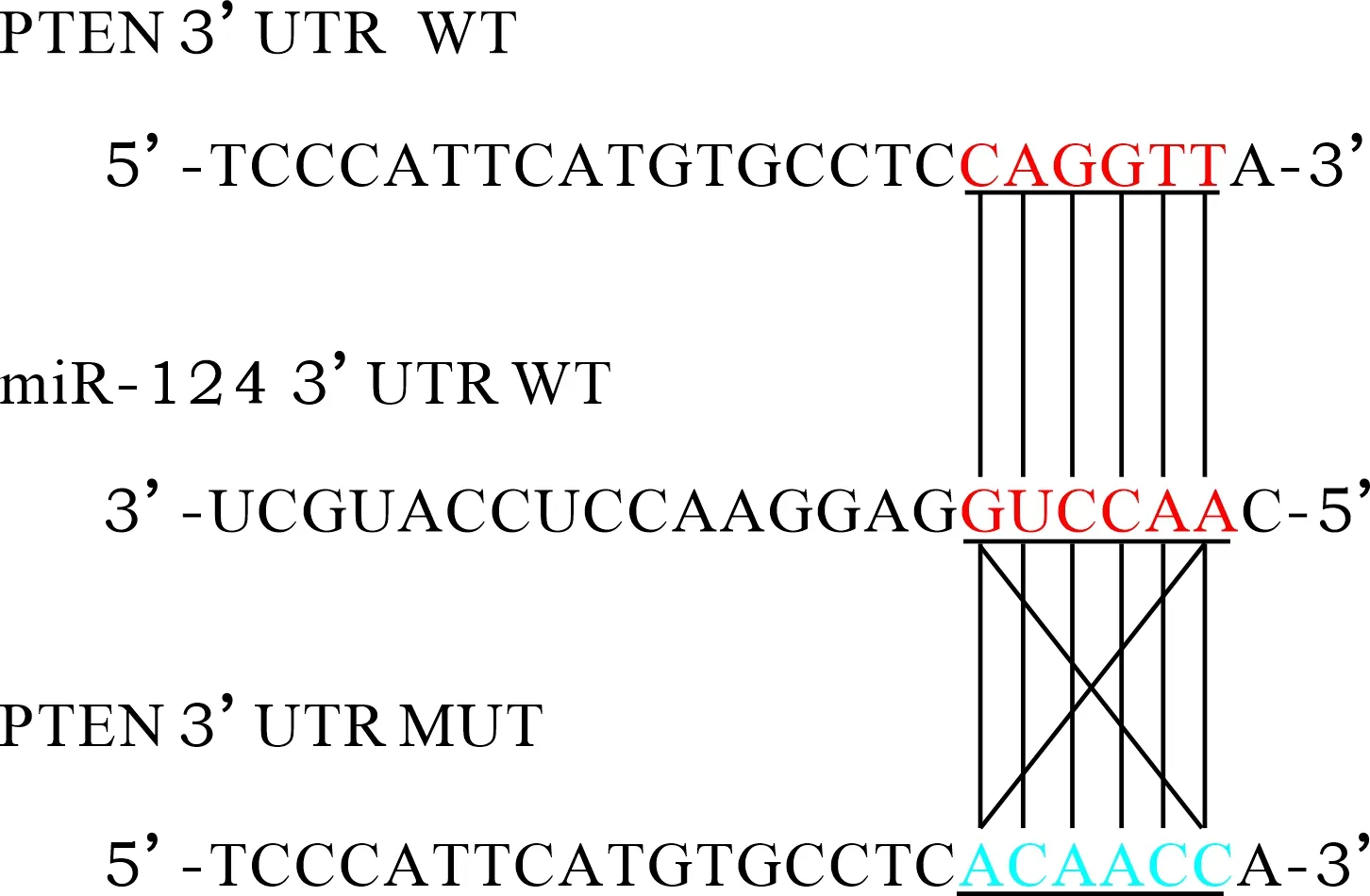
图1 miR-124与PTEN结合位点
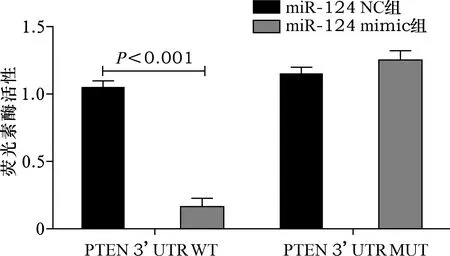
图2 双荧光素酶报告基因检测结果
2.2 miR-124对MC3T3-E1细胞PTEN mRNA及蛋白表达的影响 见表2。qRT-PCR及Werstern blot结果显示,与miR-124 NC组比较,miR-124 mimic组miR-124表达升高(P<0.05);与miR-124 NC组比较,miR-124 mimic组PTEN mRNA及蛋白表达降低,pcDNA3.1-PTEN组表达升高(均P<0.05);与miR-124 mimic组比较,miR-124 mimic+pcDNA3.1-PTEN组PTEN mRNA及蛋白表达升高(均P<0.05)。

表2 miR-124对MC3T3-E1细胞PTEN mRNA及蛋白表达的影响
2.3 miR-124对MC3T3-E1细胞增殖的影响 CCK-8检测结果显示,miR-124 NC组、miR-124 mimic组、pcDNA3.1-PTEN组和miR-124 mimic+pcDNA3.1-PTEN组细胞增殖率依次为(87.34±3.25)%、(109.25±4.58)%、(53.47±2.93)% 和(85.43±3.22)%。与miR-124 NC组比较,miR-124 mimic组细胞增殖率升高,pcDNA3.1-PTEN组降低(t=6.757、13.407,均P<0.05);与miR-124 mimic组比较,miR-124 mimic+pcDNA3.1-PTEN组细胞增殖率降低(t=7.369,P<0.05)。
2.4 miR-124对MC3T3-E1细胞分化的影响 见表3。miR-124 mimic组细胞碱性磷酸酶活性、Col Ⅰ、OPN表达明显低于miR-124 NC组,pcDNA3.1-PTEN组细胞碱性磷酸酶活性、Col Ⅰ、OPN表达明显高于miR-124 NC组(均P<0.05)。miR-124 mimic+pcDNA3.1-PTEN组细胞碱性磷酸酶活性、Col Ⅰ、OPN明显高于miR-124 mimic组(均P<0.05)。

表3 调控miR-124表达对MC3T3-E1细胞分化的影响
2.5 miR-124对MC3T3-E1细胞矿化的影响 见表4。与miR-124 NC组比较,miR-124 mimic组细胞矿化率和骨钙素水平降低,pcDNA3.1-PTEN组升高(均P<0.05)。与miR-124 mimic组比较,miR-124 mimic+pcDNA3.1-PTEN组细胞矿化率和骨钙素水平升高(均P<0.05)。

表4 miR-124对MC3T3-E1细胞分化的影响
2.6 miR-124对MC3T3-E1细胞PI3K/AKT信号通路蛋白的影响 见表5。Werstern blot检测结果显示,与miR-124 NC组比较,miR-124 mimic组细胞p-PI3K、p-AKT蛋白表达升高,pcDNA3.1-PTEN组表达降低(均P<0.05);与miR-124 mimic组比较,miR-124 mimic+pcDNA3.1-PTEN组细胞p-PI3K、p-AKT蛋白表达降低(均P<0.05)。

表5 miR-124对MC3T3-E1细胞PI3K/AKT信号通路相关蛋白表达的影响
3 讨 论
正常情况下,成骨细胞和破骨细胞处于一种动态平衡状态,其在维持机体骨量中扮演着重要角色,然而一旦平衡打破,可能诱发机体出现骨质疏松[9]。多数研究证实,在成骨细胞增殖、分化以及矿化过程中,microRNAs出现异常表达。Cui等[10]研究发现,在成骨细胞hFOB1.19中,当上调miR-296时,Cbfal蛋白表达也随之上调,同时加剧了细胞成骨细胞分化。Yu等[11]研究发现,miR-455-3p能够调控同源结构域相互作用蛋白激酶2(HIPK2)表达,介导转录激活蛋白3(STAT3)信号通路参与高糖诱导的成骨细胞凋亡和增殖。miR-214位于人染色体的1q24.3区域。有研究[12]显示,乳腺癌骨转移患者破骨细胞中miR-214表达明显上调,且能够下调肿瘤坏死因子受体相关因子3表达,促进破骨细胞分化,给予拮抗剂可减弱骨溶解转移进展。本研究生信在线分析结果显示miR-214和PTEN存在靶向结合序列。Liu等[13]研究发现,在糖尿病肾病大鼠中miR-214可以靶向调控PTEN。赵娜等[14]研究发现,在骨肉瘤中miR-214可以靶向PTEN抑制肿瘤细胞凋亡。本研究选取成骨细胞MC3T3-E1为研究对象,采用细胞转染上调miR-214表达,结果显示PTEN mRNA和蛋白均表达下调,双荧光素酶报告基因检测也证实两者存在靶向调控关系。
PTEN位于人染色体的10q23.3,主要通过调控PI3K/AKT信号通路参与多种疾病进程[15-16]。研究[17]发现,PTEN在骨质疏松患者血清中的表达显著高于健康人群,而miR-140-3p低于健康人群,且两者存在靶向调控作用。本研究将miR-214 mimic和pcDNA3.1-PTEN单独或两者共转染至成骨细胞MC3T3-E1中,结果显示miR-214表达上调能够明显抑制细胞增殖、成骨分化和矿化,降低成骨分化碱性磷酸酶、Col Ⅰ、OPN和骨钙素水平,而过表达PTEN则会逆转上述作用,提示miR-214调控成骨细胞MC3T3-E1增殖、分化以及矿化是通过靶向调控PTEN完成。
骨代谢平衡受到多种信号通路调控,PI3K/AKT信号通路是一条内源性的转导通路,参与了多种疾病进程,PI3K/AKT发生磷酸化后能直接调控细胞的增殖、凋亡与衰老等生理过程[18-19]。Khan等[20]采用Rapamycin阻断PI3K/AKT信号通路,在钙质沉积的茜素红染色减弱,成骨细胞分化受到明显抑制。本研究发现,过表达miR-124可以显著上调p-PI3K、p-AKT蛋白水平,提示上调miR-214表达后,PTEN蛋白表达下降,进而激活PI3K/AKT信号通路,从而调控成骨细胞MC3T3-E1增殖、分化和矿化。micro-RNAs在骨重建过程中发挥重要作用,尤其在调控成骨细胞和破骨细胞分化功能以及骨质疏松等疾病方面[21-22]。未来有可能通过抑制或者过表达某些特定的microRNAs来减缓患者的骨丢失,促进骨重塑,从而达到治疗骨病的目的。
综上所述,miR-214通过靶向下调PTEN蛋白表达激活PI3K/AKT信号通路,从而调控成骨细胞MC3T3-E1增殖、分化和矿化。miR-214未来可能成为骨病潜在的治疗靶点。本研究也存在不足之处,只是在细胞中初步揭示了miR-214调控MC3T3-E1细胞成骨分化的分子机制,而miR-214能否作为骨病诊断标志物以及其效能大小需进一步研究。

