骨髓间充质干细胞来源外泌体对大鼠脊髓损伤的改善作用及对脊髓组织胞浆型磷脂酶A2、水通道蛋白4和水通道蛋白9的影响实验研究
唐 剑,陈双华,何 凌
(1.南充市高坪区人民医院神经外科,四川 南充 637100;2.南充市中心医院嘉陵院区内二科,四川 南充 637500)
脊髓损伤(Spinal cord injury,SCI)是一种中枢神经系统的严重创伤,损伤后数小时至数天内会出现复杂的继发性损伤,如脊髓局部水肿、炎症反应、缺血缺氧、脂质过氧化等,这些因素使多种信号通路的级联反应被激活,扩大了原发性损伤的范围和程度[1]。一般认为继发性损伤若治疗及时是可逆的。骨髓间充质干细胞(Bone marrow stromal cells,BMSCs)移植成为治疗SCI最有希望的方法之一[2]。BMSCs可直接分化、替代脊髓损伤组织,分泌细胞因子、生长因子等介质,帮助伤口修复和血管生成,同时分泌大量外泌体,这些外泌体对炎症部位有被动靶向性,能激活内源性修复机制,起到促进神经生长的作用[3-4]。相关研究证实,脊髓损伤后水通道蛋白(Aquaporin,AQP)表达增加,引起脊髓水肿,脊髓压力持续升高,使脊髓微循环出现异常,加重SCI[5]。而胞浆型磷脂酶A2(Cytosolic phospholipase A2,cPLA2)则是影响继发性炎症反应和细胞凋亡等多种关键机制的重要分子[6]。基于此,本研究探讨BMSCs来源外泌体对大鼠SCI的改善作用及对脊髓组织cPLA2、AQP4及AQP9的影响,为BMSCs来源外泌体的临床应用提供理论依据。
1 材料与方法
1.1 实验细胞和动物 骨髓间充质干细胞(货号:A01X1663)购买于上海抚生实业有限公司。雄性SD大鼠30只,SPF级,体重180~200 g,购于西安交通大学实验动物中心。动物饲养条件:温度设定为20~23 ℃,湿度设定为60%~70%,明暗各12 h,正常饮水和摄食。
1.2 主要试剂 完全DMEM/F12培养基(货号:KGM12500S-500)购自江苏凯基生物技术股份有限公司;外泌体提取试剂盒、DAB显色试剂盒、反转录试剂盒(货号:39013-50T、3503-100T、D1801XL)购自上海雅吉生物科技有限公司;BCA蛋白浓度测定试剂盒、PBS缓冲液(货号:R21250、R22379)购自上海源叶生物科技有限公司;RIPA蛋白裂解液、总RNA提取、TRIzol试剂(货号:LM3201-1、LM-21087R、LM0016)购自上海联迈生物工程有限公司;HE染色试剂盒、原位末端脱氧核苷酸转移酶标记法(TUNEL)细胞凋亡检测试剂盒(货号:FS-10-17869、FS-79507)购自上海抚生实业有限公司。
1.3 实验方法
1.3.1 BMSCs培养:细胞复苏后用含10%胎牛血清、1%青-链霉素的完全DMEM/ F12培养基培养,将其混匀,并于培养瓶中按1×109个/L密度进行接种,每2天后换液,镜下观察细胞生长状态,当细胞生长至80%~90%融合度时,按1∶2比例进行传代。
1.3.2 外泌体提取与鉴定:取生长良好的第3代BMSCs,以10%不含外泌体的DMEM /F12培养基培养BMSCs 24 h,培养至70%~80%融合时收取培养基,参照说明书使用外泌体提取试剂盒提取外泌体,重悬于PBS中,透射电镜观察BMSCs外泌体形态,BCA蛋白浓度测定试剂盒检测外泌体蛋白含量,Western blot法对外泌体特异表面标志物CD63和Alix的表达进行测定。
1.3.3 大鼠分组与模型制备:将大鼠随机分为假手术组、模型组和外泌体组,每组10只。术前禁食6 h后,以1%戊巴比妥钠50 mg/kg麻醉,术区消毒,选择T10为中心,作一2.5 cm正中切口,充分暴露T9至T11节段,利用咬骨钳将T10棘突和椎板去除,注意硬膜完整。假手术组逐层缝合切口,模型组和外泌体组依次用打器击打T10,若损伤后局部迅速充血水肿,且双后肢抽搐,尾巴摆动,则为造模成功。外泌体组造模成功30 min后,予以尾静脉注射200 μl外泌体,假手术组及模型组大鼠尾静脉注射等体积PBS。各组大鼠每隔2 d注射1次,共注射3次,术后人工辅助大鼠排尿,3次/d,直至其可自主排尿。
1.3.4 大鼠脊髓损伤行为学(BBB)评分[7]:干预前及干预后3、7 d进行BBB评分。使待测大鼠在空旷平地上自由活动5 min,仔细观察关节、运动、踩踏和协调性。每只大鼠测试3次,取平均值,无肢体运动或体质量支持为0分,正常运动为21分。
1.3.5 大鼠脊髓组织HE染色:干预7 d后,各组随机取3只大鼠,以1%戊巴比妥钠50 mg/kg进行腹腔注射麻醉,固定后剪开腹腔,并暴露心脏部位,将灌注针刺入主动脉内,剪开右心耳后灌注0.9%氯化钠溶液。当右心耳有透明液体流出时即可停止,再行4%多聚甲醛灌注至四肢僵硬,于T10损伤处取1 cm脊髓组织,经脱水、透明、浸蜡、包埋及切片等后HE染色再封片,光学显微镜下观察脊髓组织变化。
1.3.6 脊髓神经细胞凋亡检测:将脊髓组织石蜡切片先脱蜡和水化,再用PBS缓冲液冲洗2次,蛋白酶K处理15 min,2% H2O2处理5 min,经PBS冲洗2次,加TUNEL反应液37 ℃避光30 min,PBS清洗3次后,DAB显色,苏木精复染后封片干燥。每张切片随机取5个视野,荧光显微镜下观察,阳性细胞为绿色。
1.3.7 脊髓组织cPLA2、AQP4、AQP9 mRNA表达检测:采用实时荧光定量PCR(RT-qPCR)检测。取大鼠脊髓组织,研磨破碎,总RNA以TRIzol法提取,并取2 μg RNA反转录后并扩增(常规条件)获取产物。经PCR反应40个循环后,将扩增产物凝胶电泳,用凝胶成像仪获取图片,内参为GAPDH,以2-ΔΔCt法对样本基因进行表达差异相对定量分析。各基因引物序列见表1。
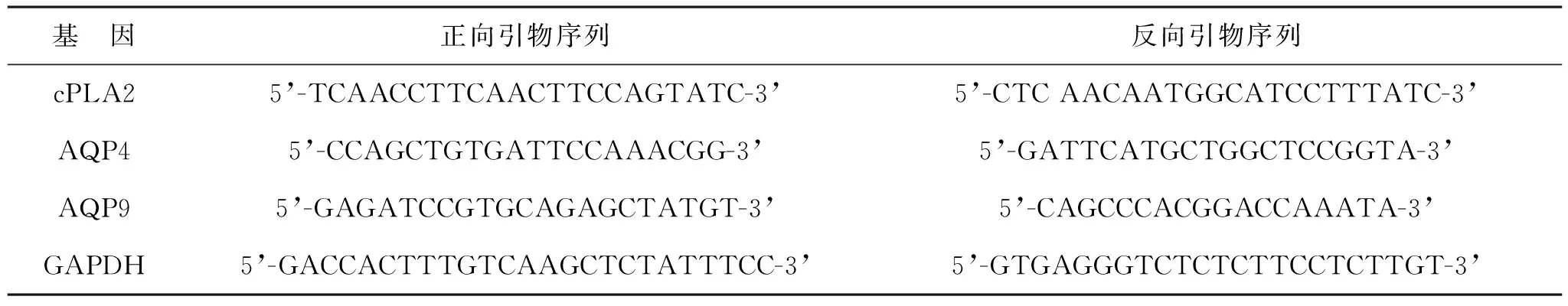
表1 各基因引物序列
1.3.8 脊髓组织cPLA2、AQP4、AQP9蛋白表达检测:采用Western blot检测。取大鼠脊髓组织放入RIPA裂解液中,12000 r/min离心10 min后取上清液,BCA检测蛋白浓度,蛋白上样10 μg电泳。将电泳分离得到的样本移到PVDF膜上固定,并封闭1 h(10%山羊血清),一抗孵育过夜(4 ℃)后加二抗孵育(常温)1 h。以GAPDH为内参,经洗膜、显色后成像拍照,做灰度值分析。
2 结 果
2.1 BMSCs形态 见图1。倒置显微镜下可见传代细胞呈均匀分布,生长迅速,3~4 d可铺满瓶壁,细胞多呈梭形,生长状态良好。

图1 培养第4天(左)及培养至第3代(右)
2.2 外泌体鉴定 见图2。透射电镜下可见BMSCs外泌体直径40~110 nm,呈圆形、椭圆形或“茶托样”囊泡结构,大小不均,膜结构完整。Western blot检测BMSCs外泌体表面标志蛋白CD63、Alix,结果呈阳性。

图2 BMSCs外泌体电镜下结构(×200,左)
2.3 各组大鼠BBB评分比较 见表2。干预前后假手术组BBB评分比较,以及干预前模型组与外泌体组BBB评分比较,无统计学差异(均P>0.05)。干预后3、7 d,外泌体组BBB评分高于模型组(均P<0.05)。

表2 各组大鼠BBB评分比较(分)
2.4 各组大鼠脊髓组织HE染色结果比较 见图3。假手术组脊髓组织无损伤坏死及出血,结构完整,细胞排列有序,细胞核形态正常。模型组大鼠脊髓结构紊乱,大量炎性细胞浸润,伴有囊性腔和空泡,神经元和细胞水肿,神经元数量明显减少。外泌体组脊髓损伤区组织结构紊乱和炎性细胞浸润减轻,脊髓空洞小,损伤恢复较好。

图3 各组大鼠脊髓组织HE染色结果(×400)
2.5 各组大鼠脊髓组织细胞凋亡情况比较 见图4。假手术组脊髓组织凋亡细胞较少。模型组细胞凋亡率较假手术组、外泌体组高,而外泌体组细胞凋亡率低于模型组(均P<0.05)。

注:左图为各组大鼠脊髓组织TUNEL染色结果(×400)。右图中,与假手术组比较,*P<0.05;与模型组比较,#P<0.05
2.6 各组大鼠脊髓组织cPLA2、AQP4、AQP9 mRNA表达比较 见图5。模型组脊髓组织cPLA2、AQP4、AQP9 mRNA表达高于假手术组,而外泌体组cPLA2、AQP4、AQP9 mRNA低于模型组(均P<0.05)。

注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
2.7 各组大鼠脊髓组织cPLA2、AQP4、AQP9蛋白表达比较 见图6。模型组脊髓组织cPLA2、AQP4以及AQP9 蛋白表达高于假手术组,而外泌体组cPLA2、AQP4以及AQP9蛋白表达低于模型组(均P<0.05)。

注:上图为各组大鼠脊髓组织cPLA2、AQP4、AQP9蛋白电泳结果。下图中,与假手术组比较,*P<0.05;与模型组比较,#P<0.05
3 讨 论
SCI是临床上常见的创伤性疾病,多由高能量作用引起,但在特定人群如老年人,也可由低能量损伤引起,易造成暂时或永久性的感觉丧失,引起运动功能障碍[8]。现阶段,相比于间充质干细胞移植治疗,BMSCs外泌体显示出良好的治疗潜力,有较高的安全性、更低的免疫原性和无成瘤性等优势,进入损伤部位后能通过旁分泌机制发挥作用[9-10]。本实验通过Allen法制作SCI大鼠模型,并提取鉴定BMSCs外泌体用于大鼠尾静脉注射治疗,透射电镜下可见BMSCs外泌体直径40~110 nm,呈圆形、椭圆形或“茶托样”囊泡结构,大小不均,膜结构完整,Western blot检测BMSCs外泌体表面标志蛋白CD63、Alix呈阳性表达。本研究中,模型组大鼠脊髓结构紊乱,大量炎性细胞浸润,伴有囊性腔和空泡,神经元和细胞水肿,神经元数量明显减少。经BMSCs外泌体干预后,上述病理变化显著减轻,外泌体组干预后BBB 评分高于模型组。推测外泌体有可能通过BMSCs外泌体抑制A1型神经毒性反应性星形胶质细胞活化发挥对神经元的保护效应,也可能通过抑制胶质瘢痕的形成使轴突和髓鞘的再生,最终使运动功能得以改善[11-12]。
脊髓水肿是SCI的重要病理生理学基础,在AQP1、AQP4、AQP9这3种水通道蛋白中,AQP4对SCI后脊髓水肿影响最大,其次是AQP9[13-14]。相关研究[15]表明,脊髓损伤部位AQP4表达减少后,脊髓灰质后角深层的渗透膨胀率随之下降,脊髓水肿也明显减轻。姚海华等[16]报道,前列腺素E2是cPLA2初始产物,其对炎症反应有促进作用,脑脊髓炎小鼠损伤的间隙中存在前列腺素E2表达,另外cPLA2被激活后细胞膜会代谢生成溶血磷脂并进一步转化为血小板活化因子,激活小胶质或免疫细胞分泌生长因子和黏附分子引起内皮损害,使细胞膜通透性增加,脆性提高,线粒体数量减少,染色质固缩、断裂,最终诱导细胞凋亡[17]。本研究中,模型组细胞凋亡率高于假手术组,而外泌体组细胞凋亡率低于模型组;模型组脊髓组织cPLA2、AQP4、AQP9 mRNA及蛋白表达高于假手术组,而外泌体组脊髓组织cPLA2、AQP4、AQP9 mRNA及蛋白表达低于模型组。提示SCI后,脊髓中细胞大量凋亡,AQP4与AQP9很可能参与了脊髓水肿和炎症反应,BMSCs外泌体注射后,cPLA2、AQP4、AQP9 mRNA及蛋白表达显著下降,细胞凋亡减少。其作用机制可能是静脉注射BMSCs外泌体可快速到达脊髓损伤区,通过M2型巨噬细胞特异性结合促使M2活化并分泌抗炎因子,对损伤区免疫反应产生调节,此过程中Wnt/β-catenin、核因子(NF)-κB等信号通路也被激活,使水肿和细胞凋亡减轻[18-19]。曾欢欢等[20]观察SCI后大鼠脊髓组织水含量发现,术后3 d模型组脊髓组织含水量较假手术组增高,大黄素中、高剂量组脊髓组织含水量低于模型组;模型组AQP4 mRNA较假手术组升高,大黄素低、中、高剂量组AQP4、基质金属蛋白酶(MMP)-2 mRNA均低于模型组。陈勇等[21]证实,与假手术组比较,AQP4、AQP9在SCI组大鼠脊髓组织的表达升高,经β-七叶皂甙钠治疗后,SCI大鼠脊髓组织AQP4、AQP9蛋白表达下降。但BMSCs外泌体能否通过调控cPLA2、AQP4、AQP9表达对中枢神经系统产生保护作用仍需进一步研究证实。
综上所述,BMSCs来源外泌体对脊髓损伤有一定改善作用,可下调cPLA2、AQP4、AQP9 mRNA及蛋白的表达,但其具体作用机制尚需进一步研究。

