长链非编码RNA核富集转录子1对胃癌SGC7901细胞迁移、侵袭、自噬的影响及机制研究
布力布·吉力斯汉,赛福丁·柯尤木,刘春晖,王培红
(新疆医科大学附属肿瘤医院消化内科,新疆 乌鲁木齐 836000)
胃癌的发生与既往胃部手术史、幽门螺杆菌感染、饮酒、基因异常表达、遗传变异、摄入过多腌制食品等因素存在联系,为发病、致死率较高的消化系统恶性肿瘤,早期临床多表现为消化不良、上腹痛等,随病情的发展可诱发恶病质、呕血、上腹部明显疼痛等,进而导致患者多脏器功能衰竭,最终死亡[1-2]。近年来,胃癌预后因治疗技术进步而有所提升,但5年生存率仍旧较低。随着研究深入,发现胃癌发生、发展中抑癌及原癌基因具有关键作用,因此从分子层面阐明胃癌进展机制对患者诊断、治疗、5年生存率的提高具有重要意义[3]。长链非编码RNA(long non-coding RNA,lncRNA)在胃癌细胞凋亡、侵袭、致瘤性、凋亡等过程中均发挥着调控作用,而lncRNA核富集转录子 1(Nuclear enriched abundant transcript 1,NEAT1)被报道在胃癌中呈高表达,且与患者淋巴结转移、临床分期、预后等密切相关[4]。丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)通路包括p38、c-Jun氨基末端激酶(C-jun amino terminal kinase,JNK)、细胞外信号调节激酶(Extracellular signal-regulated kinase,ERK),可参与细胞凋亡、增殖、分化等过程[5]。基于此,本研究分析lncRNA NEAT1通过调控MAPK通路对胃癌细胞迁移、侵袭及自噬的影响,以期为胃癌靶向治疗提供借鉴。
1 材料与方法
1.1 实验细胞 人胃癌SGC7901细胞购自中国科学院细胞库。
1.2 主要试剂 RPMI-1640培养基(批号:20170153)购自武汉益普生物科技有限公司;lncRNA NEAT1沉默载体和上调载体(批号:20200369)购自深圳市豪地华拓生物科技有限公司;PCR试剂盒(批号:20100789)购自上海钰博生物科技有限公司;四唑盐(MTT)试剂盒(批号:20211137)购自深圳子科生物科技有限公司;BCA蛋白定量试剂盒(批号:20160739)购自上海碧云天生物技术公司;GAPDH(批号:ab8241)、上皮性钙黏附素(E-cadherin,批号:ab4679)、基质金属蛋白酶-9(MMP-9,批号:ab6648)、MMP-2(批号:ab3769)、Beclin-1(批号:ab4078)、Ⅱ型/Ⅰ型微管相关蛋白1轻链3(LC3-Ⅱ/LC3-Ⅰ,批号:ab7642)、p38(批号:ab7089)、JNK(批号:ab4012)、ERK抗体(批号:ab8579)均购自(Abcam公司)。
1.3 实验方法
1.3.1 细胞培养及转染:采用RPMI-1640培养液(含10% FBS)培养SGC7901细胞,在6孔板上接种对数期SGC7901细胞,2.5×105个/孔,培养液每3天更换1次,待浓度达到80%时,采用Lipofectamine 2000进行转染,分为沉默组(转染lncRNA NEAT1沉默质粒)、过表达组(转染lncRNA NEAT1上调质粒),转染后12 h内更换培养液,再培养24 h后对SGC7901细胞进行收集备用。
1.3.2 转染效率测定:细胞lncRNA NEAT1表达采用实时荧光定量PCR(RT-qPCR)法检测。采用TRIzol试剂盒对待检细胞RNA进行提取和纯化,后行反转录处理获取总cDNA,采用Primer 5.0软件设计引物序列,启动PCR仪,采用2-ΔΔCt方法计算lncRNA NEAT1表达量。试验重复3次。
1.3.3 细胞迁移、侵袭力检测:细胞转染48 h后,取转染、未转染后的SGC7901细胞接种至6孔板上(2.5×105个/孔)。培养4 h后将培养液弃去,后对各组细胞进行收集,将细胞密度调整至5.0×104个/ml。24孔板中放置Transwell小室,上室放置基质胶,自然晾干后加入细胞悬液(100 μl),下室加培养基500 μl,培养24 h后取出,用4%多聚甲醛固定、结晶紫染色,显微镜下观察,拍照计数。迁移能力检测时采用未铺有基质胶的Transwell小室,其余操作同侵袭检测。
1.3.4 相关蛋白表达量检测:通过Western blot法进行检测。SDS-PDGE电泳于每孔加入80 μg蛋白后进行,电泳结束后将蛋白电转至PVDF膜上,5%脱脂奶粉对PVDF膜进行封闭,E-cadherin、MMP-9、MMP-2、Beclin-1、LC3-Ⅱ/LC3-Ⅰ、p38、JNK、ERK一抗(1∶1000)于摇床上室温孵育,共孵育120 min,完成后采用TBST洗膜3次,5 min/次,后将E-cadherin、MMP-9、MMP-2、Beclin-1、LC3-Ⅱ/LC3-Ⅰ、p38、JNK、ERK二抗(1∶1000)于摇床上室温孵育,共孵育60 min,完成后采用TBST洗膜3次,10 min/次。化学发光显影采用ECL,以GAPDH为内参,相对条带灰度光密度值采用Image J软件分析。
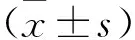
2 结 果
2.1 三组细胞lncRNA NEAT1表达量比较 对照组、过表达组、沉默组lncRNA NEAT1表达量依次为1.17±0.15、1.82±0.17、0.81±0.10。与对照组比较,过表达组lncRNA NEAT1表达量增加,沉默组lncRNA NEAT1表达量下降(均P<0.05)。与过表达组比较,沉默组lncRNA NEAT1表达量下降(P<0.05)。
2.2 三组细胞迁移、侵袭数比较 见表1(图1、2)。与对照组比较,过表达组细胞迁移、侵袭数增加,沉默组细胞迁移、侵袭数下降(均P<0.05)。与过表达组比较,沉默组细胞迁移、侵袭数下降(均P<0.05)。

表1 三组细胞迁移、侵袭数比较(个)
2.3 三组细胞迁移、侵袭相关蛋白表达量比较 见表2。与对照组比较,过表达组E-cadherin蛋白表达量降低,MMP-9、MMP-2蛋白表达量升高;沉默组E-cadherin蛋白表达量升高,MMP-9、MMP-2蛋白表达量降低(均P<0.05)。与过表达组比较,沉默组E-cadherin蛋白表达量升高,MMP-9、MMP-2蛋白表达量降低(均P<0.05)。

表2 三组细胞迁移、侵袭相关蛋白表达量比较
2.4 三组细胞自噬相关蛋白表达量比较 见表3。与对照组比较,过表达组Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达量降低,沉默组Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达量升高(均P<0.05)。与过表达组比较,沉默组Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达量升高(均P<0.05)。

表3 三组细胞自噬相关蛋白表达量比较
2.5 三组细胞MAPK通路相关蛋白表达量比较 见表4。与对照组比较,过表达组p38、JNK蛋白表达量降低,ERK蛋白表达量升高;沉默组p38、JNK蛋白表达量升高,ERK蛋白表达量降低(均P<0.05)。与过表达组比较,沉默组p38、JNK蛋白表达量升高,ERK蛋白表达量降低(均P<0.05)。

表4 三组细胞MAPK通路相关蛋白表达量比较
3 讨 论
胃癌是由多基因、多因素共同诱发的临床常见恶性肿瘤,近年来发病率呈上升趋势,对患者生活质量造成了严重影响[6-7]。胃壁表层黏膜上皮细胞为胃癌起源,可进展到胃的各部位,具有较高的转移及侵袭特性,多数胃癌患者早期症状并不明显,确诊时多为局部晚期或发生远处转移的晚期,错过了最佳治疗时机,远期生存率较低,故对胃癌的发生迁移和侵袭的机制进行探讨对于患者个体化治疗、生存期延长、预后改善具有重要意义[8-10]。
lncRNA为近年来胃癌的研究热点。lncRNA是可在转录及转录后水平上对染色质结构、调节基因表达进行改变的转录物,其表达失调可改变胃癌细胞相关表型,进而参与胃癌的发生、发展[11-12]。lncRNA NEAT1在乳腺癌、甲状腺癌、胃癌、口腔鳞癌等多种肿瘤细胞系及组织中均呈高表达,在胃癌中lncRNA NEAT1与淋巴结转移、临床分期、预后生存等密切相关,可通过激活丝切蛋白2(CFL2)而促进癌细胞增殖,最终发挥促癌作用[13-14]。本研究发现,胃癌细胞经沉默lncRNA NEAT1干预后迁移、侵袭数量减少,自噬增强,表明lncRNA NEAT1可对胃癌细胞迁移、侵袭、自噬进行调控。
胃癌的发生和发展与细胞迁移、侵袭等存在联系。E-cadherin是具有维持组织上皮完整性、细胞间黏附连结的黏附分子家族成员之一,在多种肿瘤中缺失或表达下调,进而破坏了肿瘤细胞间黏附功能,使得原发灶肿瘤细胞脱离并转移,最终对肿瘤发生、发展起到了促进作用[15-16]。肿瘤细胞外基质重塑在肿瘤生长、浸润、转移中发挥着重要作用,而基质金属酶可参与肿瘤细胞外基质重塑,其中MMP-9、MMP-2为Ⅳ型胶原的特异性水平解酶,MMP-9、MMP-2过表达可造成病变组织周围Ⅳ型胶原分解,进而促进胃癌侵袭、转移,且Ⅳ型胶原分解产生的脯氨酸可为胃癌能量代谢提供营养,有利于细胞存活[17-18]。本研究发现,经沉默lncRNA NEAT1干预后胃癌细胞E-cadherin表达量上升,MMP-9、MMP-2表达量下降,提示lncRNA NEAT1可通过调控E-cadherin、MMP-9、MMP-2表达而减弱肿瘤细胞侵袭。
自噬是可参与代谢调节、生物体发育、细胞衰老及凋亡的程序性细胞死亡方式,放射线、化疗药物、内质网应激、放射线等均可激活细胞自噬,在饥饿或应激状态下自噬可通过分解胞质内生物大分子而提供自身生存所需营养,此外自噬可对衰老细胞器及受损结构、细胞内长半衰期蛋白进行清除,自噬水平变化可改变细胞功能,进而对肿瘤发生、发展造成影响,而Beclin-1、LC3为自噬标志物,可以对自噬水平的高低进行反映[19]。Beclin-1为自噬特异性基因,可与/磷酸酰肌醇3-激酶(PI3K)结合形成复合物,进而对胞质中的FYVE基序进行募集,促进自噬体膜形成且可诱导自噬体膜上自噬蛋白定位。细胞中过表达的Beclin-1对自噬具有诱导作用,但在多种恶性肿瘤中Beclin-1均呈缺失状态,导致其对肿瘤细胞凋亡的抑制作用减弱。LC3可参与自噬胞膜延伸及成熟,在自噬成熟中发挥着重要作用,LC3-Ⅱ、LC3-Ⅰ为LC3两种存在形式,新合成的细胞内LC3可经加工成为LC3-Ⅰ,而后者则被加工成为LC3-Ⅱ,LC3-Ⅱ含量随自噬体膜的增加而增加,故LC3-Ⅱ/LC3-Ⅰ可在一定程度上对细胞自噬活性进行反映[20-21]。本研究发现,胃癌细胞经沉默lncRNA NEAT1干预后Beclin-1、LC3-Ⅱ/LC3-Ⅰ上升,提示lncRNA NEAT1可通过调控自噬标志物表达而诱导肿瘤细胞发生自噬。
细胞增殖、凋亡等与肿瘤细胞内信号通路改变存在密切联系,MAPK通路是细胞将信号从细胞膜传递至核内的细胞自噬相关信号通路,家族成员包括p38、JNK、ERK,在细胞增殖、凋亡、自噬、恶性转化中发挥着重要作用[22]。p38、JNK可经病理损伤及细胞应激信号激活,p38激活后可增加TNF-α表达、激活c-Jun而促进肿瘤细胞凋亡,且激活的p38可造成细胞凋亡及细胞周期阻滞;JNK激活后可上调促凋亡蛋白及半胱氨酸蛋白酶3(Caspase-3)表达,而Caspase-3为凋亡效应分子,可加速肿瘤细胞凋亡;ERK经生长因子等促有丝分裂刺激因素激活后可促进肿瘤细胞增殖,抑制凋亡[23]。本研究发现,胃癌细胞经沉默lncRNA NEAT1干预后p38、JNK表达量增加,ERK表达量降低,提示lncRNA NEAT1可抑制胃癌细胞迁移、侵袭,增强自噬,其机制可能与调控MAPK通路有关。
综上所述,抑制lncRNA NEAT1可有效抑制胃癌细胞的迁移、侵袭、自噬,其机制可能与调控MAPK信号通路有关,为临床上靶向治疗胃癌提供新的研究方向。

