积雪草酸对大鼠绝经后骨质疏松症的治疗作用及机制研究
张亮亮,赵程锦,周煜虎,曹 博,段明明,冯阳阳
(延安大学附属医院创伤骨科,陕西 延安 716000)
骨质疏松症(Osteoporosis,OP)是一种常见的骨代谢疾病,与骨量减少、骨质退变、骨微结构变化相关,在一定程度上可增加骨的脆性,降低骨荷载承受力,最终导致患者出现慢性疼痛并增加骨折的风险,严重影响患者日常生活与健康[1]。研究[2]发现我国50岁以上OP女性发病率为29.0%,且呈逐年增长趋势。目前寻找更加有效的防治绝经后OP的药物已成为当务之急。积雪草酸是一种五环三萜酸,为传统中草药积雪草的有效成分,具有抗癌、抗氧化、抗炎、保肝等作用。研究[3]报道积雪草酸可有效抑制OP,但其具体的分子机制仍有待探讨。Hedgehog信号通路在进化过程中高度保守,已有研究[4]指出通过调节Hedgehog信号通路可有效治疗OP。然而积雪草酸能否通过介导Hedgehog信号通路调节绝经后OP尚未可知。故本研究通过SD大鼠实验探讨上述问题,为OP患者新药的研发提供方向。
1 材料与方法
1.1 实验动物 60只2~3月龄雌性SD大鼠,无特定病原体(SPF)级,体重250~270 g,购自武汉大学动物实验中心,分笼饲养。生产许可证号和使用许可证号分别为SCXK(鄂)2019-0004、SYXK(鄂)2019-0013。本研究经医院伦理委员会审批通过(审批号:院准字2019第012号)。
1.2 主要试剂 HE染色试剂盒(批号:G1120-100)购自北京索莱宝科技有限公司;苯甲酸雌二醇(批号:YT0939)购自北京伊塔生物科技有限公司;积雪草酸(批号:J12643)购自上海金穗生物科技有限公司;大鼠骨碱性磷酸酶(BALP)酶联免疫吸附实验(ELISA)试剂盒、Ⅰ型胶原交联氨基端肽(NTX-Ⅰ)ELISA试剂盒(批号:EK-R37372、EK-R36686)购自上海酶研生物科技有限公司;大鼠抗酒石酸酸性磷酸酶(TRAP)ELISA试剂盒(批号:MM-0620R1)购自武汉益普生物科技有限公司;总RNA提取试剂盒(批号:SOS-1207)购自北京凯诗源生物科技有限公司;音猬因子(SHH)、细胞表面跨膜蛋白Patched1(Ptc1)、7次跨膜蛋白(Smo)、Gli家族锌指蛋白-1(Gli1)、矮小相关转录因子2(Runx2)、成骨细胞特异性转录因子(Osx)、骨保护素(OPG)、细胞核因子-κB受体活化因子(RANKL)、磷酸脱氢酶(GAPDH)聚合酶链反应(PCR)引物委托金唯智生物公司合成;总蛋白提取试剂盒(批号:SN-002)购自英文特生物技术(北京)有限公司;核蛋白提取试剂盒(批号:BB-31813)购自上海贝博生物科技公司;二喹啉甲酸(BCA)蛋白定量试剂盒(批号:E112-01)购自南京诺唯赞生物科技股份有限公司;兔抗鼠SHH、Ptc1、Smo、Gli1、Runx2、Osx、OPG、RANKL、GAPDH、组蛋白3(H3)单克隆抗体(一抗,批号:2207S、MA5-24893、ab229258、ab151796、Q13950、ab236465、BS1862、PA5-110268、ab190304、ab1791),羊抗兔SHH、Ptc1、Smo、Gli1、Runx2、Osx、OPG、RANKL、GAPDH、H3辣根过氧化物酶标记多克隆抗体(二抗,批号:31461、A16124、A16116、32460、A27036、A16110、31460、G-21234、A16096、31463)购自无锡云萃生物科技有限公司。
1.3 实验方法
1.3.1 造模及鉴定、分组与给药:①采用一次性手术摘除双侧卵巢造模法[5]构建绝经后OP大鼠模型,将卵巢组织完整切除,两侧卵巢组织摘除后逐层缝合,关闭创口。假手术组仅切除双侧卵巢附近脂肪组织。②常规麻醉处理后,取造模组和假手术组各1只大鼠处死,取右侧股骨,固定后常规脱水,石蜡包埋切片(5 μm);脱蜡脱水后苏木素染色5 min,分化后伊红复染2 min,脱水,透明,封片,光学显微镜下观察,股骨切片出现骨小梁疏松变薄、间隙变宽等情况表明造模成功[6]。③将建模成功大鼠分为模型组(9只)、雌二醇组(10只)、积雪草酸低剂量组(10只)、积雪草酸中剂量组(10只)和积雪草酸高剂量组(10只)。雌二醇组于皮下注射0.02 mg/(kg·d)苯甲酸雌二醇。积雪草酸低、中、高剂量组分别予以50、100、200 mg/(kg·d)积雪草酸灌胃,假手术组(9只)和模型组分别给予等量0.9%氯化钠溶液灌胃,1次/d,持续12周。
1.3.2 各组大鼠骨组织病理改变:给药结束后禁食24 h,常规麻醉后取各组大鼠右后肢股骨近端1/3组织,HE染色操作同1.3.1。
1.3.3 各组大鼠骨密度(BMD)和微结构检测:给药结束后禁食24 h,取各组大鼠右后肢股骨远端1/3行Micro-CT扫描成像。Micro-CT扫描股骨远端1/3后,对其进行三维重建,获取骨小梁三维重建结构图像,并使用Micro-CT自带软件分析骨小梁三维微结构并采集骨小梁空间结构参数,包括骨密度(BMD)、骨体积分数(BV/TV)、结构模式指数(SMI)、骨小梁数目(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)。
1.3.4 各组大鼠血清BALP、NTX-Ⅰ和TRAP水平:给药结束后禁食24 h,取各组大鼠腹主动脉血1.5 ml,3000 r/min离心15 min(离心半径8.8 cm),取上清,按照ELISA试剂盒操作说明检测各组大鼠血清BALP、NTX-Ⅰ和TRAP水平。
1.3.5 各组大鼠骨组织SHH、Ptc1、Smo、Gli1、Runx2、Osx、OPG、RANKL mRNA表达检测:采用实时反转录聚合酶链反应(RT-qPCR)检测。给药结束后禁食24 h,取各组大鼠左后肢1/2股骨,提取骨组织总RNA,反转录合成cDNA后进行RCR反应,引物序列见表1。反应条件:95 ℃ 5 min;94 ℃ 40 s,60 ℃ 40 s,72 ℃ 40 s,30个循环;72 ℃ 5 min。采用2-ΔΔCt法计算待测基因mRNA相对表达水平。
1.3.6 各组大鼠骨组织SHH、Ptc1、Smo、Gli1、Runx2、Osx、OPG、RANKL蛋白表达检测(Western blot):给药结束后禁食24 h,取各组大鼠左后肢剩余1/2股骨,液氮将其粉碎为粉末,加细胞裂解液,4 ℃下12000 r/min离心20 min(有效离心半径8.8 cm),取上清得SHH、Ptc1、Smo、Runx2、Osx、OPG、RANKL总蛋白。同时,根据核蛋白提取试剂盒提取Gli1核蛋白,采用BCA蛋白定量试剂盒检测蛋白浓度,调整终浓度为4 μg/μl。上样5 μl,电泳,转膜后封闭2 h,加一抗(稀释比例1∶500)4 ℃孵育过夜,更换二抗(稀释比例1∶2000)室温孵育2 h,显色,分析待测待测基因蛋白条带灰度值。其中Gli1基因选取H3为内参基因,其余基因选取GAPDH为内参基因。
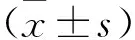
2 结 果
2.1 各组大鼠骨组织病理改变情况 见图1。假手术组大鼠骨小梁网状结构清晰、排列有序,基本结构正常;模型组大鼠骨小梁结构明显异常,骨小梁断裂、不完整、网状结构消失;雌二醇组和积雪草酸低剂量组骨小梁断裂改善;积雪草酸中剂量组骨小梁断裂进一步改善;积雪草酸高剂量组骨小梁结构基本趋于正常。
2.2 各组大鼠骨密度和微结构指标比较 见表2。与假手术组比较,模型组大鼠股骨BMD、BV/TV、Tb.N以及Tb.Th下降,SMI和Tb.Sp上升(均P<0.05)。与模型组比较,雌二醇组和积雪草酸低、中、高剂量组大鼠股骨BMD、BV/TV、Tb.N、Tb.Th上升,SMI和Tb.Sp下降(均P<0.05)。雌二醇组和积雪草酸低剂量组上述指标比较差异无统计学意义(均P>0.05)。积雪草酸低、中、高剂量组上述指标呈剂量依赖性(均P<0.05)。

表2 各组大鼠骨密度和微结构指标比较
2.3 各组大鼠血清BALP、NTX-Ⅰ和TRAP水平比较 见表3。与假手术组比较,模型组大鼠血清BALP水平下降,NTX-Ⅰ和TRAP水平上升(均P<0.05)。与模型组比较,雌二醇组和积雪草酸低、中、高剂量组血清BALP水平上升,NTX-Ⅰ和TRAP水平下降(均P<0.05)。雌二醇组和积雪草酸低剂量组上述指标比较差异无统计学意义(均P>0.05)。上述指标积雪草酸低、中、高剂量组上述指标呈剂量依赖性(均P<0.05)。

表3 各组大鼠血清BALP、NTX-Ⅰ和TRAP水平比较
2.4 各组大鼠骨组织SHH、Ptc1、Smo、Gli1、Runx2、OPG、Osx、RANKL mRNA表达比较 见表4、5。与假手术组比较,模型组大鼠骨组织SHH、Ptc1、Smo、Gli1、Runx2、OPG、Osx mRNA表达下降,RANKL mRNA表达上升(均P<0.05)。与模型组比较,雌二醇组和积雪草酸低、中、高剂量组SHH、Ptc1、Smo、Gli1、Runx2、OPG、Osx mRNA表达上升,RANKL mRNA表达下降(均P<0.05)。雌二醇组和积雪草酸低剂量组上述指标比较差异无统计学意义(均P>0.05)。积雪草酸低、中、高剂量组上述指标呈剂量依赖性(均P<0.05)。

表4 各组大鼠骨组织SHH、Ptc1、Smo、Gli1 mRNA表达比较

表5 各组大鼠骨组织Runx2、Osx、OPG、RANKL mRNA表达比较
2.5 各组大鼠骨组织SHH、Ptc1、Smo、Gli1、Runx2、OPG、Osx、RANKL蛋白表达比较 见表6、7。与假手术组比较,模型组大鼠骨组织SHH、Ptc1、Smo、Gli1、Runx2、OPG、Osx蛋白表达下降,RANKL蛋白表达上升(均P<0.05)。与模型组比较,雌二醇组和积雪草酸低、中、高剂量组SHH、Ptc1、Smo、Gli1、Runx2、OPG、Osx蛋白表达上升,RANKL蛋白表达下降(均P<0.05)。雌二醇组和积雪草酸低剂量组上述指标比较差异无统计学意义(均P>0.05)。积雪草酸低、中、高剂量组上述指标呈剂量依赖性(均P<0.05)。

表6 各组大鼠骨组织SHH、Ptc1、Smo、Gli1蛋白表达比较

表7 各组大鼠骨组织Runx2、Osx、OPG、RANKL蛋白表达比较
3 讨 论
OP与内分泌功能失常、营养缺失、遗传因素及免疫因素密切相关[7]。目前临床上多采用药物治疗并结合生活方式的调整和康复治疗共同进行,必要时进行手术治疗,尽管具有一定疗效,但存在不良反应、治疗周期长、无法治愈等问题,与此同时OP所引发的骨折等并发症严重危害人体健康,给家庭和社会带来沉重的经济负担[8-9],因此急需寻找高效防治OP的药物。
本研究结果显示,建模组大鼠骨组织出现骨髓腔增大、骨小梁断裂等情况,表明本研究成功构建绝经后OP模型。雌二醇可有效抑制OP,故本研究选取其为阳性药物。本研究表明,积雪草酸可改善骨组织病理情况和骨组织微结构,上调骨组织BMD、BV/TV、Tb.N、Tb.Th水平,下调SMI和Tb.Sp水平,上调血清BALP水平,下调NTX-Ⅰ和TRAP水平,发挥抑制绝经后OP的作用。血清BALP反映成骨细胞活性。郭建邦等[10]研究指出OP患者治疗后血清BALP水平升高。血清胶原降解标志物NTX-Ⅰ及破骨细胞分泌的TRAP则反映骨吸收速率。Alrowaili等[11]研究指出,OP大鼠体内NTX-Ⅰ水平上升,而治疗后水平下降,OP得到缓解。Yildirim等[12]研究指出,OP大鼠骨密度降低伴随血液TRAP升高。本研究结果与上述研究结果一致。
本研究结果还表明,积雪草酸可促进SHH、Ptc1、Smo、Gli1、Runx2、Osx、OPG mRNA和蛋白表达,抑制RANKL mRNA和蛋白表达,发挥治疗绝经后OP的作用。Hedgehog信号通路由Hedgehog信号蛋白(如SHH等)、Ptc1与Smo特异性受体、Gli蛋白和下游靶基因组成,当Hedgehog蛋白缺失时,下游的Gli蛋白进入细胞核内抑制下游靶基因转录,而当Hedgehog蛋白表达上升时,Gli与其他分子结合形成大分子复合物进入细胞核内激活下游靶基因的转录[13]。已有研究[14]表明,通过激活Hedgehog信号通路可有效治疗OP。Runx2和Osx在骨形成过程中发挥重要作用。Takebe等[15]研究指出,通过介导Hedgehog信号通路促进Runx2、Osx表达,可促进骨折愈合过程中的骨形成。OPG和RANKL是骨吸收的重要调控因子。宋斌等[16]研究指出,通过调控Hedgehog信号通路促进Runx2、OPG表达,抑制RANKL表达,可明显改善OP中的骨代谢。Deng等[17]研究指出,通过调节Hedgehog信号通路,促进Runx2表达,上调BALP水平,可改善骨组织损伤。Zhang等[18]研究指出,通过激活Hedgehog信号通路抑制RANKL和TRAP表达,可抑制破骨细胞形成和骨丢失。本研究结果与上述研究结果相符。另外,杨帆等[19]研究发现积雪草酸可促进健康人牙周膜细胞成骨分化,证实积雪草酸对骨形成有调控作用;陈晓驷等[20]报道指出积雪草酸可增加OP模型大鼠Runx2蛋白表达,且能够改善其生物力学特性,增加骨小梁面积。本研究结果与上述报道均提示积雪草酸在OP治疗中具有良好的开发与应用价值。
综上所述,积雪草酸可调节绝经后OP骨代谢,可能通过激活Hedgehog信号通路促进Runx2、Osx、OPG表达,抑制RANKL表达,上调BALP水平,下调NTX-Ⅰ和TRAP水平,发挥对绝经后OP的治疗作用,且呈剂量依赖性。但是关于积雪草酸改善OP骨代谢是否存在其他分子机制,积雪草酸是否与Hedgehog通路激活剂的效应等同,以及该成分在OP患者临床治疗中应用的有效性与安全性并不十分明确,且积雪草酸的批量获取及生产是否能实现也是需要考虑的问题,后续均需深入探讨研究。

