吉西他滨联合热疗对胰腺癌ASPC-1细胞增殖、迁移、侵袭和凋亡的影响及机制研究
习 攀,王 蒨,郭俊俊,李 量,李 雅
(1.陕西省肿瘤医院放疗科,陕西 西安 710061;2.陕西省肿瘤医院内二科,陕西 西安 710061)
胰腺癌是具有侵袭性的、恶性程度较高的癌症之一[1]。虽然男女发病率基本一致,但相对于白种人,非裔的发病率较高[2-3]。近10年来,胰腺癌全球发病率有所增加,这可能与肥胖、人口老龄化等因素相关[3-5]。但其病死率基本保持不变,胰腺癌的发病集中在70~80岁人群[6-9]。近20年来,中国胰腺癌发病率提高了近6倍[10]。目前,约80%胰腺癌患者在确诊时已是晚期,其中1/3是局部晚期,而局部晚期胰腺癌患者的中位生存时间约6~10个月。
胰腺癌手术切除率低,术后复发率较高,故化疗在胰腺癌综合治疗中发挥着重要作用。但目前胰腺癌的治疗效果仍欠佳,其中吉西他滨(Gemcitabine,GEM)单药的反应率仅28%左右[11-12]。分子靶向治疗、免疫治疗效果也远低于预期,故需寻找更有效的治疗方法。热疗是近些年出现的一种崭新的癌症治疗技术,基本原理是将物理热量投射到细胞内,从而形成热效应来杀伤肿瘤细胞。热疗不仅对癌症细胞有直接杀伤效果,而且还能强化化疗的敏感性,最终诱发细胞凋亡。前期研究发现,特异性蛋白1(Specific protein 1,Sp1)、细胞周期蛋白D1(Cyclin D1)、环氧合酶-2(Cyclooxygenase-2,COX-2)、B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)等相关基因在癌症细胞凋亡、侵袭及转移过程中发挥重要作用。而热化疗在调节胰腺癌细胞增殖、迁移、侵袭以及诱导凋亡方面是否与Sp1、Cyclin D1、COX-2、Bcl-2等相关还有待验证。因此,本研究探讨GEM联合热疗对胰腺癌ASPC-1细胞增殖、迁移、侵袭和凋亡的影响及可能的机制。
1 材料与方法
1.1 实验细胞与主要试剂 人胰腺癌细胞株ASPC-1购自上海细胞库;RPMI-1640培养基(批号:A1049105)、0.25%胰蛋白酶(批号:25200057)、磷酸盐缓冲液(PBS,批号:1419020)、杜氏磷酸缓冲盐溶液(DPBS,批号:1419014)购自美国Gibco公司;GEM (批号:G552001) 购自法国礼来公司;Sp1抗体(批号:PA5-29165)、Cyclin D1 抗体(批号:MA5-35331)、COX-2抗体 (批号:MA5-27783)、Bcl-2抗体 (批号:PA5-106039)购自Cell Signaling Technology (CST)公司;Transwell小室(批号:C2950)购自BD公司;MTT检测试剂盒(批号:12-6696-42)购自美国Sigma公司;碘化吡啶(PI,批号:PA5-16661)、荧光染料DCFH-DA(批号:C2939)、实时荧光定量PCR(RT-qPCR)试剂盒(批号:C2940)购于自Takara公司。
1.2 实验方法
1.2.1 细胞培养:在含有10%胎牛血清的RPMI-1640培养基中,将ASPC-1细胞悬浮并放置在37 ℃、5% CO2的细胞孵育箱中培养。
1.2.2 细胞分组与处理:将ASPC-1细胞随机分为对照组、GEM组、热化疗组。对照组无任何处理。GEM组将浓度为30 μmol/L GEM溶解在RPMI-1640培养基中处理ASPC-1细胞24 h。热化疗组将ASPC-1细胞置于5%加湿CO2、43 ℃培养箱中孵育1 h后给予30 μmol/L GEM处理24 h。
1.2.3 MTT法检测细胞增殖及活力情况:将ASPC-1细胞悬液接种于96孔板中,各组给予不同处理后在每孔中加入MTT,37 ℃孵育4 h。使用酶标仪在562 nm处检测OD值,并计算细胞活力。
1.2.4 划痕实验检测细胞迁移能力:将ASPC-1细胞以(0.5~1)×106个/孔的密度接种于6孔板中,在无血清培养基中过夜。次日,用枪头在平板中间做划痕后培养48 h,显微镜下每24 h观察迁移的细胞并记录迁移距离。
1.2.5 Transwell实验检测细胞侵袭能力:将ASPC-1细胞接种于Transwell上室(1×105个/孔)中,在Transwell下室中添加500 μl含20%胎牛血清的DMEM。常规条件孵育48 h后,将迁移的细胞固定并用结晶紫染色,显微镜下统计细胞数。
1.2.6 流式细胞仪检测细胞凋亡情况:将ASPC-1细胞接种于10 cm培养皿中,收集细胞前24 h给予GEM,热化疗组给予GEM联合热疗。取上清,清洗保留的细胞,离心后在200 μl结合缓冲液中重悬,然后与10 μl Annexin V-FITC和5 μl PI在4 ℃下反应30 min。加入300 μl缓冲液,在流式细胞仪上检测凋亡细胞。
1.2.7 Western blot检测相关蛋白表达:在培养皿中接种ASPC-1细胞后给予相应处理。将处理后的细胞用PBS洗涤2次,使用RIPA裂解液提取蛋白。用BCA试剂盒定量测定后,在10% SDS-聚丙烯酰胺凝胶上电泳,然后转移到PVDF膜。在室温下用5%脱脂奶粉封闭膜1 h后与抗Sp1、CyclinD1、Bcl-2、COX-2的一抗在4 ℃下反应过夜。用辣根过氧化物酶偶联的IgG二抗在室温下孵育1 h后检测、显影,采用Image-Pro Plus图像分析软件检测条带灰度值,以β-actin为内参,计算相关蛋白表达水平。
1.2.8 RT-qPCR检测mRNA表达:采用1 ml TRIzol裂解缓冲液在三组处理过的胰腺癌细胞中提取总RNA。以2.5 μg总RNA为模板,使用反转录试剂盒合成cDNA,并进行定量PCR扩增。以GAPDH为内参,引物序列见表1。采用2-ΔΔCt法计算靶基因mRNA表达。

表1 各基因引物序列
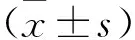
2 结 果
2.1 各组细胞增殖情况及不同热化疗方式细胞活力比较 见图1。MTT结果显示,30 μmol/L GEM对ASPC-1细胞增殖有抑制作用,热化疗组抑制作用更明显(均P<0.05);30 μmol/L GEM联合不同的热疗方式(化疗前24 h给予43 ℃热疗1 h、化疗同时热疗、化疗后24 h给予43 ℃热疗1 h)的细胞活力分别为(50.45±3.77)%、(61.0±2.34)%、(71.74±2.14)%,GEM前热疗对细胞抑制作用更明显(均P<0.05)。
注:与GEM前热疗比较,*P<0.05
2.2 各组细胞迁移及侵袭能力比较 见图2、3。划痕实验结果显示,与对照组比较,GEM组、热化疗组细胞迁移能力降低,且热化疗组细胞迁移能力降低更加明显(均P<0.05)。Transwell实验结果显示,GEM组和热化疗组细胞侵袭能力较对照组降低,且热化疗组更明显(均P<0.05)。

注:左图为各组细胞划痕实验结果(×100)。右图中,与对照组比较,*P<0.05;与GEM组比较,#P<0.05
2.3 各组细胞凋亡情况比较 见图4。对照组、GEM组及热化疗组ASPC-1细胞凋亡率分别为(2.15±0.11)%、(4.12±0.20)%、(11.48±1.62)%。与对照组比较,GEM组和热化疗组细胞凋亡率升高,且热化疗组高于GEM组(均P<0.05)。
2.4 各组细胞Sp1、Cyclin D1、COX-2和Bcl-2蛋白表达比较 见图5。与对照组比较,GEM组细胞Sp1、COX-2、Bcl-2蛋白水平降低(均P<0.05)。与GEM组比较,热化疗组Sp1、COX-2蛋白水平降低(均P<0.05)。
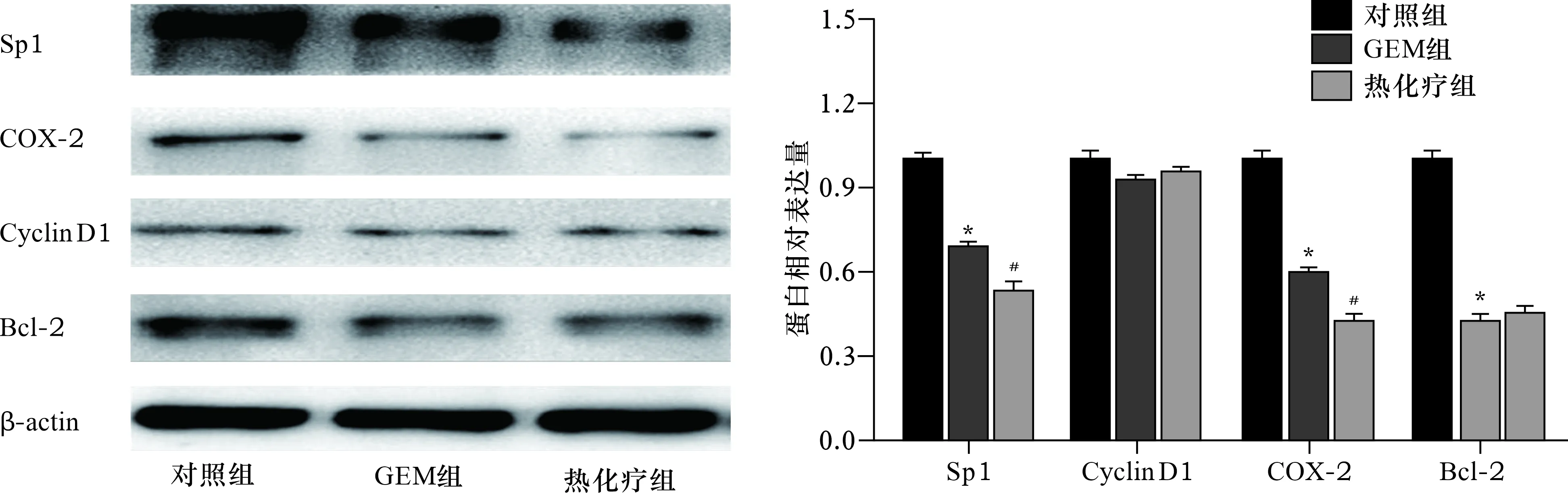
注:左图为各蛋白电泳图。右图中,与对照组比较,*P<0.05;与GEM组比较,#P<0.05
2.5 各组细胞Sp1、Cyclin D1、COX-2和Bcl-2 mRNA表达比较 见图6。与对照组比较,GEM组细胞Sp1、COX-2 mRNA表达降低(均P<0.05)。与GEM组比较,热化疗组Sp1、COX-2 mRNA表达降低(均P<0.05)。
3 讨 论
热疗已在临床实践中用于各种肿瘤的治疗,其抗肿瘤的有效性已在早期研究中得到了验证[13-17]。随机Ⅱ期和Ⅲ期临床试验证实了热疗治疗乳腺癌、胰腺癌、宫颈癌、肺癌、头颈部肿瘤、黑色素瘤以及胃肠道癌症和肉瘤的效果[18-22]。此外,热化疗联合治疗已成为许多Ⅱ期和Ⅲ期临床试验的主题。例如,在临床试验中采用的热疗联合顺铂、紫杉醇治疗晚期卵巢癌的方案取得了较好的效果[23]。热疗通过降低细胞内pH值增加细胞膜的渗透性,从而提高了化疗药物的穿透与吸收能力。热疗对于化疗也有增敏效果,主要源于热疗可以促进化疗药物诱导的细胞凋亡。化疗耐药的部分原因是由热休克蛋白诱发的,而热疗则通过抑制部分热休克蛋白的产生,从而防止化疗耐药的形成,这些在丝裂霉素、博来霉素、顺铂等药物中得以证明[24-26]。但关于热化疗诱导癌症细胞凋亡的机制目前仍不清楚。
有研究[27]证实,热疗可以抑制癌症细胞的迁徙、转移,胃癌细胞经42.5 ℃处理1 h后,细胞表面的分子发生变化,E-钙黏素、B-整合素、黏附分子表达增多。研究[28-31]发现,经高温(40~45 ℃,1~2 h)处理后的肿瘤细胞可表现为对化疗药物的敏感性显著增加。通过局部热疗(42 ℃,30 min)联合化疗治疗的胰腺癌患者,平均生存期超过单纯化疗的患者[32]。研究[33]发现,热疗通过降低膀胱癌细胞P糖蛋白、多药耐药相关蛋白1等蛋白的表达来逆转耐药,从而实现对化疗的增敏。Sp1在肉瘤、结肠癌和胰腺癌中均有表达,研究表明Sp1在胰腺癌细胞中高表达且可作为胰腺癌患者生存预后的负性指标。在ⅡB期-Ⅳ期胰腺癌患者中,Sp1过表达与淋巴结转移和较晚的癌症分期有关,Sp1阳性患者的总生存期大幅缩短。作为转录因子,Sp1与多种蛋白(Cyclin D1、Bcl-2、COX-2)表达相关,这些蛋白同肿瘤增殖、侵袭、凋亡相关[34]。肿瘤细胞中Bcl-2过表达往往通过Sp1转录因子发挥作用。在胰腺癌细胞中,Sp1表达与COX-2表达呈正相关,抑制或过表达Sp1可导致COX-2的表达降低或升高[35]。
本研究发现,GEM联合热疗对胰腺癌ASPC-1细胞增殖抑制作用较为明显。GEM联合热疗能显著抑制ASPC-1细胞的迁移、侵袭并进一步诱导凋亡。为进一步研究热化疗对ASPC-1胰腺癌细胞增殖、迁移、侵袭抑制并诱导凋亡可能的机制,本研究测定了细胞内Sp1、Cyclin D1、Bcl-2和COX-2蛋白的表达,结果显示与对照组比较,GEM组细胞Sp1、COX-2、Bcl-2蛋白水平降低;与GEM组比较,热化疗组Sp1、COX-2蛋白水平降低,并在mRNA层面上进行了验证。
综上所述,GEM联合热疗可抑制胰腺癌ASPC-1细胞增殖、迁移和侵袭,并诱导凋亡,其机制可能与抑制Sp1及其下游基因COX-2有关。

