JS-K对口腔鳞状细胞癌H157和CAL-27细胞增殖与凋亡的影响及机制实验研究
高晨峰,刘 斌,陈小凤,廖卫国,黄小杰,杨 腾,于立明,兰 青
(1.广东医科大学附属医院肝胆外科,广东 湛江 524001;2.广东医科大学附属医院临床医学研究中心,广东 湛江 524001;3.广东医科大学附属医院口腔科,广东 湛江 524001)
口腔鳞状细胞癌(Oral squamous cell carcinoma,OSCC)是世界范围内导致死亡的常见癌症之一,以分化和选择性淋巴结转移为特征[1-2]。由于风险因素暴露、高病死率和低治愈率,OSCC被公认为是一个全球公共卫生问题,给个人和社会带来巨大的经济负担[3-4]。因此,研究潜在抗肿瘤药物的分子机制可能有助于探索和开发有效的抗OSCC治疗策略。
细胞凋亡是程序性细胞死亡的主要类型,通过一系列生化事件最终导致细胞死亡[5]。凋亡可通过外源性死亡受体相关途径和(或)内源性细胞器修饰途径诱导。线粒体凋亡途径受B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白家族调控,如抗凋亡Bcl-2蛋白和促凋亡蛋白Bak和Bax。半胱氨酸蛋白酶(Caspase)在细胞凋亡调控中起关键作用,可分为启动子Caspase (Caspase-8/9)和执行子Caspases (Caspase-3/6/7)[6-7]。细胞周期依次经历G1、S、G2和M四个阶段。细胞周期阻滞与肿瘤细胞的增殖密切相关,这一现象被认为是药物化学预防或抗肿瘤活性的标志。据报道,G2/M检查点是肿瘤治疗的重要靶点,而细胞周期由细胞周期调节蛋白介导,如细胞周期蛋白、细胞周期蛋白依赖激酶(Cyclin-dependent kinase,CDK)、p21、p18和p27[8]。此外,细胞周期由激酶家族的各种保守蛋白调节。例如,丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)与细胞周期、细胞增殖和凋亡的调控有关。这些激酶的一个主要亚群p38 MAPK是各种抗癌药物引发肿瘤细胞凋亡所必需的[9-10]。因此,p38 MAPK可能被用于开发一种新的治疗策略,通过激活凋亡和细胞周期进程抑制通路来对抗OSCC。
活性氧(Reactive oxygen species,ROS)是细胞内氧的天然代谢产物,在激活细胞内信号转导通路和维持细胞稳态方面发挥重要作用。ROS还可调控肿瘤中的多种事件,如细胞增殖、细胞周期进展、分化、免疫反应、凋亡和迁移[11]。ROS水平升高已被证实是许多化疗药物特殊事件的潜在机制[12-13]。而一氧化氮(Nitric oxide,NO)作为一种重要的信号分子,在肿瘤生物学中起着关键作用,如细胞迁移、肿瘤生长、肿瘤侵袭和血管生成控制。NO前体化合物JS-K可通过增加ROS水平对各种类型的癌症(如非小细胞肺癌、前列腺癌和膀胱癌)发挥抗肿瘤作用。已有研究[12]报道,JS-K对肿瘤细胞具有选择性细胞毒性,但对正常细胞未见明显毒性。虽然这些研究表明JS-K可能作为一种潜在的抗癌化疗药物,但其对OSCC的影响尚未被彻底研究。因此,在本研究中,我们旨在探讨JS-K在OSCC细胞中的抗肿瘤作用及其潜在机制。
1 材料与方法
1.1 实验细胞 OSCC细胞株H157、SCC4和CAL-27购自上海桐派生物科技有限公司。所有细胞在RPMI 1640培养基中培养,其中包含10%胎牛血清和1%青霉素/链霉素(100 U/ml青霉素和100 μg/ml链霉素)。细胞置于37 ℃、含有5% CO2饱和湿度培养箱中培养。当细胞达到对数生长阶段时,用于实验。
1.2 主要试剂 JS-K(货号:J4137)购自Sigma-Aldrich[使用二甲基亚砜(DMSO)制备的JS-K(20 mmol/L)原液,-20 ℃保存,实验前使用RPMI 1640培养基进一步稀释原液];细胞ROS/活性氮(RNS)检测试剂盒(货号:ab139473) 购自Abcam[试剂盒包括ROS抑制剂N-乙酰半胱氨酸(NAC)和氧化应激检测试剂(绿色)];p38 MAPK抑制剂SB202190和SB203580(SB)购自Med Chem Express;GAPDH抗体(货号:2218)、p21抗体(货号:2947)、p18抗体(货号:2896)、cyclin B1抗体(货号:4138)、cyclin D1抗体(货号:2978)、cyclin D3抗体(货号:2936)、CDK2抗体(货号:2546)、CDK4抗体(货号:12790)、多聚ADP核糖聚合酶(PARP)抗体(货号:9542)、Bcl-2抗体 (货号:2876)、Bax抗体 (货号:2772)、细胞色素C(Cyt C)抗体(货号:4272)、p38抗体 (货号:9212)、p-p38抗体 (货号:4511)和Cdc2抗体 (货号:9112)均购自Cell Signaling Technology;细胞周期分析试剂盒(货号:C1052) 购自碧云天生物技术公司。
1.3 实验方法
1.3.1 细胞活力测定:采用MTT实验评价JS-K对OSCC的生长抑制作用。将H157、SCC-4和CAL-27细胞以每孔7 × 103个的初始密度种于含有0.1 ml培养基的96孔板上,孵育过夜。待细胞贴壁后,按梯度给药的方式(0、0.5、1、2.5、5、10、20 μmol/L)处理细胞,每个浓度设置6个复孔,培养24 h或48 h。随后,每孔中加入20 μl MTT (5 mg/ml),孵育4 h。去除上清液,加入100 μl DMSO溶解甲臜结晶。使用Multiskan MK3微孔板阅读器测量492 nm波长处吸光度值。统计结果将每个浓度的吸光度与对照组对比并归一化(对照,100%)。
1.3.2 Western blot分析:按指定方法处理后,用PBS清洗细胞2次,并在含有PMSF的RIPA裂解液中裂解。蛋白质(每组30 μg)在10%聚丙烯酰胺凝胶上分离,转移到聚偏氟乙烯膜上。用5%脱脂牛奶在TRIS缓冲盐和1%吐温于室温下1 h以阻断膜的非特异性结合。然后,膜使用p21、GAPDH、p18、cyclin B、cyclin D1、cyclin D3、CDK2、CDK4、PARP、Bcl-2、Bax、Cyt C、p38、p-p38和Cdc2等一抗(1∶1000)在4 ℃孵育过夜,洗涤3次后使用二抗(1∶2000)在4 ℃孵育4 h。最后,在清洗膜3次后,使用Tanon 5200仪器进行检测。
1.3.3 细胞凋亡检测:使用膜联蛋白V-荧光素异硫氰酸酯(Annexin V-FITC)细胞凋亡检测试剂盒进行细胞凋亡评估。细胞以3×105个/孔的初始密度种于6孔板上,并使用适量(0、1.25、2.5、5 μmol/L)JS-K处理24 h。将每组细胞1×105个重悬于100 μl Annexin V-FITC结合缓冲液中,加入5 μl Annexin V-FITC和5 μl碘化丙啶(PI),黑暗孵育15 min。加入400 μl 1×结合缓冲液,停止染色反应。采用流式细胞仪检测样品,并使用系统软件进行数据分析。
1.3.4 细胞周期检测:使用细胞周期分析试剂盒进行。将2.5×106个细胞种于6孔板上,用对应方式(0、1.25、2.5、5 μmol/L,加或不加2.5 μmol/L JS-K,加或不加15 μmol/L SB、2.5 μmol/L JS-K、400 μmol/L NAC)处理24 h。收集细胞,用70%乙醇在4 ℃下固定过夜。将细胞重悬于PBS中,加入25 μl PI,在37 ℃黑暗条件下混合30 min。最后,使用BD FACSCantoTM Ⅱ流式细胞仪检测样品,并使用系统软件分析数据。
1.3.5 亚细胞分离:用对应方式(0、1.25、2.5、5 μmol/L,加或不加2.5 μmol/L JS-K,加或不加15 μmol/L SB、2.5 μmol/L JS-K、400 μmol/L NAC)处理24 h后收集细胞。细胞在1 ml含有线粒体分离试剂中溶解15 min,然后对细胞悬液进行匀浆。4 ℃条件下以600 g离心10 min后取上清,再以11000 g离心10 min。弃上清,将颗粒重悬在线粒体提取缓冲液中。
1.3.6 Caspase-3/7活性测定:H157和CAL-27细胞用对应方式(0、1.25、2.5、5 μmol/L,加或不加2.5 μmol/L JS-K,加或不加15 μmol/L SB、2.5 μmol/L JSK、400 μmol/L NAC)处理24 h后,收集贴壁与漂浮的细胞。然后,将每组约6×104个细胞以100 μl PBS转移到1.5 ml试管中。每管中加入100 μl Caspase-Glo试剂,在室温下黑暗孵育1 h。样品的发光值使用Sirius L管发光计进行检测。统计结果将每个浓度(用0、1.25、2.5、5 μmol/L)发光值与对照组对比并归一化(对照,100%)。
1.3.7 ROS检测:H157细胞和CAL-27细胞(2.5×106个)分别在6孔板上孵育过夜。然后,用JS-K(0、1.25、2.5、5 μmol/L)培养细胞24 h。处理完成后,PBS洗涤并收集细胞,200 g离心3 min。随后,用1∶2500的氧化应激检测试剂(绿色)培养细胞,转移到96孔板上,37 ℃培养60 min。最后,使用多功能酶标仪在488 nm激发波长和520 nm发射波长下测量荧光。统计结果将每个浓度的发光值与对照组对比并归一化(对照,100%)。
1.3.8 平板克隆实验:将H157细胞和CAL-27细胞(2.5×106个)分别种于6孔板上,分别用0、1.25、2.5、5 μmol/L JS-K处理,加或不加2.5 μmol/L JS-K和加或不加15 μmol/L SB、2.5 μmol/L JS-K、400 μmol/L NAC,孵育24 h后收集每组细胞并进行量化。每组大约400个H157细胞和600个CAL-27细胞种于含有无药物培养基的6孔板上进行集落形成试验。每隔3 d更换1次培养基。培养7 d后,菌落在4%多聚甲醛中固定15 min,PBS洗涤2次,0.5%结晶紫溶液染色10 min,超纯水洗涤3次,用相机拍摄。
1.4 统计学方法 使用Graph Pad Prism 5和SPSS 19.0统计学软件进行数据分析,多组间比较采用方差分析,组间两两比较采用SNK-q检验,检验水准α=0.05。
2 结 果
2.1 JS-K对OSCC细胞增殖的影响 见图1~3。MTT实验结果表明,JS-K以浓度依赖方式降低细胞活力,H157和CAL-27细胞对JS-K处理表现出更高的敏感性。同时,JS-K处理组观察到不同程度的细胞凋亡。为了证实JS-K对H157和CAL-27细胞的增殖有抑制作用,进行了平板克隆实验,结果显示JS-K处理后H157和CAL-27细胞菌落数量较对照组减少。

注:与JS-K 0 μmol/L比较,*P<0.05

图2 JS-K干预后H157、CAL-27细胞凋亡情况(Annexin V/PI染色,×200)
2.2 JS-K对OSCC细胞凋亡的影响 见图4~6。流式细胞仪检测结果显示,JS-K对H157和CAL-27细胞均有凋亡诱导作用。Western blot结果显示,JS-K上调促凋亡蛋白Cleaved-PARP、Bax、Cyt C和Cleave-caspase 9表达,而下调抗凋亡蛋白Bcl-2表达;此外,线粒体中Cyt C表达下调。同时,JS-K还可促进Caspases-3/7活性,而两者与细胞凋亡密切相关。

图4 JS-K干预后H157、CAL-27细胞凋亡流式细胞仪检测结果

图5 JS-K干预后H157、CAL-27细胞凋亡相关蛋白Western blot结果

注:与JS-K 0 μmol/L比较,*P<0.05
2.3 JS-K对OSCC细胞周期的影响 图7~9。流式细胞仪检测结果显示,JS-K在H157和CAL-27细胞的G2/M期诱导细胞周期停滞。Western blot检测结果显示,在H157和CAL-27细胞中,JS-K可上调p21、p18、CDK2、cyclin B1、cyclin D1、cyclin D3和cyclin E1表达,下调Cdc2和CDK4表达。

图7 JS-K干预后H157、CAL-27细胞周期检测结果

注:与JS-K 0 μmol/L比较,*P<0.05

图9 JS-K干预后细胞周期相关蛋白和p38 MAPK信号通路蛋白Western blot结果
2.4 JS-K通过调控p38 MAPK信号通路诱导细胞凋亡 见图10~13。JS-K和SB联合使用降低了细胞凋亡水平,增加了细胞集落形成。Western blot结果显示SB可逆转JS-K下调H157和CAL-27细胞Bcl-2,上调Bax、Cyt C、Cleaved-PARP和Cleaved-caspase 9的作用。同时,Caspase-3/7活性水平下调。

图10 JS-K和(或)SB干预后H157、CAL-27细胞凋亡情况(Annexin V/PI染色,×200)

图11 JS-K和(或)SB干预后H157、CAL-27细胞平板克隆实验结果(结晶紫染色)

图12 JS-K和(或)SB干预后H157、CAL-27细胞凋亡相关蛋白Western blot结果

注:与JS-K 2.5 μmol/L比较,*P<0.05
2.5 JS-K通过调控p38 MAPK信号通路诱导细胞周期阻滞 见图14~16。细胞周期分布图谱显示,使用JS-KH157、CAL-27细胞系似乎都被阻滞在细胞周期的G2/M期,而使用p38 MAPK抑制剂SB202190和SB202580可缓解这种情况。使用SB202580后,Western blot分析结果与细胞周期评价结果一致。SB202580逆转了JS-K诱导的细胞周期蛋白表达的激活,包括p18、p21、cyclin D1、cyclin D3、cyclin B1、CDK2和CDK4。

图14 JS-K和(或)SB干预后H157、CAL-27细胞周期检测结果

注:与JS-K 2.5 μmol/L比较,*P<0.05
2.6 JS-K通过调控ROS触发p38 MAPK通路诱导细胞周期阻滞 见图17~21。JS-K增加了H157和CAL-27细胞的ROS活性。经JS-K处理的细胞形态分析显示细胞凋亡水平较高,而经JS-K和NAC处理的细胞凋亡水平较低。与单纯的JS-K处理(2.5 μmol/L)比较,ROS抑制剂NAC (400 μmol/L)在JS-K处理前预孵育H157和CAL-27细胞1 h后,p-p38表达减少。这些结果有力地表明,JS-K诱导的ROS导致OSCC细胞中p38 MAPK通路激活。此外,流式细胞术分析显示,NAC明显逆转了H157和CAL-27细胞中JS-K诱导的G2/M期细胞周期阻滞。
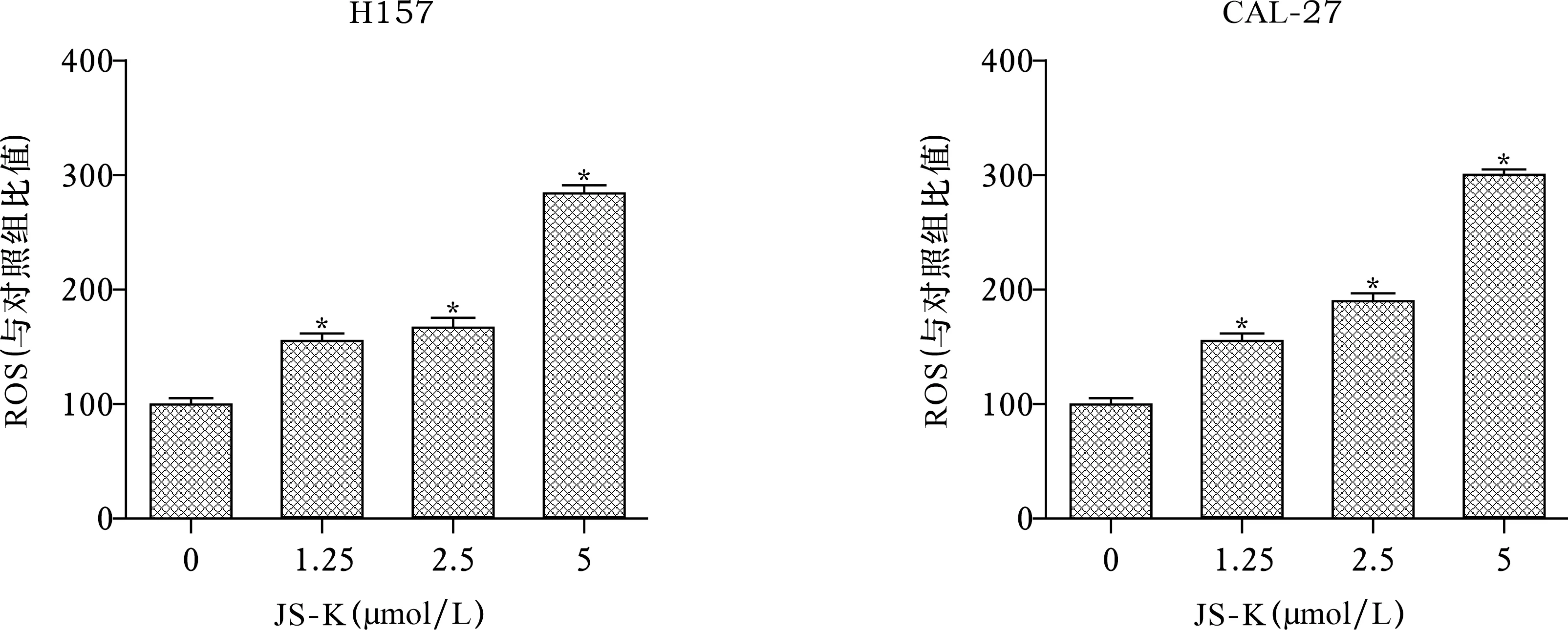
注:与JS-K 0 μmol/L比较,*P<0.05
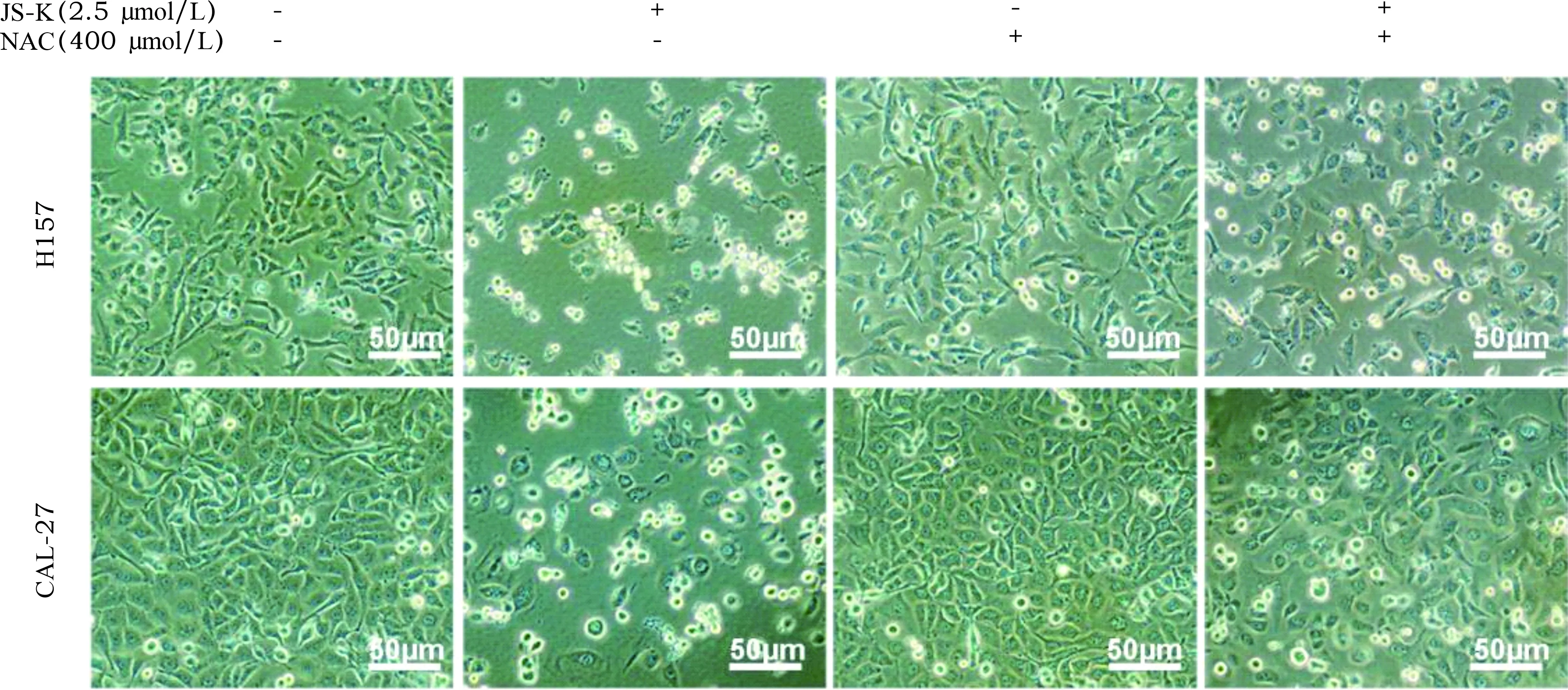
图18 JS-K和(或)NAC干预后H157、CAL-27细胞凋亡情况(Annexin V/PI染色,×200)
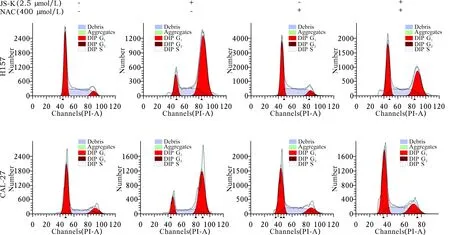
图20 JS-K和(或)NAC干预后H157、CAL-27细胞周期检测结果

注:与JS-K 2.5 μmol/L比较,*P<0.05
3 讨 论
JS-K是目前正在开发的一种很有前景的抗癌药物,可以抑制癌细胞增殖,对各种类型的肿瘤细胞有选择性的细胞毒作用。
研究[14]表明,JS-K可通过激活ROS在多种癌症类型中诱导细胞周期阻滞和凋亡。然而JS-K对OSCC的抗癌作用尚未见报道[15-17]。在本研究中,MTT和平板克隆实验结果显示,JS-K对H157和CAL-27细胞具有抗增殖作用,说明JS-K对OSCC细胞具有一定程度的细胞毒作用。Annexin V/PI染色结果证实,JS-K以浓度依赖性方式诱导H157和CAL-27细胞凋亡,提示JS-K可诱导细胞凋亡。细胞凋亡作为一种生理途径,在清除受损或感染细胞以维持组织稳态方面起着关键作用。
为进一步研究JS-K诱导H157和CAL-27细胞凋亡的机制,我们评估了常见的凋亡调节因子。Bcl-2家族蛋白不仅在线粒体水平诱导细胞凋亡,而且在非线粒体位点也有作用。此外,Bcl-2可以通过调节线粒体动力学和代谢在未死亡的细胞中发挥生理作用。Bcl-2水平的降低与凋亡刺激引发的细胞死亡有关。与Bcl-2单独表达水平相比,Bcl-2/Bax与细胞凋亡诱导的关系更为密切[6,18]。在本研究中,JS-K可通过下调Bcl-2和上调Bax(即降低Bcl-2/Bax比值)诱导H157和CAL-27细胞凋亡。Caspase-3作为一种刽子手Caspase,可被死亡配体和线粒体功能障碍诱导激活[19]。PARP与DNA复制和转录有关,而效应子Caspases(Caspases-3/7/9)可调控并裂解PARP,导致细胞收缩和DNA断裂,最终刺激细胞死亡信号[20]。
在本研究中,我们观察到在JS-K处理H157和CAL-27细胞24 h后,Caspase-3/7/9激活和p-PARP上调,而用SB(15 μmol/L)预处理后,Caspases-3/7/9下调,p-PARP活性被抑制。这些结果表明,JS-K可通过线粒体介导的凋亡途径选择性诱导H157和CAL-27细胞凋亡。
研究表明,细胞周期进程可以控制细胞增殖,细胞周期的每个阶段都包括可以启动修复机制的检查点,而肿瘤细胞更依赖于G2检查点来抵御DNA损伤。细胞周期进程与CDKs相关。其中,Cdc2也被称为CDK-1,控制哺乳动物细胞的G2/M转变,cyclin蛋白可以通过与CDKs形成复合物激活。Cdc2-cyclin B复合物调节G2/M期的细胞周期进程[21]。DNA合成由CDK4/6-cyclin D复合物控制。此外,G1/S和S/G2转变由CDK2-cyclin E/A复合物介导。p21、p27和p18是CDK抑制剂,它们可以调节细胞周期及DNA复制和修复[8]。在使用JS-K处理H157和CAL-27细胞24 h后,CDK2蛋白表达下降,p18和p21蛋白表达上升,提示JS-K在H157和CAL-27细胞中诱导细胞周期停滞在了G2/M期。
p38 MAPK是MAPK家族成员,在细胞应激反应中起关键作用,与细胞凋亡相关[22]。作为DNA损伤信号通路的重要组成部分,p38 MAPK通路的作用在过去十年中得到了重视。细胞周期检查点G2/M和较小程度的G1/S是由p38 MAPK激活介导的[23]。p38 MAPK通路可被多种化疗药物激活,并与癌细胞凋亡相关[24]。p38磷酸化程度是决定细胞死亡和存活的重要因素。此外,p38的过度激活会导致细胞损伤[25]。本研究表明,JS-K处理提高了p-p38的水平,而在JS-K处理组中p38蛋白的表达没有明显变化。此外,p38 MAPK信号的抑制中断了JS-K诱导的H157和CAL-27细胞凋亡和细胞周期阻滞。以上表明,JS-K通过调节p38 MAPK通路诱导细胞凋亡和细胞周期阻滞。
ROS的生成在正常生理条件下受到严格的调控。ROS同时参与复杂的信号网络。然而,过多的ROS产生会导致细胞损伤。癌细胞通常会产生和维持比正常细胞更高水平的ROS。一旦细胞内ROS水平升高,癌细胞对正常细胞更加敏感。因此,提高ROS水平是一种潜在的治疗癌症的策略[26]。本研究揭示了JS-K诱导OSCC细胞产生ROS。此外,高水平的细胞内ROS可能是OSCC细胞诱导凋亡的主要机制之一,因为ROS清除剂NAC对细胞的预处理显著逆转了细胞凋亡诱导的变化。众所周知,过多的ROS生成可以激活p38 MAPK通路。为了研究p38 MAPK通路是否与JS-K诱导的凋亡有关,我们评估了H157和CAL-27细胞中关键p38 MAPK通路蛋白的表达。JS-K处理显著激活了两种细胞系的p38 MAPK通路。此外,我们发现NAC预处理显著逆转了JS-K诱导的H157和CAL-27细胞中p-p38的上调。这些结果表明,在H157和CAL-27细胞中,细胞内ROS积累导致p38 MAPK信号通路激活。
综上所述,JS-K通过p38 MAPK信号通路调控ROS,诱导OSCC细胞周期阻滞在G2/M期并凋亡,最终抑制OSCC细胞增殖。JS-K可能为一种治疗OSCC的潜在药物。

