O-GlcNAc转移酶介导的Kruppel样因子5 O-GlcNAc糖基化修饰调控细胞周期素D1参与结直肠癌发生、发展实验研究
彭明沙,黎 爽,周 翼,黄世贵,舒子龙,彭 洪
(川北医学院附属南充市中心医院,四川 南充637000)
结直肠癌(Colorectal cancer,CRC)是消化系统常见恶性肿瘤之一[1]。CRC的标准化治疗方案包括手术切除、化疗和放疗,虽然CRC患者总发病率和病死率正在下降,然而其5年生存率依然低于预期,因为部分患者确诊时已经发生远处转移[2]。因此揭示CRC发生、发展背后的潜在作用机制,寻找新的诊断和预后生物标志物及治疗靶点,就显得尤为重要。Kruppel样因子5(Kruppel-like factor 5,KLF5)是一种含有三个锌指DNA结合结构域的转录因子,广泛表达于各种组织,在肿瘤细胞增殖、凋亡、细胞周期调节、迁移、分化和血管生成方面发挥着重要作用[3-4]。既往研究[5-6]发现,KLF5在CRC中高表达,可促进CRC细胞的增殖并与结直肠癌化疗耐药密切相关。然而KLF5在CRC中发挥促癌作用的具体机制尚不明确。糖基化修饰是重要的蛋白质翻译后修饰之一,影响蛋白质的功能并调控细胞信号传导,从而调节各种生物学效应[7]。氧连接N-乙酰葡萄糖胺(O-linked N-acetylglucosamine,O-GlcNAc)糖基化修饰具体表现为仅在蛋白质的丝氨酸/苏氨酸残基上加成一个单糖,这种蛋白加工方式能快速、可逆地添加及移除,并与磷酸化修饰竞争性修饰,迅速调节蛋白质的活性和稳定性。O-GlcNAc糖基化修饰几乎参与了各种细胞代谢途径和信号转导通路,在肿瘤和糖尿病等多种疾病中起着非常重要的调节作用[8-9]。但是O-GlcNAc糖基化修饰与CRC发生发展的关系却报道较少。本研究探讨KLF5通过正调控细胞周期素D1(Cyclin D1,CCDN1)促进CRC细胞增殖和细胞进入G1期,以及OGT通过O-GlcNAc糖基化修饰稳定KLF5并上调CCND1表达参与CRC发生、发展的作用机制,以期为CRC的治疗提供新的作用靶点。
1 材料与方法
1.1 实验细胞 FHC(批号:BFN607201253)、SW620(批号:TCHu101)、SW480(批号:TCHu172)和DLD-1(批号:TCHu134)细胞株购自中国科学院细胞库。FHC和DLD-1在含有10% FBS的1640培养基中培养。SW620和SW480在Leibovitz’s L-15培养基中培养。培养箱温度为37 ℃,并含有5% CO2。
1.2 主要试剂 1640培养基和L-15培养基(批号:61870036、MD06)购自Gibco公司;Lipofectamine 3000(批号:L3000-001)购自Invitrogen公司;CCK8试剂(批号:CK04)购自Dojindo公司;RNAprep试剂盒(批号:DP441)购自Tiangen公司;HiScript Ⅲ RT Super Mix(批号:R333-01)购自Vazyme公司;SYBR Green(批号:Q111-02)购自Vazyme公司;蛋白酶抑制剂 Cocktail(批号:HY-K0010)购自MCE公司;KLF5抗体(批号:ab137676)购自Abcam公司;山羊抗兔IgG(批号:ab150077)购自Abcam公司;O-GlcNAc一抗(批号:MAB16475)购自Abnova公司。
1.3 生物信息学分析 通过GEPIA2数据库(http://gepia2.cancer-pku.cn/#index)分析CRC组织中KLF5表达,通过UALCAN portal数据库(http://ualcan.path.uab.edu/analysis-prot.html)分析CRC组织中OGT表达,并通过UALCAN分析CRC组织中OGT和KLF5蛋白的表达水平。使用GEPIA2数据库分析OGT与KLF5以及KLF5与CCND1表达的相关性。通过TRRUST数据库(https://www.grnpedia.org/trrust/)分析KLF5可能的靶基因,进一步通过JASPAR网站查询CCND1启动子区与转录因子KLF5可能的结合位点。通过YinOYang-1.2(https://services.healthtech.dtu.dk/service.php?YinOYang-1.2)和GlyGen 数据库(https://www.glygen.org/)分析KLF5蛋白上可能的O-GlcNAc糖基化位点。
1.4 实验方法
1.4.1 细胞培养与转染:由Gene Pharma(中国上海)合成并构建KLF5 siRNA,CCND1过表达载体(OE-CCND1)和KLF5过表达载体(OE-KLF5),用Lipofectamine 3000将其转染到CRC细胞中。KLF5 siRNA序列为5’-GCAGAGAUGCUCCAGAAUUTT-3’。
1.4.2 CCK-8实验:将处理好的细胞以3×103个/孔的密度接种于96孔板。在24、48、72 h加入CCK-8溶液(10 μl/孔),孵育2 h后在450 nm处测量每个孔的吸光度。分析KLF5对SW620细胞增殖的影响时分为阴性对照组、空白对照组(不进行处理)和KLF5 siRNA组(转染KLF5 siRNA);分析过表达CCND1对SW620细胞增殖的影响时分为阴性对照组、空白对照组(不进行处理)、KLF5 siRNA组(转染KLF5 siRNA)和KLF5 siRNA+CCND1过表达组(同时转染KLF5 siRNA和OE-CCND1)。
1.4.3 实时荧光定量 PCR (RT-qPCR) 实验:收集处理好的细胞,使用RNAprep试剂盒提取总RNA。使用HiScript Ⅲ RT Super Mix将总RNA反转录为cDNA。使用SYBR Green分析目标mRNA的相对表达水平。各组mRNA的相对表达水平通过2-ΔΔCt法进行计算。KLF5正向引物序列为5’-CCTGGTCCAGACAAGATGTGA-3’,反向引物序列为5’-GAACTGGTCTACGACTGAGGC-3’。CCND1正向引物序列为5’-TTCCTGTCCTACTACCGC-3’,反向引物序列为5’-CTCCTCCTCTTCCTCCTC-3’。 分析OGT对SW620细胞CCND1表达的影响时分为空白对照组(不进行处理)、阴性对照组、OGT抑制组(转染OGT siRNA)和OGT抑制+ KLF5过表达组(同时转染OGT siRNA和OE-KLF5)。
1.4.4 蛋白免疫印迹(Western blot)实验:收集处理好的细胞(密度为80%),加入蛋白酶抑制剂Cocktail和RIPA裂解液提取细胞总蛋白。使用BCA蛋白质测定试剂盒定量分析蛋白浓度。分离蛋白质并转移至PVDF膜。室温下用KLF5抗体孵育膜1 h,再用山羊抗兔IgG在室温下孵育2 h。使用ECL化学发光剂对膜进行可视化,蛋白质在凝胶成像仪(Bio-Rad)上进行显影。
1.4.5 免疫荧光实验:处理好的细胞接种在培养皿上,使用4%多聚甲醛固定20 min后加入含Triton X-100(0.5%)的PBS渗透5 min,再加入含3% BSA的PBS液封闭1 h。将细胞与O-GlcNAc一抗在4 ℃下孵育过夜。然后加入FITC标记的山羊抗兔IgG(2 μg/ml)在37 ℃下与细胞孵育1 h,然后用DAPI与细胞室温孵育5 min。使用FV-10 ASW 1.7 Viewer图像分析软件处理图片,使用共聚焦激光扫描显微镜FV-3000分析荧光。
1.4.6 流式细胞仪检测细胞周期:将处理好的细胞以1×105个/孔的密度接种在24孔板中。孵育24 h后,移除培养基并用新鲜培养基替换,48 h收获细胞并重新悬浮在PBS缓冲液中。用碘化丙啶(PI)对细胞进行染色。分析G0/G1期、S期和G2/M期的细胞百分比。分析KLF5对SW620细胞周期的影响时分为阴性对照组、空白对照组(不进行处理)和KLF5 siRNA组(转染KLF5 siRNA);分析过表达CCND1对SW620细胞周期的影响时分为阴性对照组、空白对照组(不进行处理)、KLF5 siRNA组(转染KLF5 siRNA)和KLF5 siRNA+CCND1过表达组(同时转染KLF5 siRNA和OE-CCND1)。
1.4.7 荧光素酶报告实验:CRC细胞在24孔板中培养,将荧光素酶报告基因载体pGL3-CCND1或荧光素酶报告基因缺失突变载体pGL3-CCND1-DM与pCMV-Myc-KLF5过表达载体或pCMV-Myc质粒及内参质粒pRL-TK共转染至细胞,设定荧光素酶报告基因载体、pCMV-Myc-KLF5过表达载体与内参质粒pRL-TK转染比例为50∶50∶1。孵育48 h后,使用Dual Luciferase Reporter Assay System测量荧光素酶活性。
2 结 果
2.1 各细胞中KLF5 mRNA表达情况 GEPIA2和UALCAN portal数据库显示,KLF5 mRNA和蛋白在CRC中均为高表达。RT-qPCR结果显示,FHC、SW620、SW480和DLD-1细胞中KLF5 mRNA相对表达量依次为0.997±0.055、1.843±0.061、2.070±0.046和1.553±0.112。与正常结直肠黏膜细胞株FHC比较,SW620、SW480和DLD-1细胞株中KLF5 mRNA相对表达量明显增高(均P<0.05)。既往研究[5]发现KLF5在SW620细胞中稳定表达,所以后续实验选择SW620细胞。
2.2 KLF5对SW620细胞增殖的影响 见图1。CCK-8实验结果表明,与阴性对照组和空白对照组比较,KLF5 siRNA组细胞增殖活性明显降低(P<0.05)。

注:与KLF5 siRNA组比较,*P<0.05
2.3 KLF5对SW620细胞周期的影响 见图2。流式细胞仪分析结果显示,与空白对照组和阴性对照组相比,KLF5 siRNA组G1期细胞比例明显增高(P<0.05)。

注:与KLF5 siRNA组比较,*P<0.05
2.4 KLF5靶基因筛选及荧光素酶报告实验结果 通过TRRUST数据库分析KLF5可能的靶基因,发现CCND1是KLF5可能的靶基因,并且KLF5可正调控CCND1表达。进一步通过JASPAR网站查询CCND1启动子区与转录因子KLF5可能的结合位点,发现两者有多个结合位点。因为评分越高,两者结合的可能性越大,所以后续实验我们选择评分最高的结合位点“CCCCCGCCCC”进行研究。为进一步验证KLF5对CCND1基因转录的调控作用及作用位点,本研究分别合成了荧光素酶报告基因载体pGL3-CCND1与荧光素酶报告基因缺失突变载体pGL3-CCND1-DM。将pGL3-CCND1或pGL3-CCND1-DM与pCMV-Myc-KLF5过表达载体及内参质粒pRL-TK共转染至SW620细胞,转染48 h后测定荧光素酶活性。结果显示,与共转染pCMV-Myc空载体对照组比较,过表达KLF5可以上调CCND1荧光素酶报告基因活性(1.001±0.05与1.856±0.092,t=-12.455,P=0.000)。将KLF5结合位点“CCCCCGCCCC”缺失后,CCND1荧光素酶报告基因活性降低(1.856±0.092与1.340±0.086,t=7.118,P=0.002),说明KLF5能够通过结合“CCCCCGCCCC”促进CCND1表达。
2.5 KLF5对SW620细胞CCND1表达的影响 通过RT-qPCR分析KLF5对CCND1表达的调控作用,结果表明与空白对照组(1.001±0.080)和阴性对照组(1.040±0.098)比较,KLF5 siRNA组CCND1表达水平(0.615±0.023)明显降低(t=7.939、7.275,P=0.001、0.002),证实KLF5可正调控CCND1表达。
2.6 过表达CCND1对SW620细胞增殖及细胞周期的影响 见图3。与KLF5 siRNA组比较,KLF5 siRNA+CCND1过表达组细胞增殖水平增高,细胞G1期比例降低(均P<0.05)。

注:与KLF5 siRNA组比较,*P<0.05
2.7 OGT对SW620细胞O-GlcNAc和KLF5蛋白表达的影响 见图4、5。YinOYang-1.2和GlyGen数据库分析结果表明KLF5蛋白Thr159位点进行O-GlcNAc糖基化修饰可能性最大。UALCAN数据库分析结果表明OGT mRNA和蛋白在CRC组织中的表达水平较癌旁正常组织明显增高(均P<0.05)。GEPIA2数据库分析结果提示OGT和KLF5表达呈正相关(r=0.15,P=0.0051)。为进一步观察OGT对SW620细胞O-GlcNAc和KLF5蛋白表达的影响,设立空白对照组、阴性对照组和OGT抑制(添加20 μmol/L OSMI-1)组,处理48 h后Western blot检测KLF5蛋白表达,免疫荧光化学观察O-GlcNAc糖基化蛋白表达,结果表明OGT抑制组O-GlcNAc糖基化蛋白水平和KLF5蛋白水平均明显降低(均P<0.05)。

图4 OGT对SW620细胞KLF5蛋白表达的影响

图5 OGT对O-GlcNAc糖基化蛋白水平的影响(免疫荧光染色,×200)
2.8 O-GlcNAc糖基化修饰对KLF5蛋白稳定性的影响 见图6。蛋白质半衰期指蛋白降解为原有一半所需的时间,是衡量蛋白质稳定性的关键参数,蛋白质半衰期越短蛋白质稳定性越低。主要采用可有效抑制蛋白质合成的放线菌酮(CHX)处理细胞并每隔一段时间检测蛋白含量以得到半衰期。本研究分DMSO组和OSMI-1组,分别用DMSO和OSMI-1处理SW620细胞,OSMI-1处理48 h后用50 μm的放线菌酮处理1、2、4、6、8 h并检测KLF5蛋白的表达。结果表明OSMI-1处理后,KLF5在CHX处理4 h后蛋白达到半衰期,而OSMI-1未处理的SW620细胞在放线菌酮处理8 h后KLF5蛋白才基本达到半衰期。
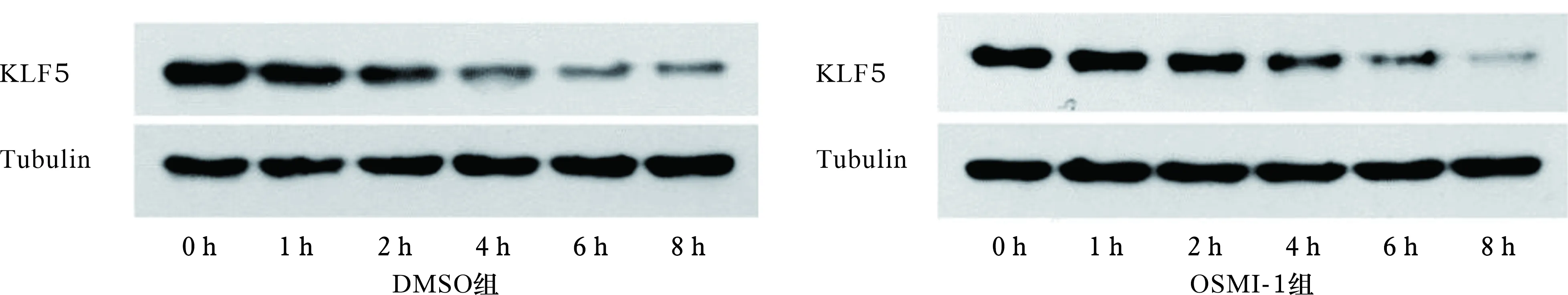
图6 O-GlcNAc糖基化修饰对KLF5蛋白稳定性的影响
2.9 OGT对SW620细胞CCND1表达的影响 与空白对照组(1.003±0.043)和阴性对照组(1.051±0.109)比较,OGT抑制组中CCND1表达(0.593±0.024)明显降低(t=7.094、14.476,P=0.002、0.000),但是与OGT抑制组比较,OGT抑制+ KLF5过表达组CCND1表达(0.737±0.051)则增高(t=4.399,P=0.012)。
3 讨 论
CRC是全球常见的恶性肿瘤之一。研究[10]表明,细胞周期失调在CRC的发生和发展中起着重要作用。然而CRC进展过程中的具体分子作用机制和关键通路之间的调控关系尚不明确,因此对于促进CRC增殖和转移的分子机制仍需进一步研究。
KLF5是一种干细胞相关转录因子,在肿瘤细胞增殖、存活、凋亡和化疗药物敏感性方面发挥着重要作用[11]。通过生物信息学分析我们发现KLF5 mRNA和蛋白在CRC中均为高表达,同时KLF5在CRC细胞株中的表达水平也明显增高,并且KLF5可促进CRC SW620细胞增殖和促进细胞周期由G1期向S期转化,证实KLF5在CRC中扮演着癌基因的角色。通过TRRUST数据库我们筛选了KLF5可能的靶基因,发现KLF5可正调控CCND1的表达,通过JASPAR网站发现CCND1启动子区与转录因子KLF5有多个结合位点。CCND1属于高度保守的细胞周期家族,在多种恶性肿瘤中高表达,包括CRC[12-13]。CCND1可结合并激活 G1期特有的周期蛋白依赖性激酶CDK4,从而推动细胞周期由G1期进入S期并促进细胞增殖[14]。荧光素酶实验结果表明,KLF5可与CCND1靶向结合,并且抑制KLF5的表达后可明显下调CCND1的表达水平,表明KLF5与CCND1属于正调控关系。进一步的拯救实验表明,与空白对照组和阴性对照组比较,KLF5 siRNA组SW620细胞增殖活性降低,G1期比例明显增高,但是和KLF5 siRNA组相比KLF5 siRNA+CCND1过表达组SW620细胞增殖活性和G1期比例有所降低,说明过表达CCND1可逆转沉默KLF5对CRC细胞增殖活性的抑制和细胞周期G1期的阻滞作用,证实KLF5通过上调CCND1增强细胞增殖活性及促进细胞周期由G1期向S期转化。
为探寻调控KLF5蛋白表达的上游机制,我们通过YinOYang-1.2和GlyGen数据库对KLF5蛋白上可能的O-GlcNAc糖基化位点进行预测,发现KLF5蛋白Thr159位点进行O-GlcNAc糖基化修饰可能性最大。O-GlcNAc糖基化修饰异常是肿瘤细胞新的重要特征之一,O-GlcNAc糖基化修饰作为一种营养感受器,能够对肿瘤细胞代谢进行调控并影响肿瘤细胞的增殖[15-16]。O-GlcNAc糖基化修饰由O-GlcNAc转移酶(OGT)负责催化,O-GlcNAc水解酶负责水解[17]。OGT通过O-GlcNAc糖基化修饰相关蛋白质从而参与细胞信号转导、转录调节、细胞分化及蛋白质的翻译和降解等[18]。既往研究[19]发现,OGT在多种恶性肿瘤中高表达并导致肿瘤细胞相关蛋白O-GlcNAc糖基化水平明显增高。并且O-GlcNAc糖基化与磷酸化及泛素化存在竞争和依赖共存的关系,因此O-GlcNAc糖基化与泛素化的竞争关系使得O-GlcNAc糖基化修饰可增强蛋白质的稳定性[20-21]。通过生物信息学分析我们发现CRC组织中OGT mRNA和蛋白的表达水平均明显增高,并且OGT和KLF5的表达呈正相关。不仅如此,抑制OGT表达后O-GlcNAc糖基化蛋白水平和KLF5蛋白水平均明显降低,因此推断O-GlcNAc糖基化可能影响KLF5蛋白的稳定性。本研究进一步检测了KLF5蛋白的半衰期,结果发现抑制OGT表达后KLF5蛋白在4 h时达到半衰期,而未抑制OGT表达的SW620细胞KLF5蛋白在8 h达到半衰期,说明抑制OGT表达使得O-GlcNAc糖基化水平降低,导致细胞内KLF5蛋白的稳定性降低,KLF5蛋白的表达水平也明显降低。最后,拯救实验结果表明OGT抑制组中CCND1表达水平较空白对照组和阴性对照组明显降低,但是与OGT抑制组相比,OGT抑制组+KLF5过表达组中CCND1表达水平则有所增高,说明过表达KLF5可逆转抑制OGT对CCND1表达的下调作用,证实OGT通过O-GlcNAc糖基化修饰上调KLF5表达并促进CCND1表达。
综上所述,KLF5可正调控CCND1转录,CCND1过表达可促进CRC细胞增殖和细胞周期由G1期向S期转化,而OGT通过O-GlcNAc糖基化修饰上调KLF5表达并最终增强CCND1表达水平,从而参与CRC发生、发展。本研究为CRC的发病提供了新的见解,并为CRC的防治提供了新的作用靶点,但是还需要更深入的体内和体外研究对本结论进行验证。

