布托啡诺对白细胞介素-1β诱导的关节软骨细胞焦亡的影响及机制研究
张 玲,陈 尧,尹 航,程 超
(1.黄石市中医医院麻醉科,湖北 黄石435000;2.黄石市中医医院骨科,湖北 黄石435000)
骨关节炎(Osteoarthritis,OA)是一种常见的以软骨退化和破坏为特征的慢性关节疾病,其病理过程主要以软骨细胞死亡、关节炎症、衰老为主[1]。OA患者往往因为关节僵硬、疼痛而致残,最终导致生活质量严重下降,并产生巨大的经济负担,因此开发新药物治疗OA方法意义重大[2]。布托啡诺(Butorphanol,BT)是一种脂溶性麻醉药,作为一种合成的阿片受体激动拮抗剂,临床上广泛用作镇痛药[3]。但研究[4]表明BT可以通过减少炎症性浸润损伤减轻神经元损伤及脑损伤,然而在OA治疗中鲜有报道。细胞焦亡是一种由促炎介质诱导的炎症性程序性细胞死亡,可诱导细胞破裂和细胞内容物释放,其特征是NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)、半胱天冬酶-1(Caspase-1)激活以及白细胞介素(Interleukin-1β,IL-1β)的释放,参与多种疾病中的进展[5]。Li等[6]研究发现,在脂多糖诱导建立小鼠膝骨关节炎软骨细胞模型中,下调微小RNA-155(microRNA-155,miR-155)可通过抑制NLRP3/Caspase-1通路增加细胞活力,抑制小鼠膝骨关节炎软骨细胞焦亡。但BT能否通过抑制NLRP3/Caspase-1通路对OA发展起作用尚不清楚。IL-1β作为一种促炎细胞因子,由激活的巨噬细胞、滑膜细胞产生,在OA进展中起重要作用[7]。本研究以IL-1β诱导的关节软骨细胞建立OA体外模型,探讨BT通过抑制NLRP3/Caspase-1通路对OA发生与发展的影响。
1 材料与方法
1.1 实验细胞 人关节软骨细胞HC-a由上海通派生物科技有限公司提供。将细胞放置在含10% FBS的DMEM培养基中,培养于37 ℃、含5% CO2的培养箱中。
1.2 主要试剂 BT(批号:42408-82-2)购自江苏恒瑞医药股份有限公司; IL-1β试剂(批号:SRP6169)、NLRP3激活剂ATP(批号:5.30657)购自Sigma-Aldrich公司;Hoechst 33342染色液/ 碘化丙啶(PI)染色液(批号:FS-79092)、肿瘤坏死因子-α(TNF-α,批号:70-EK1822)及IL-6 ELISA试剂盒(批号:70-EK3062/2)购自杭州联科生物科技有限公司;一氧化氮(NO)ELISA试剂盒(批号:fk-fv0386)购自延慕实业有限公司;反转录试剂盒(批号:RR037A)购自Takara公司;RIPA裂解液(批号:R0020)、MTT试剂(批号:M1020)购自北京索莱宝生物公司;兔源NLRP3(批号:ab263899)、兔源Caspase-1(批号:ab238972)、兔源IL-1β(批号:ab254360)一抗购自Abcam公司。
1.3 实验方法
1.3.1 细胞分组与处理:取对数生长期HC-a细胞,分为对照组、IL-1β组、BT低浓度(BT-L)组、BT中浓度(BT-M)组、BT高浓度(BT-H)组、BT-H+ATP组。其中,对照组未经IL-1β处理细胞;IL-1β组经10 ng/ml IL-1β处理细胞[8]。BT-L、BT-M、BT-H组分别经10 ng/ml IL-1β处理细胞30 min后,然后经1、2、4 μmol/L BT处理细胞[9]。BT-H+ATP组经10 ng/ml IL-1β处理细胞30 min后,给予4 μmol/L BT、3 mmol/L ATP处理细胞[10]。以上各组均处理48 h后进行检测。
1.3.2 细胞形态观察:按照上述分组处理HC-a细胞,48 h后于倒置显微镜观察各组细胞外观形态变化。
1.3.3 MTT法检测细胞增殖率:将HC-a细胞接种在96孔板中于37 ℃、5% CO2培养箱中培养。处理对数生长期HC-a细胞后,将10 μl MTT溶液添加到96孔板中,并在37 ℃下连续孵育4 h,然后除去MTT溶液,将甲臜染料溶解在二甲亚砜中,低速振荡10 min。于酶标仪上检测570 nm处的光密度值(OD),计算细胞增殖率。细胞增殖率=(试验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.3.4 实时荧光定量PCR(RT-qPCR)检测细胞NLRP3、Caspase-1、IL-1β mRNA表达:收集HC-a细胞,使用TRIzol试剂提取总RNA,使用反转录试剂盒将RNA反转录为cDNA。以β-actin为参照,按照2-ΔΔCt分析NLRP3、Caspase-1、IL-1β mRNA表达水平。引物序列见表1。

表1 各基因引物序列
1.3.5 Hoechst 33342/PI染色检测细胞焦亡变化:将HC-a细胞(2×105/ml)接种于6孔板中,用PBS洗涤细胞,在室温下用PI溶液、Hoechst 33342溶液、细胞染色缓冲液按照1∶1∶200混合后,加入1 ml混合液进行反应,PBS洗涤3次,然后在荧光显微镜观察并拍照。
1.3.6 ELISA检测NO、TNF-α及IL-6水平变化:收集HC-a细胞离心,取上清液按照ELISA试剂盒检测NO、TNF-α及IL-6水平。
1.3.7 Western blot检测细胞NLRP3、Caspase-1、IL-1β蛋白表达水平:用预冷的PBS洗涤上述各组细胞3次,然后用RIPA裂解缓冲液在4 ℃下提取总蛋白。收集上清液,在15% SDS-PAGE电泳上分离蛋白质并进行转膜,室温封闭2 h。之后在4 ℃下与NLRP3、Caspase-1、IL-1β一抗孵育过夜,TBST洗膜3次,将膜与二抗在室温下孵育2 h。通过ECL检测试剂可视化蛋白,以β-actin为内源参照物,分析各组蛋白表达水平。
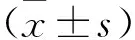
2 结 果
2.1 各组细胞形态变化 见图1。对照组HC-a细胞呈类圆形形态,胞核核仁清晰,呈圆形或椭圆形。IL-1β组细胞体积缩小、有空泡出现,核分裂现象减少。BT-L、BT-M、BT-H组细胞形态逐渐恢复,其中BT-H趋于正常化。BT-H+ATP组核分裂现象较BT-H组减少,细胞体积皱缩。
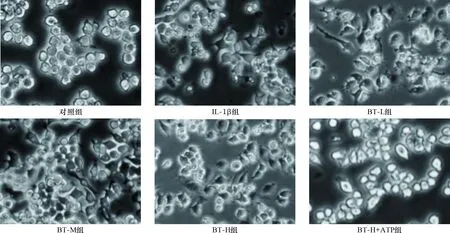
图1 各组细胞形态变化(×400)
2.2 各组细胞增殖率比较 对照组、IL-1β组、BT-L组、BT-M组、BT-H组、BT-H+ATP组细胞增殖率依次为(100.00±0.00)%、(42.31±4.24)%、(58.84±5.89)%、(72.18±7.22)%、(89.61±8.97)%、(64.37±6.44)%。IL-1β组较对照组显著降低(P<0.05)。BT-L组、BT-M组、BT-H组较IL-1β组显著增加,且呈剂量依赖性(均P<0.05)。BT-H+ATP组较BT-H组显著降低(P<0.05)。
2.3 各组细胞PI阳性细胞率比较 见图2。对照组、IL-1β组、BT-L组、BT-M组、BT-H组、BT-H+ATP组PI阳性细胞率依次为(7.15±0.72)%、(78.51±7.86)%、(51.29±5.25)%、(38.67±3.87)%、(16.51±1.66)%、(52.37±5.24)%。与对照组比较,IL-1β组PI阳性细胞率明显增加(P<0.05)。与IL-1β组比较,BT-L组、BT-M组、BT-H组PI阳性细胞率明显减少,且呈剂量依赖性(均P<0.05)。与BT-H组比较,BT-H+ATP组PI阳性细胞率明显增加(P<0.05)。
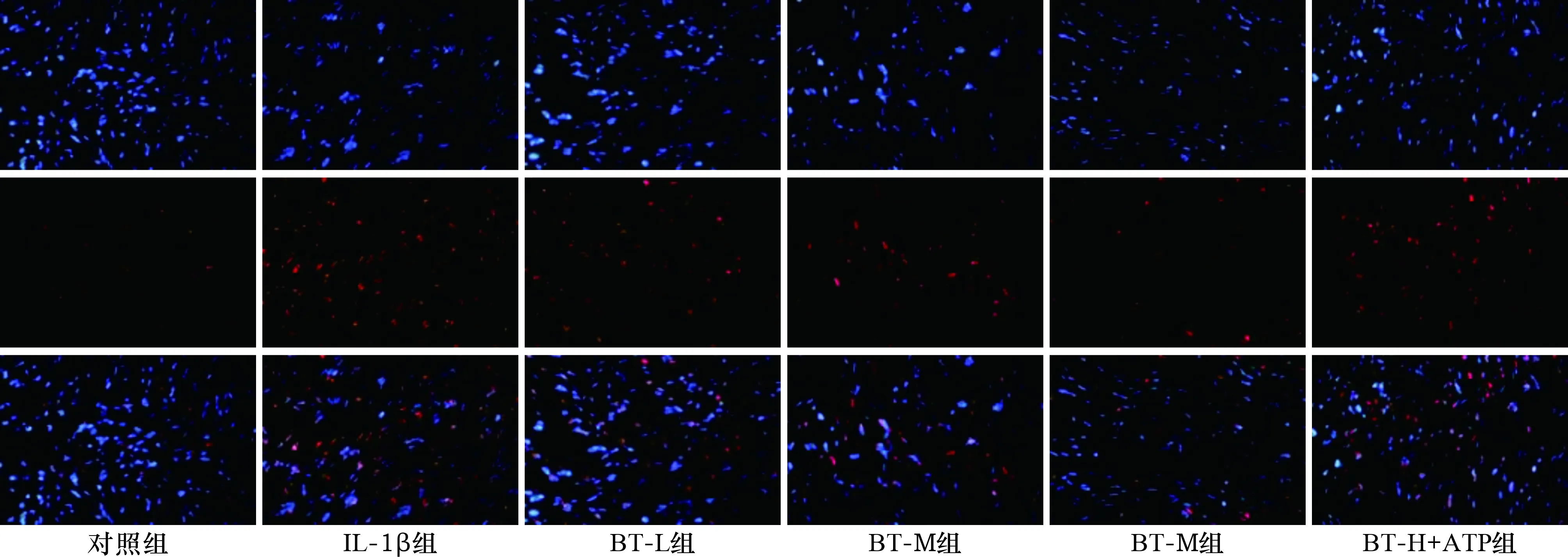
图2 各组细胞Hoechest33342(上)、PI(中)和Merge(下)染色结果(×200)
2.4 各组细胞NO、TNF-α及IL-6水平比较 见表2。与对照组比较,IL-1β组NO、TNF-α及IL-6水平显著升高(均P<0.05)。与IL-1β组比较,BT-L组、BT-M组、BT-H组NO、TNF-α及IL-6水平显著降低(均P<0.05)。与BT-H组比较,BT-H+ATP组NO、TNF-α及IL-6水平显著升高(均P<0.05)。
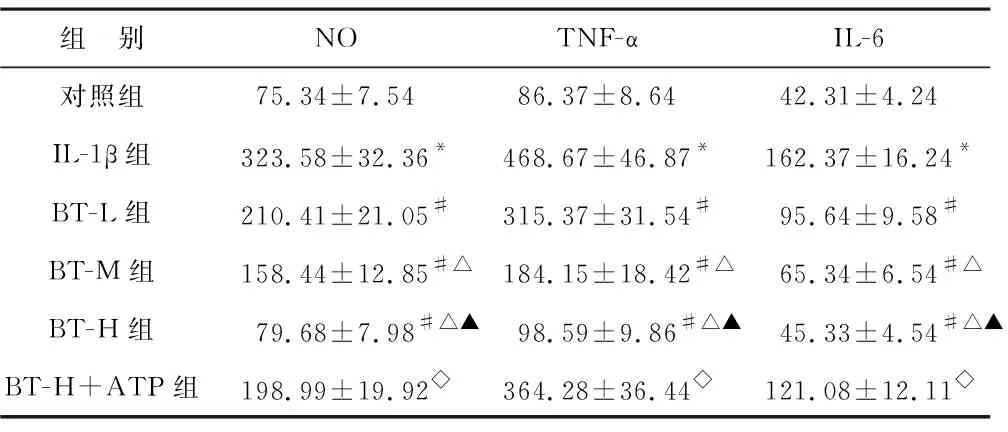
表2 各组细胞NO、TNF-α及IL-6水平比较(pg/ml)
2.5 各组细胞NLRP3、Caspase-1、IL-1β mRNA表达比较 见表3。与对照组比较,IL-1β组NLRP3、Caspase-1、IL-1β mRNA表达显著升高(均P<0.05)。与IL-1β组比较,BT-L组、BT-M组、BT-H组NLRP3、Caspase-1、IL-1β mRNA表达显著下降(均P<0.05。与BT-H组比较,BT-H+ATP组NLRP3、Caspase-1、IL-1β mRNA表达显著增加(均P<0.05)。
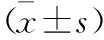
表3 各组细胞NLRP3、Caspase-1、IL-1β mRNA表达比较
2.6 各组细胞NLRP3、Caspase-1、IL-1β蛋白表达比较 见表4。与对照组比较,IL-1β组NLRP3、Caspase-1、IL-1β蛋白表达显著升高(均P<0.05)。与IL-1β组比较,BT-L组、BT-M组、BT-H组NLRP3、Caspase-1、IL-1β蛋白表达显著下降(均P<0.05)。与BT-H组比较,BT-H+ATP组NLRP3、Caspase-1、IL-1β蛋白表达显著增加(均P<0.05)。
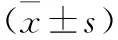
表4 各组细胞NLRP3、Caspase-1、IL-1β蛋白表达比较
3 讨 论
OA常见的症状包括关节疼痛和关节功能紊乱,是全世界常见的慢性退行性疾病,发病率较高,但其主要发生在老年人群中[11]。虽然OA进展缓慢,但其病理变化会影响关节中的所有组织,如软骨下硬化、软骨退化、关节肥大、不同程度的滑膜炎症等,造成患者运动过程中负担严重,进而影响其日常生活[12]。目前OA的病因和发病机制尚不完全清楚,但在OA的进展过程中往往伴随着软骨基质丢失、自噬、氧化应激、炎症和细胞死亡等病理变化,尚未发现有药物能阻断OA的进展[13],因此需要关注病理变化,探讨发病机制以找寻更安全有效的药物。
BT是一种美国食品和药物管理局批准的镇痛剂,是一种有效的κ-阿片受体激动剂和μ-阿片受体拮抗剂,临床应用较为广泛。近年来的研究主要集中在BT的镇痛作用方面,如可用作治疗偏头痛的鼻腔喷雾剂,也可用作治疗中度至重度疼痛的麻醉镇痛剂或作为全身麻醉的辅助剂[14]。除此之外,研究发现BT还具有抗炎等作用。例如,脂多糖刺激H9C2细胞后导致释放的炎症细胞因子增加,而BT处理后抑制了炎症因子的释放,为脓毒症引起的心肌功能障碍提供潜在药物[15];彭赛等[16]研究发现,在子宫全切手术中,BT联合舒芬太尼可以降低患者疼痛,抑制炎症因子水平。值得关注的是,Zhang等[17]研究证明TNF-α诱导人软骨细胞-关节细胞衰老过程中,BT可以通过降低炎症因子水平保护细胞免受TNF-α引起的细胞衰老,可用作治疗与衰老相关的骨关节炎的潜在药物。本研究发现,IL-1β诱导的HC-a细胞中,炎症因子(NO、IL-6、TNF-α)水平明显增加,细胞焦亡(PI阳性表达)增加,但细胞增殖显著下降,经不同浓度的BT处理后,细胞增殖显著增加,炎症反应及细胞焦亡均被抑制,表明BT可能在OA治疗中发挥抑制炎症反应及细胞焦亡的作用,但具体机制需探索。
细胞死亡包括自噬、坏死性凋亡、细胞焦亡、铁死亡等,其中细胞焦亡是炎症小体触发的促炎程序性细胞死亡,其特点是细胞膜溶解,细胞肿胀、破裂,细胞质内容物释放到细胞外。典型激活途径是由NLRP3炎性小体介导的,通过NLRP3响应细胞受到的刺激而被激活,募集凋亡相关斑点样蛋白,并与pro-Caspase-1结合组装成NLRP3炎性小体,然后炎性小体可将pro-Caspase-1切割成活化的Caspase-1,同时也可以切割IL-1β前体,促进其成熟和分泌,从而诱导细胞焦亡[18]。Zhang等[19]研究发现,阻断NLRP3/Caspase-1轴可以减少神经病理损伤,改善细胞焦亡并缓解认知功能障碍,为治疗氯胺酮相关的神经毒性提供了新研究方向。在1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的帕金森小鼠模型中[20],红景天苷通过抑制NLRP3/Caspase-1信号通路抑制细胞焦亡,保护多巴胺能神经元。本研究发现,IL-1β诱导的HC-a细胞中IL-1β、Caspase-1、NLRP3表达显著增加,提示激活NLRP3/Caspase-1信号通路可能与IL-1β诱导的HC-a细胞中炎症因子及细胞焦亡产生有关。经不同浓度的BT处理后,IL-1β、Caspase-1、NLRP3表达显著下调,炎症因子及细胞焦亡均被抑制,推测BT可以通过抑制NLRP3/Caspase-1信号通路降低炎症因子水平,抑制细胞焦亡。为进一步验证上述猜想,本实验引入NLRP3激活剂ATP,结果发现ATP逆转了BT-H对IL-1β诱导的HC-a细胞中炎症因子及细胞焦亡的抑制作用,提示BT通过抑制NLRP3/Caspase-1信号通路降低IL-1β诱导的HC-a细胞焦亡。
综上所述,BT可以抑制IL-1β诱导的关节软骨细胞焦亡,可能与抑制NLRP3/Caspase-1信号通路有关。但本研究仅在体外进行了实验,接下来计划在动物体内开展相关实验,并设置抑制剂阴性对照以进一步完善该机制的研究。

