全内脏反位肝硬化合并不明原因发热1例
权昕 崔曼莉 路宁 李茜 温华 张明鑫
患者,女性,54岁,农民。因“发现肝硬化8年,间断发热2个月”入院。8余年前出现双下肢水肿伴腹胀、乏力、纳差,当地医院诊断为“原发性胆汁性肝硬化、血小板减少症”。2个月前无明显诱因出现间断发热,体温多波动于38~39℃,无畏寒、寒战,口服布洛芬胶囊、尼美舒利颗粒后体温可退至正常。1个月前再次出现发热,住院对症治疗后症状缓解,遂出院。出院后1周再次出现发热,体温38℃,口服布洛芬后降至正常。1天前再次出现发热,体温最高40℃,伴畏寒、寒战,伴左侧肩背部疼痛,伴腹痛、腹胀,伴恶心、呕吐,无反酸、烧心,无呃逆、嗳气,无心慌、咳嗽、咳痰等。于我院发热门诊就诊,以“发热待查:腹膜炎?”收入我科。患病以来,精神差,食纳差,睡眠差,小便正常,2~3天大便1次,体重无明显变化。既往病史:5年前行CT检查显示“心脏及腹腔脏器转位、肝硬化、脾大、门脉高压、腹水”,后长期口服熊去氧胆酸(1片/次,2次/d)治疗,此后仍间断出现上述症状。2年前因“食管胃底静脉曲张破裂出血”于我科住院并行内镜下食管胃底曲张静脉硬化剂及组织胶治疗术。查体:生命体征平稳,心尖搏动位于右侧第5肋间锁骨中线内0.5 cm处。心界叩诊不大,心率84次/分,律齐,各瓣膜听诊区未闻及病理性杂音。腹膨隆,腹软,上腹轻压痛。无反跳痛,腹部无包块。脾右肋下5 cm可触及,Murphy征阴性,移动性浊音阴性,其余查体未见无明显异常。
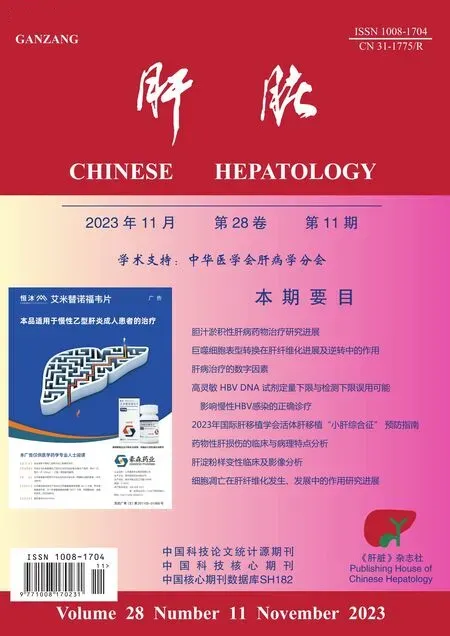
辅助检查:血气分析:二氧化碳分压30 mmHg、氧分压78 mmHg、pH 7.47。血凝:PT活动度43.0%、国际标准化比值1.92、凝血酶原时间25.70 s、D-二聚体2.64 mg/L。血分析:白细胞2.54×109/L;嗜酸细胞百分比0.0%、红细胞3.11×1012/L、血小板29×109/L、淋巴细胞百分比5.5%、血红蛋白78 g/L、C反应蛋白118.82mg/L、中性粒细胞百分比90.3%;降钙素原19.60 ng/mL。电解质:钠134.6 mmol/L、钙1.89 mmol/L、钾3.04 mmol/L、镁0.62 mmol/L、磷0.75 mmol/L。肝功能:白蛋白29.3 g/L、白球比0.7、胆碱酯酶2229 U/L、总胆红素51.60 μmol/L、碱性磷酸酶140 U/L、总胆汁酸15.3 μmol/L、谷草转氨酶37 U/L、直接胆红素25.80 μmol/L、间接胆红素25.80 μmol/L。肾功能:肌酐42.6 μmol/L。传染病系列:乙肝表面抗体19.26、乙肝e抗体0.69、乙肝核心抗体2.88。血氨未见异常。红细胞沉降率99 mm/h。肿瘤标志物:糖类抗原CA125 45.70 U/mL、糖类抗原CA199 704.89 U/mL。血脂:总胆固醇1.40 mmol/L、高密度脂蛋白0.82 mmol/L。免疫功能组合:特定蛋白BN2补体C3 0.677 g/L、免疫球蛋白A 7.71 g/L、免疫球蛋白κ轻链7.2 g/L、免疫球蛋白G 22.4 g/L、免疫球蛋白λ轻链2.83 g/L。尿液分析:尿葡萄糖(2+) 14 mmol/L。出血热抗体及结核抗体阴性。自身免疫性肝病系列、铁蛋白未见异常。血培养、腹水培养未见异常。腹部超声(图1):患者内脏反位。肝实质回声增粗增强;肝内胆管轻度扩张。胆囊体积略大;结石性胆囊炎并胆泥沉积。胆总管内径正常高值。脾大,脾静脉内径增宽。门静脉内径增宽。腹部CT+门静脉CT成像(图2、图3):①部分肝内胆管明显扩张、肝内胆管及胆囊结石;S7、S8肝内胆管周围异常强化及胆囊改变,考虑炎症。②肝硬化、门脉高压征象,肝门静脉属支迂曲增粗,食管胃底静脉为著;门静脉主干及左、右支见附壁血栓形成。③多脾综合征合并下腔静脉肝段缺如、奇静脉增粗、全内脏反位、胰腺短小。④肝外胆管形态尚可,十二指肠壶腹区可疑结节此次显示不确切。⑤腹腔少量积液,系膜及腹膜后见片絮状渗出样改变。⑥左侧心膈角区淋巴结肿大,形态尚可,强化尚均匀。⑦扫及右肾囊肿。⑧扫及双肺下叶部分肺组织膨胀不全。MRI+MRCP(图3):多脾综合征伴胸腹腔多脏器反位。肝硬化,门脉高压征象;下腔静脉肝段缺如,奇静脉增粗。肝内胆管、肝左、右管及肝总管、胆总管增宽,以胆总管为著;胆囊大,胆囊及右半肝部分肝内胆管多发结石。右肾囊肿。基因检测:未检测到与肝硬化失代偿期、Caroli病、自身免疫性肝病、腹腔血管发育异常、胸腹腔脏器转位、多脾综合征、结缔组织病、Kartagener综合征、肝硬化、血小板减少症等相关的符合遗传方式的具有可能临床意义的变异(包括SNV和Indel)。但检测出了可能跟Caroli病或肝硬化有关的基因突变,即PRKCSH、ACOX2,它们分别与多囊肝1型和先天性胆汁酸合成缺陷6型有关。

图1 腹部彩超。患者内脏反位;肝实质回声增粗增强;肝内胆管轻度扩张;结石性胆囊炎并胆泥沉积;胆总管内径正常高值;脾大,脾静脉内径增宽;门静脉内径增宽。
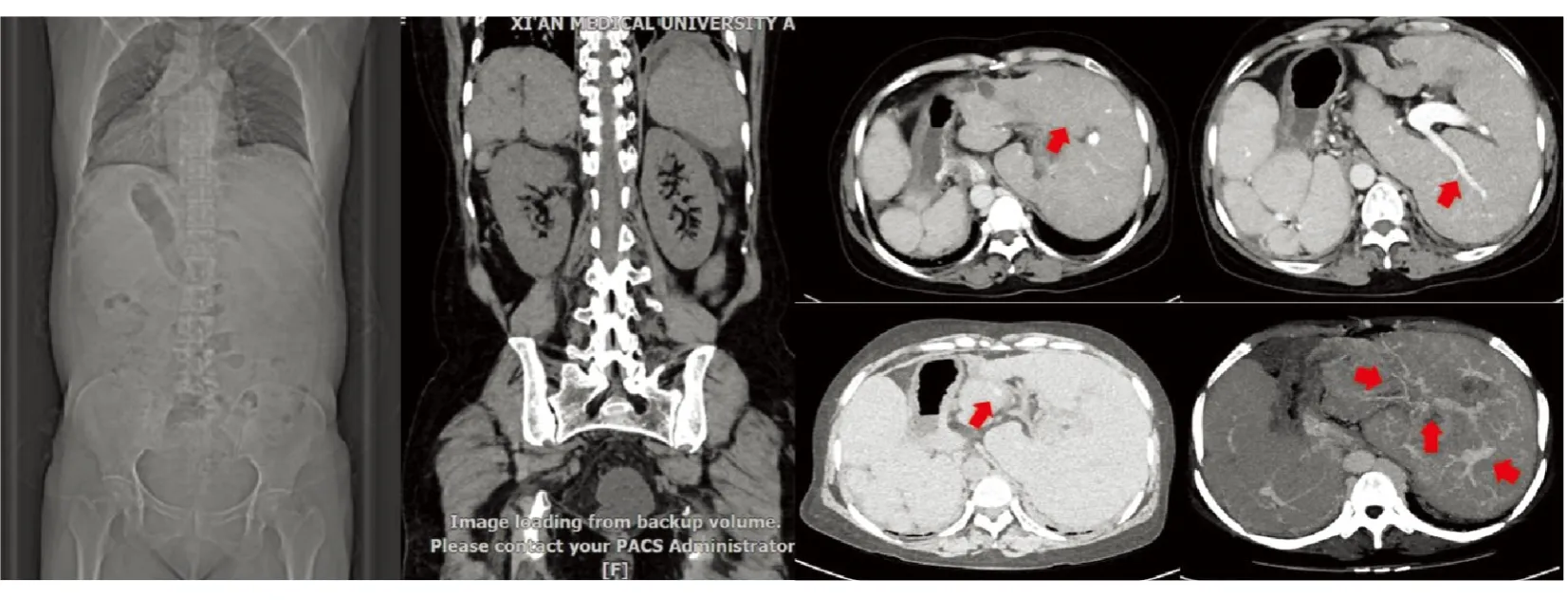
图2 腹部CT结果。部分肝内胆管明显扩张、肝内胆管及胆囊结石;肝硬化、门脉高压征象,肝门静脉属支迂曲增粗,食管胃底静脉为著;多脾综合征合并全内脏反位、胰腺短小;腹腔少量积液;右肾囊肿。

图3 门静脉成像。门静脉增宽,肝门处门静脉内经约17 mm;食管胃底静脉曲张;下腔静脉肝段缺如;奇静脉增粗。
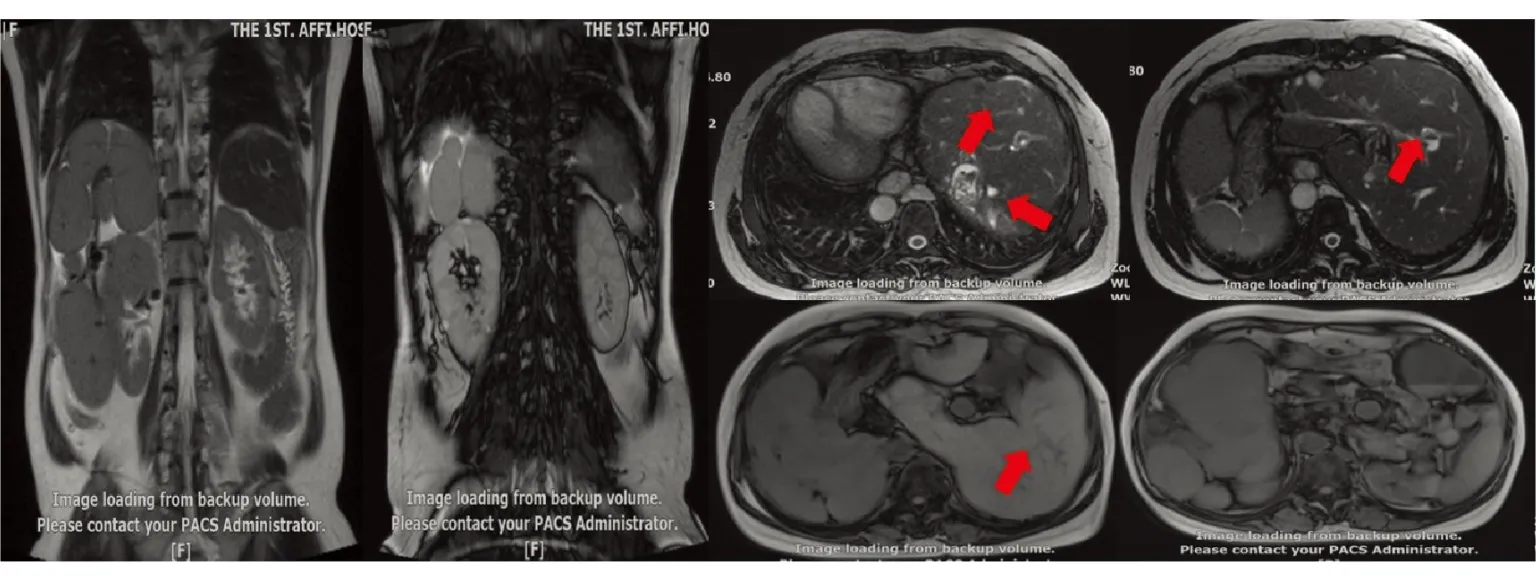
图4 MRI+MRCP。多脾综合征伴胸腹腔多脏器反位;肝硬化,门脉高压征象;下腔静脉肝段缺如,奇静脉增粗;肝内胆管、肝左、右管及肝总管、胆总管增宽,以胆总管为著;胆囊大,胆囊及右半肝部分肝内胆管多发结石;右肾囊肿。
诊断:结合上述病史、查体及辅助检查,主要考虑以下诊断:①肝内胆管囊状扩张症(Caroli病)。②全内脏反位腹腔血管发育异常,多脾综合征。③原发性胆汁性肝硬化失代偿(Child-PughC级)门静脉高压,食管胃底静脉曲张,腹腔积液(少量),脾大。④结缔组织病?⑤肝内胆管结石。⑥胆囊结石。⑦右肾囊肿。
鉴别诊断:①发热鉴别诊断包括:胆系感染、自发性腹膜炎、血小板减少综合征、结缔组织病以及消化性肿瘤等。②Caroli病鉴别诊断包括:原发性硬化性胆管炎、梗阻性肝内胆管扩张、肝内胆管囊腺瘤、肝脓肿等[4]。
治疗经过:入院先后给予替硝唑0.8 g(1次/d,静滴)、头孢他啶(1.0 g,静滴,q12 h)、美罗培南(0.5 g,静滴,q8 h)抗感染治疗;熊去氧胆酸胶囊(250 mg,口服,3次/d)促进胆汁排出;门冬氨酸鸟氨酸(15g,静滴,1次/d)和复方氨基酸(3AA)(250 mL,静滴,1次/d)预防肝性脑病;多烯磷脂酰胆碱(697.50 mg,静滴,1次/d)保肝治疗;枸橼酸钾颗粒(1.46 g,口服,3次/d)补钾;赖氨匹林(0.9 g,肌内注射,1次/d)、右旋布洛芬栓(50 mg,口服,1次/d)联合物理等方式降温;艾司奥美拉唑(40 mg,静脉泵入,2次/d)抑酸护胃;地榆升白片(0.1 g,口服,3次/d)、重组人粒细胞刺激因子(150 μg,皮下注射)升高白细胞;悬浮红细胞(2 U)纠正贫血等对症支持治疗,余给予补液纠正水电解质及酸碱失衡等对症治疗。经上述治疗14 d后,患者发热、畏寒、恶性、呕吐、腹痛及贫血等症状明显好转。复查各项血象除血小板稍低外其余指标基本恢复正常。出院1周后随访,患者未再出现发热。但Caroli病病情易反复,且患者肿瘤标志物升高,合并肝硬化、门静脉高压、食管胃底静脉曲张、胆囊结石及右肾囊肿等,应高度警惕出现食管胃底静脉破裂出血及肿瘤发生风险,需定期随访观察。
讨论目前,不明原因发热(fever of unkown origin,FUO)主要分为经典型不明原因发热和特殊人群的不明原因发热。其中经典型发热的病因比较多,目前已超过200种,主要分为感染性疾病(最常见)、肿瘤性疾病、非感染性炎症性疾病及其他疾病[1,2]。感染性疾病热程较非感染性疾病热程短,提示热程在30 d以内者首先应考虑感染性疾病,随着热程的延长需高度重视结缔组织病、恶性肿瘤等非感染性疾病的可能。虽然热程对于FUO病因的初步诊断具有提示作用,但仍需结合其他因素来寻找病因。病原学、血清学及组织病理检查具有较大的诊断价值[2]。不过某些疾病往往需要多次反复检查才有可能获得阳性结果。该患者主要以发热、畏寒、腹痛、恶心为主要症状入院,结合其他病史资料、辅助检查及查阅相关文献,其发热原因主要考虑Caroli病合并胆系感染所致。有研究表明,28.6%~85.71%的Caroli病患者以不同程度的发热、寒战、恶必、呕吐等为首发症状伴或不伴肠源性感染[3,4]。同时我们认为该患者的肝硬化主要是由Caroli病致肝内外胆管扩张畸形从而形成胆汁淤积所致。
Caroli病最初被Caroli描述为一种纤毛功能障碍引起的先天性导管板畸形,以肝内胆管的节段性囊性扩张为特征的先天性疾病,普通人群患病率为百万分之一[5],一般伴有胆囊及胆道结石、胆管炎、肝脓肿等,严重者可发展为肝硬化、门脉高压,也与肾小管扩张或类似的肾囊性疾病有关。患者虽然在出生时就出现导管畸形,但通常到青春期或成年都无症状[6]。目前大多认为它是常染色体隐性遗传病[7]。Caroli病包括以下两种类型:①简单或孤立型(少见),特征是肝内胆管囊性扩张,而无明显肝脏异常表现。②Caroli 综合征(多见),为汇管区纤维化型,胆管畸形伴先天性肝纤维化和门静脉高压表现,肝小叶结构破坏,易较早出现脾大、腹水和静脉曲张破裂出血等肝硬化表现。PKHD1基因被认为是简单或孤立型和Caroli综合征的致病基因[8,9]。虽然我们的基因检测并没有检测到目的基因,但检测到PRKCSH、ACOX2基因突变,它们分别与多囊肝1型和先天性胆汁酸合成缺陷6型有关。以上突变基因是否与患者Caroli病或者肝硬化有关,我们尚未可知,因为并没有查阅到相关文献。
Caroli病基本可以根据患者病史特点联合超声、CT、ERCP、MRCP、基因检测及组织病理予以诊断。超声可见肝内胆管呈囊样或串珠样扩张,囊肿沿肝内胆管走向分布,囊肿之间可见正常胆管声像。CT表现为囊状扩张的中央点状影,称为“中心点”征,或囊状扩张的胆管与细小的胆管相通形似蝌蚪,称为“蝌蚪征”,是Caroli病的CT特征性表现[10,11]。MRCP表现为多发性肝内胆管囊状扩张,T1WI呈低信号影,T2WI呈高信号影,增强扫描有部分强化[12,13]。有文献报道,MRCP对胆管扩张或狭窄的敏感性为90%~95%,对正常肝外胆管的显示率接近100%,逐步成为首选的检查[4]。穿刺活检为诊断的金标准,可见肝内胆管节段性囊状扩张或增生,可伴有典型的肝内胆管畸形或交通性海绵状胆管扩张[13]。该病保守治疗只能改善症状,并不能根治且容易复发。Caroli病的有效治疗方法是手术切除或者肝移植,局限于某个肝叶可以行手术切除,如果肝内胆管弥漫性囊状扩张可考虑肝移植[14]。考虑该患者为肝硬化失代偿期(Child-Pugh C级),合并门静脉高压、食管胃底静脉曲张、腹水,自身条件极差,只能采取保守治疗,经治疗后该患者症状缓解出院。
有报道表明,约7%的Caroli病患者最终发展为恶性肿瘤,其发生风险是正常肝胆管人群的100倍[15]。该患者为中年发病,肿瘤标志物升高,合并肝硬化、门静脉高压、食管胃底静脉曲张、胆囊结石及右肾囊肿等,应高度警惕食管胃底静脉破裂出血及肿瘤发生风险,需定期随访。此外值得注意的是,该患者存在全内脏反位。这也是一种罕见的先天性畸形,其发生率为1/20000~1/5000,通常内脏器官排列发生镜像转位,又被称为“镜面人”[16,17]。80%的全内脏反位者合并其他先天性异常,如心脏畸形、纤毛运动障碍、先天性肝纤维化,以及更大范围的胰腺纤维化的肝内胆道发育不良和/或肾脏疾病,如双侧肾囊性疾病、常染色体隐性多囊性肾脏疾病或肾囊性疾病,但以胆道系统畸形的发生为著[18]。所以该患者究竟是因为全内脏反位导致的胆道系统畸形从而形成Caroli病,还是因为这两种先天性畸形病变有各自的突变基因,只是巧合地在同一患者身上表现出来?因为未查询到相关文献资料,基因检测也未寻找到目的基因,所以我们不能得出明确的结论,希望以后能有更多相关的病例报道出现,以解决我们心中的疑惑。
综上所述,FUO在临床较为多见,大部分患者只有发热症状,临床很多疾病包括一些少见病、罕见病均会引起发热症状[19],同时FUO病因纷繁复杂,常规检查难以确诊,进而无法给予针对性治疗,这给患者的身心健康造成了严重影响。本病例患者FUO病因主要是由Caroli病合并胆系感染所致,同时合并全内脏反位,十分罕见,诊断起来也较为困难,我们经过多科室联合讨论及查阅相关文献,才最终考虑Caroli病。因此,临床诊治患者时要注重多科室的合作,以提高确诊率;同时详细的病史采集和查体均可有效缩小诊断范围。对于短期不能明确病因的患者,定期随访观察或许是可行的方法。另外,我们也需要加深对Caroli病的认识,对于反复发热、寒战、恶心、腹痛、黄疸,或出现不明原因的慢性胆汁淤积、胆管炎、胆道结石、门静脉高压、脾功能亢进等症状者,应警惕Caroli病的可能。此外超声、腹部CT及MRCP提示多发肝囊肿伴肝内胆管扩张、肝纤维化者,也需考虑Caroli病可能。
利益冲突声明:所有作者均声明不存在利益冲突。