肝细胞癌患者TACE术后血清GP73、FOXP3表达及其与疗效的关系
LEE EUNJI 刘博 袁响林
肝细胞癌(hepatocellular carcinoma,HCC)主要通过经门静脉系统在肝内进行传播[1]。但该病表现出的消化道、全身症状特异性不明显,且进展较快,多数患者在确诊时已处于疾病晚期阶段,无法进行手术治疗,只能采取介入治疗、靶向治疗等保守治疗方式[2,3]。经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)能够通过阻断肿瘤的营养供应从而消灭肿瘤细胞[4]。目前TACE是无法进行手术的HCC患者首选治疗方式,能够提高部分患者根治性概率,但远期疗效仍无法令人满意[5]。有研究指出叉头状螺旋转录因子(Forkhead/winged helix transcription factor,FOXP3)作为影响调节性T细胞功能及发育的决定因子,间接调节其在免疫系统对肿瘤抗原的应答,进而促进肿瘤发生发展[6]。而高尔基体蛋白73(Golgi protein 73,GP73)在部分恶性肿瘤中被证实可通过促进血管内皮生长因子分化从而参与疾病[7]。本研究探讨血清GP73、FOXP3水平与TACE治疗HCC患者疗效及预后的关系。
资料与方法
一、一般资料
选取2019年5月至2021年8月在同济医学院附属同济医院接受TACE治疗的HCC患者198例,年龄为(54.5±14.4)岁,男性102例,女性96例;BMI为(22.14±1.74)kg/m2;肝功能Child-Pugh分为A级的有112例,B级86例;肿瘤最大直径≤10 cm;肿瘤数≤3个。所有患者及其家属在术前均明确知晓本研究采用的治疗方式并签署知情同意书。
纳入标准:①符合《原发性肝癌诊疗指南(2022年版)》相关标准[8];②均签署知情同意书;③为第一次接受TACE治疗;④具有完整的临床资料及一般信息。排除标准:①合并先天性免疫、血液功能障碍;②合并精神系统类疾病;③对本研究治疗方式有禁忌证;④随访过程中失访者。
二、方法
(一) TACE治疗方式 采用股动脉穿刺置管在DSA下根据肿瘤部位与供血动脉位置,将微导管置入肝两端的动脉及远处肿瘤供血动脉;按照顺铂80 mg、超液化碘油3~20 mL、吡柔比星20 mg的顺序依次灌注栓塞肿瘤血管;至肿瘤内碘油浓聚时,取适当的明胶海绵颗粒对肝端进行栓塞;DSA下复查,证实肿瘤染色消失,记录超液化碘油的注入量;根据肿瘤直径选用超液化碘油(最大量≤20 mL);术后给予甘美0.2 g,连续静脉滴注6 d。
(二)血清GP73检测 电化学发光发检测GP73:取待测样品放入离心机(北京时代北利离心机有限公司)中以3500 r/min,离心半径15 cm离心5 min,用吸管吹打搅拌红细胞,进行人为溶血处理,在继续将溶血标本放入离心机中以同样的离心参数离心5 min,直至溶血标本呈现淡红色,放入电化学发光免疫分析仪(德国罗氏公司)中检测GP73并取峰值。
(三)血清FOXP3检测 采用Elisa对血清FOXP3表达进行检测,操作步骤如下:①配置标准曲线,分别设8个不同浓度水平(124、100、62、28.3、15、8.54、2.94、1.46)PM的标准曲线外加空白样品,体积可根据需要的比例随时调整;②配制质控样品及待测样品,并在每孔中按照版图加入配置好的标准曲线、质控样品及待测样品各25 μL;③每孔加入200 μL Enzyme Conjugate solution,封板孵育;④采用洗板液350 μL连续洗板6次,避免长时间浸泡,洗板后在洁净纸上拍打至干;⑤每孔加入200 μL substrate TMB,室温避光条件下反应;⑥各孔中加入50 μL 终止液并在15 min内使用波长为450 nm的酶标仪(湖南中瑞互信医疗科技有限公司)读取吸光度,分析FOXP3水平。
(四)疗效评估[9]术后4周,CT观察肿瘤双径及病灶碘油量,按照疗效标准分为完全缓解(CR)、部分缓解(PR),疾病稳定(SD),疾病进展(PD)。有效率=(CR+PR)/人数×100%。
(五)预后评估 采用电话、门诊等方式随访,每3个月1次,末次随访时间为2022年8月,主要终点为总生存期(overall survival,OS),次要终点为无进展生存期(progression free survival,PFS)。
三、统计学处理
SPSS 25.0统计软件进行数据分析。正态分布的计量资料以均数±标准差表示,组间采用独立样本t检验,组内采用配对样本t检验。计数资料以例数(%)表示,比较采用χ2检验。Spearman相关系数验证GP73、FOXP3表达与临床疗效的相关性;多元logistic回归模型分析影响HCC患者预后的独立危险因素;ROC验证GP73、FOXP3联合检测对HCC患者预后的评估效能。P<0.05为差异有统计学意义。
结 果
一、有效组与无效组患者GP73、FOXP3表达比较
共有122例患者治疗有效,76例患者治疗后无效;治疗前,两组患者GP73和FOXP3表达无显著差异(P>0.05);治疗后两组GP73和FOXP3表达均有所降低,且相较于无效组,有效组表达明显更低(P<0.05),见表1。
表1 有效组及无效组TACE治疗前后GP73、FOXP3表达(±s)
二、GP73、FOXP3表达与临床疗效的相关性
Spearman相关检验结果显示,GP73、FOXP3表达与临床疗效之间均呈显著负相关(r=-0.662、-0.688,P<0.05)。
三、单因素分析HCC患者预后的影响因素
随访结果显示,预后良好患者共104例,预后不良者94例。单因素结果显示,预后良好组GP73、FOXP3、甲胎蛋白表达显著低于预后不良组,且Child-Pugh分级中A级占比显著高于预后不良组(均P<0.05),见表2。
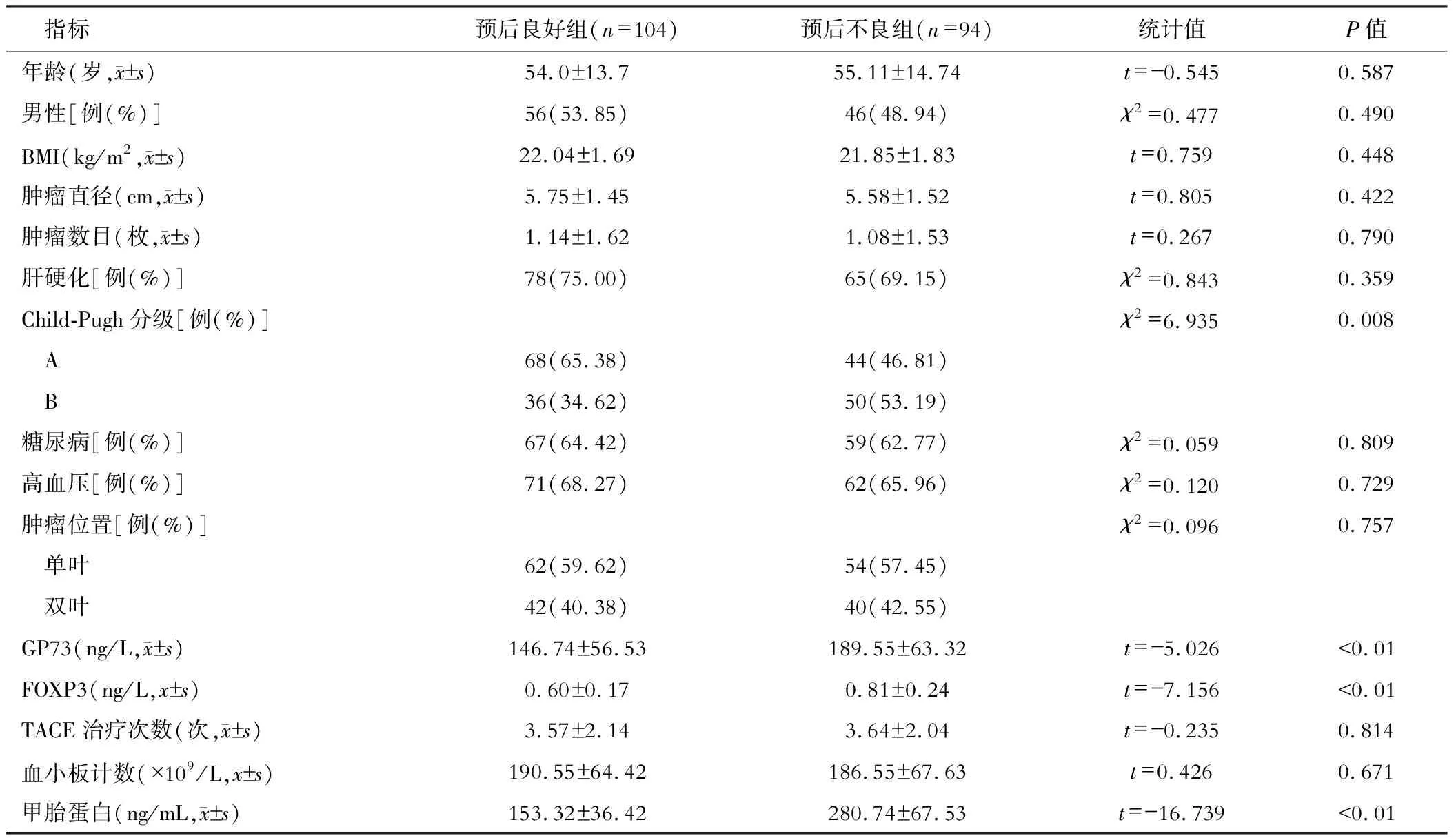
表2 单因素分析影响HCC患者预后的相关因素
四、多因素分析HCC患者预后的影响因素
将表2中差异有统计学意义的指标纳入多元logistic回归模型中进行分析,以HCC患者预后作为因变量(预后良好=0;预后不良=1),所有计量资料均以原值录入,计数资料赋值:Child-Pugh分级(A级=0;B级=1)。结果显示Child-Pugh分级、GP73、FOXP3是影响HCC患者预后的危险因素,见表3。
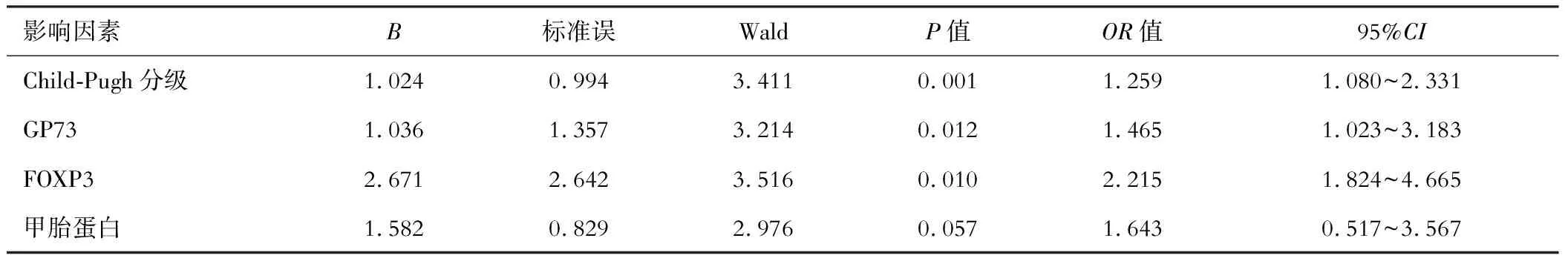
表3 多因素分析影响HCC患者预后的独立危险因素
五、GP73、FOXP3联合检测对HCC患者预后的预测效能
GP73、FOXP3联合检测的曲线下面积显著高于单一检测(联合检测与GP73比较,Z=4.416,与FOXP3比较,Z=5.660,均P<0.01),且具有较高的敏感度、特异度,见表4。
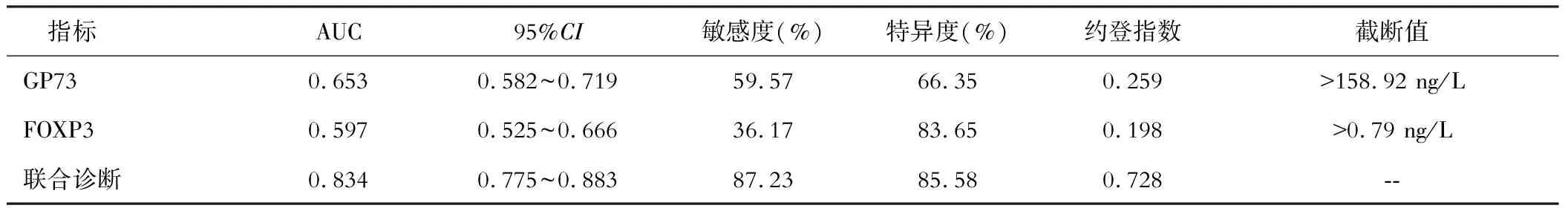
表4 GP73、FOXP3和联合检测的诊断效能
讨 论
HCC进展快、恶性程度高,患者5年病死率可高达30%~40%[10]。TACE主要通过阻断肿瘤细胞的营养供应从而消灭肿瘤,在一定程度上提高了HCC患者的疾病控制率与生存率[11,12]。但对于直径较大的肿瘤,经TACE治疗后呈乏血状态,对动脉影响较大,导致其出现狭窄甚至闭塞,影响治疗效果[13]。
本研究结果显示,HCC患者经过TACE治疗后GP73、FOXP3表达均有所下降,但相比无效组,有效组GP73、FOXP3表达更低。应用吡柔比星能够阻碍血管内皮细胞DNA形成,超液化碘油和明胶海绵两种混合物注入肝血管瘤中,可促使成纤维瘤样结构在瘤体形成,达到硬化血管瘤的作用,从而降低血清相关标志物的表达[14]。闫伟等[15]研究发现,经TACE治疗后,HCC患者血清免疫炎症相关因子均得到明显改善。
本研究发现,GP73、FOXP3表达与临床疗效之间均呈显著负相关,即GP73表达越低,经TACE治疗的HCC患者疗效越好;且GP73作为影响HCC患者远期预后的危险因素之一,与HCC患者疗效及预后均具有强关联性。这主要是由于GP73作为Ⅱ型跨膜蛋白,在正常人体肝脏组织中无表达。Fang等[16]研究显示,GP73表达水平与肝脏肿瘤分期、分化程度等并不具有相关性,但与血管内皮生长因子具有强关联性,分析原因可能是病数量差异较大,导致结果也呈现一定差异,后续仍需进一步进行相关研究。Liu等[17]指出,上皮-间质转化(epithelial-mesenchymal transition,EMT)作为肿瘤细胞运动侵袭能力的基础,其对GP73进行干扰后可通过影响EMT进程而阻碍HCC进程。
FOXP3与临床疗效呈负相关,是HCC远期预后的独立危险因素,参与HCC疾病发生、发展,FOXP3是位于哺乳动物X染色体的一类转录因子,可作为调节性T细胞的特异性标志物,特异性表达CD4+CD25+T细胞并在炎性介质的刺激下发挥与调节性T细胞的相同作用[18]。Zhang等[19]研究发现,FOXP3能够促进调节性T细胞发育,间接紊乱肿瘤局部免疫功能,并减轻肿瘤微环境中抗肿瘤免疫功能,从而加重病情,但FOXP3在人体内调控其他基因表达的机制尚未明确。通过对胆红素、肝性脑病、腹水、营养状况、Alb对患者的肝功能进行评估,Child-Pugh B级的HCC患者肝功能较差,预后也相对较差[20]。GP73、FOXP3单一指标检测的敏感度、特异度较低,但二者联合检测能够大幅提升对HCC患者预后的评估效能,说明联合GP73、FOXP3能够作为有效的血清生物学指标辅助评估HCC患者预后。
利益冲突声明:所有作者均声明不存在利益冲突。