柴胡皂苷A 对噪音诱发耳鸣小鼠抑郁的干预作用及机制
张 艳 ,赵浩杰 ,段明志 ,段静燕 ,杨雪艳
(1)保山市人民医院耳鼻喉科;2)肿瘤科;云南 保山 678000;3)保山中医药高等专科学校,云南 保山 678000)
耳鸣(Tinnitus)是指无相应的外界生源刺激下,患者却可以感受到耳内或颅内产生持续或间断性声音的主观感觉[1]。耳鸣的发生机理可以分为主观性耳鸣和客观性耳鸣。其中,客观性耳鸣较为少见,是由内部生物源性声音引起的,可以通过仪器检测或被其他人听到,这种耳鸣具有确切的生源,通常与中耳或脑部血管发育异常等相关;主观性耳鸣的发生率较高,是指缺乏相应生源的耳鸣,也是平常所指耳鸣,与中耳炎、噪声暴露、听觉通路肿瘤、神经系统疾病等相关[2]。耳鸣的患病率较高,国外数据统计显示成年人中约有10.1%的人患有耳鸣[3],而在我国成年人中约有11.4%的人患有耳鸣,且患病率随着年龄的增加而升高[4]。耳鸣可能导致患者出现注意力不集中、失眠、焦虑、易怒、抑郁、恐惧等严重的精神症状,甚至可能会引起自杀。这些负面情绪会进一步使患者对耳鸣更加敏感,形成恶性循环,导致患者出现精神和行为异常[5]。目前临床尚无有效治疗耳鸣的药物,因此探究耳鸣的发病机制对治疗耳鸣有重要意义。噪声是世界上公认的危害之一,其可通过损伤听觉系统等多个系统影响人的听觉和记忆能力等多方面的功能[6]。柴胡的主要有效成分之一是柴胡皂苷A(saikosaponin A,SSA),其具有多种药理活性,如抗炎、抗肿瘤、抗氧化等作用。近年对SSA 的研究主要集中在抗癫痫、抗抑郁和抗炎等研究,而癫痫和抑郁的发病与炎症因子密切相关[7],体内研究发现SSA 可通过抑制核因子κB(nuclear factor kappa B,NF-κB)信号通路发挥较强的抗炎活性[8],但目前关于SSA能否通过影响炎症因子对耳鸣小鼠发挥治疗作用鲜有报道,因此本研究从实践角度出发,用噪音诱导耳鸣小鼠模型探究,探究SSA 对耳鸣小鼠的干预作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物7~8 周龄,50 只听力正常的C57BL/6 雄性小鼠,体质量18~20 g,动物均购自成都达硕实验动物实验公司,许可证号为:SCXK(川)2013-0024。小鼠均分笼饲养于统一的动物房内,温度21~25 ℃,相对湿度50%~60%,光照12 h/12 h 昼夜交替,自由摄食饮水。本研究经保山市人民医院动物伦理委员会审批通过(20220012)。
1.1.2 试剂和仪器柴胡皂苷A(SSA 化学结构见图1,质量分数 > 98%,批号:130301,美国Sigma-Aldrich 公司);IL-1β、IL-6、TNF-α 抗体(美国Cell signaling technology 公司);惊跳反射实验系统(美国Med Associates 公司);音响(HARMAN International 公司);视频行为学分析系统(美国HAVARD APPARAUTUS panlab 公司);超净工作台(新加坡艺思高科技有限公司)。
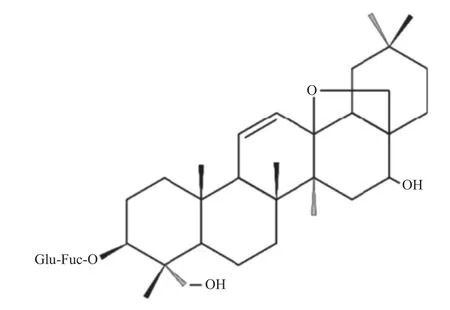
图1 SSA 化学结构Fig.1 SSA chemical structure
1.2 方法
1.2.1 分组和模型制备[9]将50 只小鼠随机分为对照组(Control 组)10 只和造模组40 只。将造模组40 只小鼠制备噪音诱发耳鸣小鼠模型,将造模组小鼠均置于标准隔音室内,采用100 dB SPL 的宽频带噪声(broadband noise,BBN)进行噪声单次暴露2 h;为了避免实验动物在暴露期间相互影响入耳声强以及相互撕咬,将小鼠分别放置在长4.5 cm、宽4.5 cm、高8 cm 的铁丝笼内,在不影响声音传播的同时小鼠能自由活动。将音响放在笼子前方进行实验。造模成功标准:出现头部摇晃、耳朵抖动、耳朵摩擦等耳鸣行为。Control 组小鼠置于相同的金属笼中,并于标准隔音室内放置2 h,但关闭扬声器。实验结束各组小鼠均分笼饲养并进行后续检测。
造模成功后将40 只小鼠随机分为4 组,即噪音诱发耳鸣小鼠模型组(BBN 组)、BBN 组基础上分别灌胃10 mg/kg、20 mg/kg、40 mg/kg 的柴胡皂苷A 干预,分别设为SSA-L 组、SSA-M 组和SSAH 组,每组10 只。Control 组和BBN 组小鼠均灌胃等量的生理盐水。各组小鼠均每次灌胃1 次,连续灌胃28 d。
1.2.2 耳鸣行为学检测各组小鼠分别于噪声暴露2 h 后3 d、14 d、28 d 时进行耳鸣行为学测定。在进行前间隙抑制听觉惊跳反应(gap prepulse inhibition of acoustic startle response,GPIAS)实验之前,需要先让小鼠在透明盒子中适应10 min。实验过程中,将每只小鼠放置在一个透明盒子中,并将盒子放置在灵敏的压电传感器上。通过检测小鼠肌肉动作幅度的波形,自动计算出相应的波幅,以进行实验。GPIAS 实验包括30 次有间隙试验(gap 试验)和30 次无前间隙试验(no gap 试验)采用随机配对法消除有前间隙试验和无前间隙试验偏差。耳鸣行为学检测以GPIAS 抑制率作为检测指标,即
1.2.3 焦虑抑郁样行为评估[10]每只小鼠于给药后1 d,分别采用旷场实验、高架十字迷宫实验、强迫游泳实验来评估各组小鼠的焦虑抑郁情绪。实验前1 h 将测试小鼠单笼单只放置于测试室内以适应环境,全部行为测定结束后将小鼠放回原始笼中。
(1)旷场实验:制备5 个相同大小、内壁及底部均为白色的矿场箱,长宽均为45 cm,高为30 cm。将矿场仪器放于灯的正下方,面向箱壁将小鼠放于不同的矿场箱内中央与周围区交界处,让小鼠在矿场内自由活动10 min。取出测定后的小鼠放回笼内,将小鼠的排泄物清理干净。矿场箱底部为25 个正方形,中间9 个正方形为中央区,采用视频行为学系统采集并记录小鼠进入中央区时间及在中央区距离。
(2)高架十字迷宫实验:高架十字迷宫由2 条开放臂、2 条闭合臂和1 个联合4 条臂的中央区平台组成,形状呈十字形,各面均为白色。每个臂和平台的距离为50 cm。为确保亮度相等,高架被置于灯的正下方,避免阴影。在测试中,将小鼠背对实验员放置在中央区,面对其中一条开放臂。然后,让小鼠在高架内自由活动5 min。测试结束后,将小鼠放回笼子中,并清理高架上的分泌物。在进行下一轮测试前,使用酒精擦拭干净高架各部分。记录小鼠进入开放臂次数及在开放臂的时间。
(3)强迫游泳实验:进行小鼠强迫游泳测试时,需要使用直径为16 cm、高为30 cm 的2 个玻璃烧杯,并在每个杯子加入温度为28 ℃的水,深度达20 cm。然后将小鼠放置在其中1 个烧杯内,确保小鼠可以直立在水中,但尾巴不触及杯底。观察小鼠是否漂浮或摆动,并保持其头部浮在水面,仅单下肢微颤状态。借助手动计数器,在5 min 内记录小鼠的不动时间。测试结束后将小鼠擦拭干净后放回笼中。
1.2.4 ABR 阈值测定各组小鼠于药物干预结束后36 h 测定听力。进行小鼠ABR 阈值测试时,先在麻醉状态下将记录电极放置于颅顶皮下、参考电极放置在右耳乳突部皮肤下,接地电极放置在左耳同一位置。然后使用耳机依次刺激click 声、8 kHz、16 kHz 和32 kHz 的纯音,从70 dB 开始每降低10 dB,并在阈值附近改为5 dB 递减。测定前五个波中最后一个消失的波确定阈值,并将被消失时的声强数值与上一个仍有波的声强数值取平均值作为阈值。在测定过程中要保持小鼠体温并确保其舒适度。
1.2.5 RT-qPCR 检测小鼠听觉皮层中IL-6、TNF-α 和IL-1β mRNA 表达3%戊巴比妥钠腹腔注射30 mg/kg 麻醉小鼠,断头处死小鼠,取听觉皮层组织研磨,加入1 mL TRIzol 裂解液裂解,提取裂解后细胞和组织中总RNA,提取步骤按照试剂盒说明书进行。根据逆转录试剂盒说明书将总RNA 逆转录为cDNA。瞬时离心各引物(引物序列见表1),在引物中加入去离子水并制成100 µmol/L 的液体,稀释引物终浓度为10 µmol/L。按照以下条件扩增引物,预变性95 ℃ 5 min;变性95 ℃ 10 s;退火60 ℃ 20 s;延伸72 ℃ 10 min;共30 个循环。用2-△△CT法分析表达量。

表1 引物序列Tab.1 Primer sequence
1.2.6 Western blot 检测小鼠听觉皮层中IL-6、TNF-α 和IL-1β 蛋白表达麻醉并处死小鼠,取听觉皮层组织,提取组织中总蛋白,用BCA 法检测总蛋白浓度。将蛋白溶液的终浓度配制为2 µg/mL,将蛋白溶液置于热水中煮沸10 min,后保存在-20 ℃冰箱中。将30 µg 的蛋白样品用200 V电压电泳,通过电转的方式将SDS-PAGE 分离胶中的蛋白质转移到PVDF 膜上,用5%脱脂奶粉封闭PVDF 膜1 h,将一抗IL-6、TNF-α、IL-1β(1∶1 000)加入到PVDF 膜上,4 ℃孵育过夜;将PVDF 膜冲洗干净后加入二抗(1∶1 000),室温孵育2 h。ECL 发光液加入到细胞中,曝光显影后用Image Lab 软件分析条带灰度值。
1.3 统计学处理
实验数据使用Graphpad priam 8.0 软件进行统计学分析,并用均数±标准差()表示计量资料。针对不同组间的数据,采用单因素方差(oneway ANOVA)分析来进行统计学比较。同时使用LSD-t检验来比较组间两两比较的差异。根据实验结果,若P<0.05,则表示差异具有统计学意义。
2 结果
2.1 各组小鼠耳鸣行为学比较
和Control 组相比,BBN 组小鼠在噪声暴露2 h后3 d、14 d 和28 d 时GPIAS%值降低(P<0.05);和BBN 组相比,SSA-L 组、SSA-M 组和SSA-H组小鼠在噪声暴露2 h 后3 d、14 d 和28 d 时GPIAS%值升高,且呈剂量依赖(P<0.05),见表2。
表2 各组小鼠噪声暴露2 h 后不同时间节点中GPIAS%值比较(,n=10)Tab.2 Comparison of GPIAS% values at different time points after 2-hour noise exposure in each group of mice(,n=10)
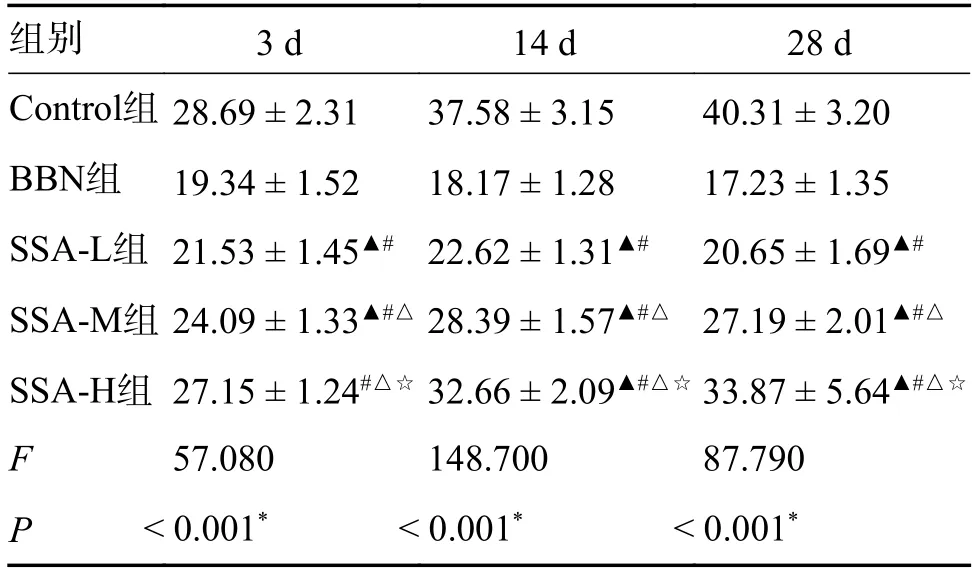
表2 各组小鼠噪声暴露2 h 后不同时间节点中GPIAS%值比较(,n=10)Tab.2 Comparison of GPIAS% values at different time points after 2-hour noise exposure in each group of mice(,n=10)
*P<0.05;与Control组相比,▲P<0.05;与BBN组相比,#P< 0.05;与SSA-L组相比,△P<0.05;与SSA-M组相比,☆P <0.05。
2.2 各组小鼠进入中央区时间和进入中央区距离比较
和Control 组相比,BBN 组小鼠进入中央区时间和进入中央区距离均缩短(P<0.05);和BBN 组相比,SSA-L 组、SSA-M 组 和SSA-H 组小鼠进入中央区时间和进入中央区距离均增加,且呈剂量依赖(P<0.05),见图2。
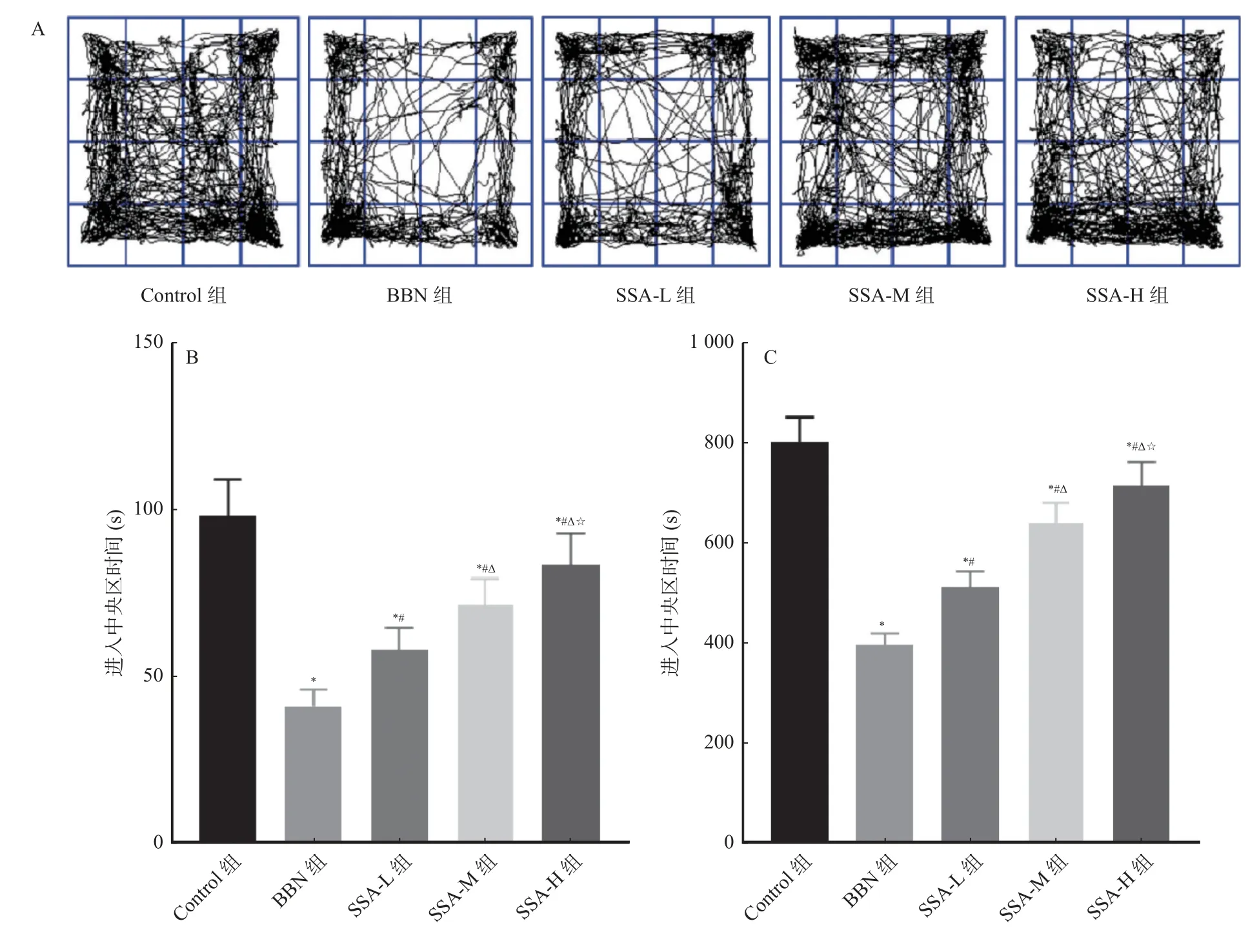
图2 各组小鼠进入中央区时间和进入中央区距离比较Fig.2 Comparison of the time and distance of mice entering the central region in each group
2.3 各组小鼠进入开放臂次数及进入开放臂的时间比较
和Control 组相比,BBN 组小鼠进入开放臂次数和时间均减少(P<0.05);和BBN 组相比,SSAL 组、SSA-M 组和SSA-H 组小鼠进入开放臂次数和时间均增加,且呈剂量依赖(P<0.05),见图3。
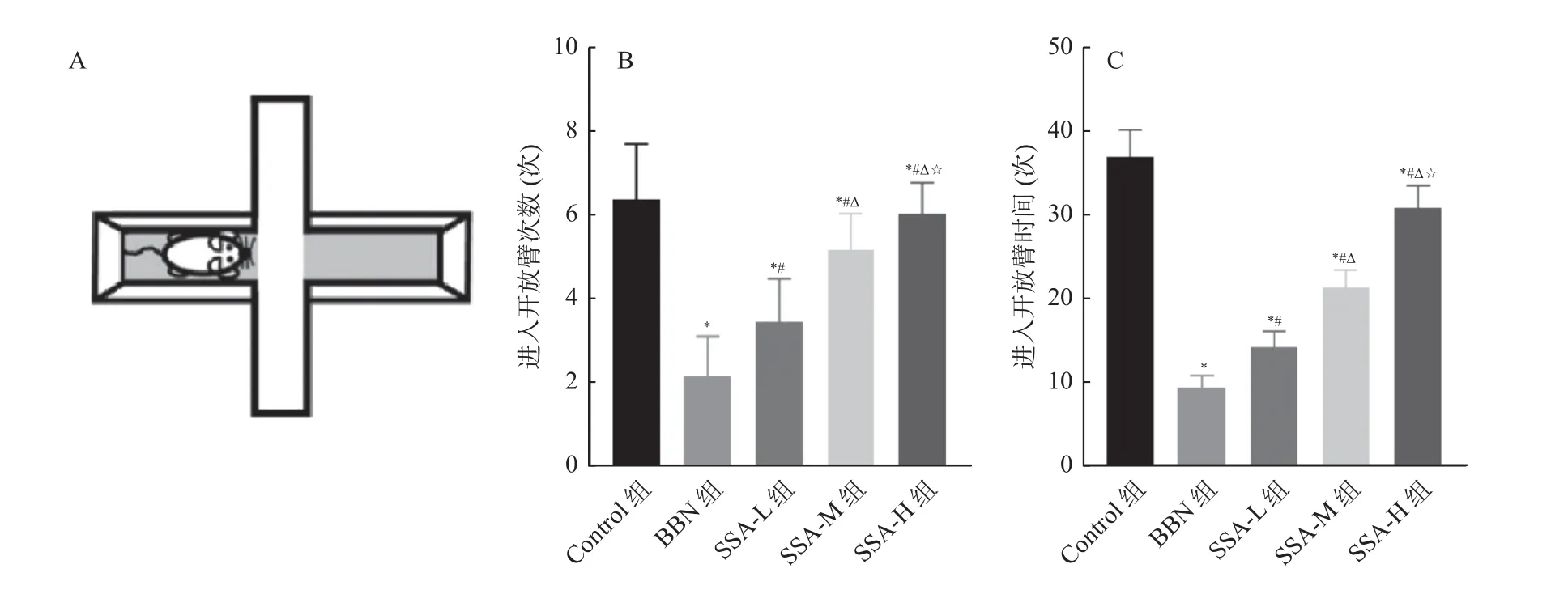
图3 各组小鼠进入开放臂次数及进入开放臂的时间比较Fig.3 Comparison of the number of times and time of mice entering the open arm in each group
2.4 各组小鼠强迫游泳实验不动时间比较
和Control 组相比,BBN 组小鼠不动时间增加(P<0.05);和BBN 组相比,SSA-L 组、SSAM 组和SSA-H 组小鼠不动时间均减少,且呈剂量依赖(P<0.05),见图4。
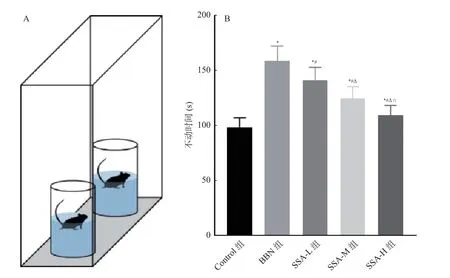
图4 各组小鼠强迫游泳实验不动时间比较Fig.4 Comparison of immobility time in forced swimming experiments of mice in each group
2.5 各组小鼠ABR 阈值改变比较
和Control 组相比,BBN 组小鼠在Click 和8、16、32 kHz 声刺激下ABR 阈值均升高(P<0.05);和BBN 组相比,SSA-L 组、SSA-M 组和SSA-H组小鼠在Click 和8、16、32 kHz 声刺激下ABR阈值均降低(P<0.05),见图5。
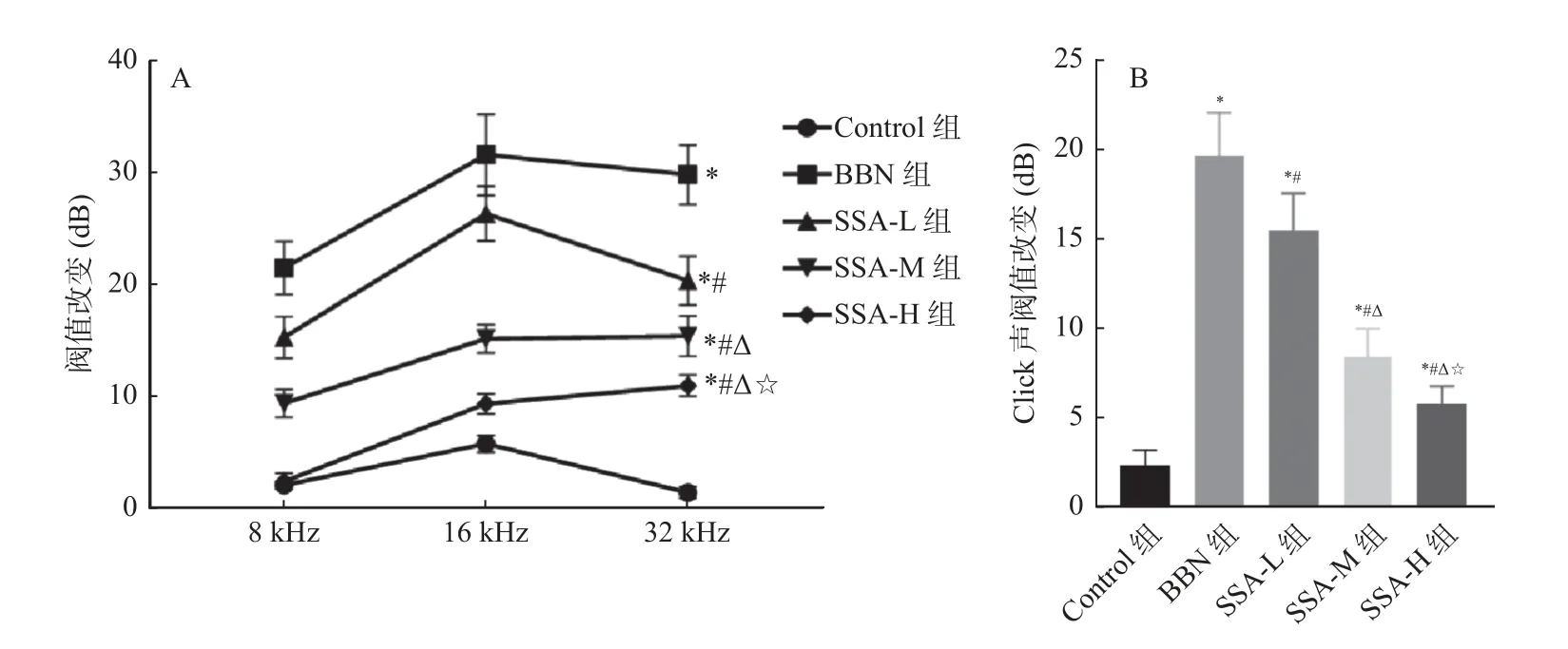
图5 各组小鼠在Click 和8、16、32 kHz 声刺激下ABR 阈值改变Fig.5 Changes in ABR threshold of mice in each group under Click and 8,16,and 32 kHz sound stimulation
2.6 各组小鼠听觉皮层中IL-6、TNF-α 和IL-1β mRNA 表达比较
和Control 组相比,BBN 组小鼠听觉皮层中IL-6、TNF-α 和IL-1β mRNA 表达均升高(P<0.05);和BBN 组相比,SSA-L 组、SSA-M 组和SSA-H 组小鼠听觉皮层中IL-6、TNF-α 和IL-1β mRNA 表达均降低,且呈剂量依赖(P<0.05),见图6。
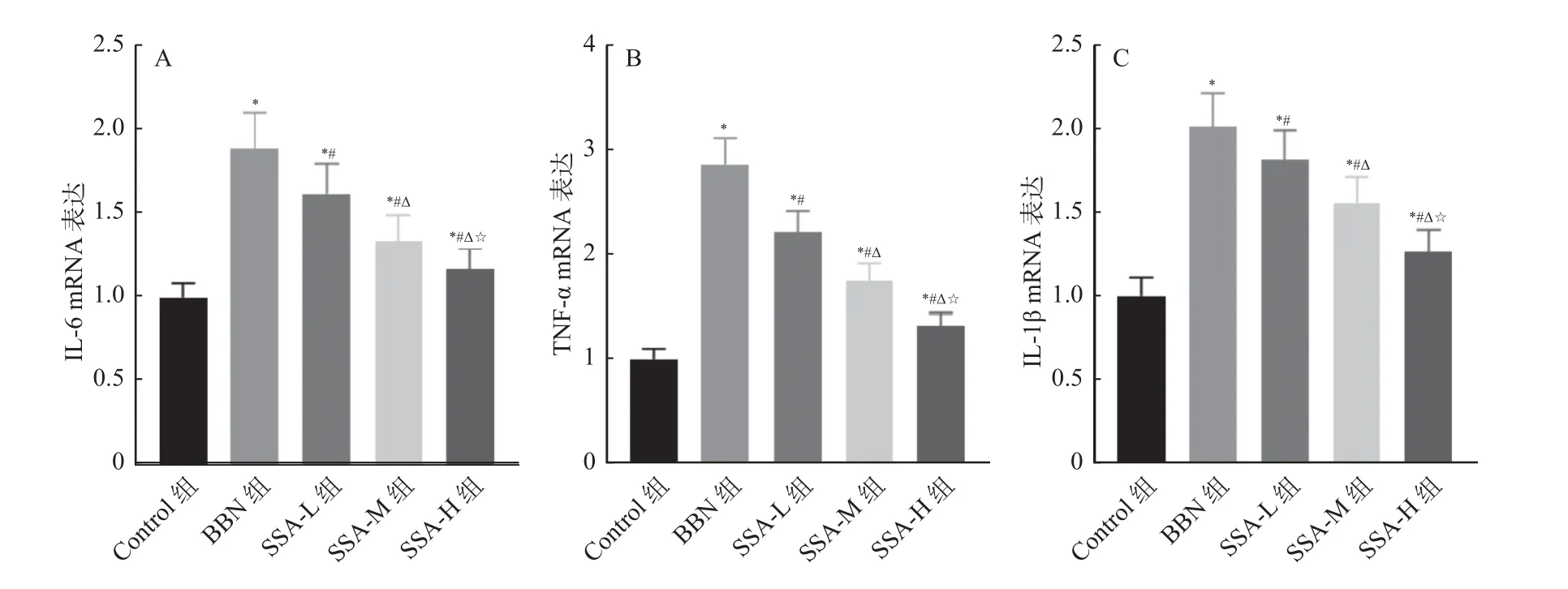
图6 各组小鼠听觉皮层中IL-6、TNF-α 和IL-1β mRNA 表达比较Fig.6 IL-6 and TNF in the auditory cortex of mice in each group-α And IL-1 β MRNA expression comparison
2.7 各组小鼠听觉皮层中IL-6、TNF-α 和IL-1β 蛋白表达比较
和Control 组相比,BBN 组小鼠听觉皮层中IL-6、TNF-α、IL-1β 蛋白表达均升高(P<0.05);和BBN 组相比,SSA-L 组、SSA-M 组和SSA-H组小鼠听觉皮层中IL-6、TNF-α、IL-1β 蛋白表达均降低,且呈剂量依赖(P<0.05),见图7。

图7 各组小鼠听觉皮层中IL-6、TNF-α、IL-1β 蛋白表达比较Fig.7 IL-6 and TNF in the auditory cortex of mice in each group-α、IL-1 β Comparison of protein expression
3 讨论
耳鸣是由多种因素共同作用的一种疾病,其患病率较高,目前临床的治疗方案效果不显著且治愈率较低,严重影响患者的心理健康和生活质量[11]。目前,噪声已成为导致青少年和大学生出现耳鸣的常见因素之一。宽频白噪声是人们日常生活中接触最多的一种噪声类型,因其以较均匀分布的能量播放所有频率而备受关注。利用噪声诱导耳鸣动物模型结合GPIAS 检测方式,可更有效地模拟人类耳鸣,降低训练时间成本,同时不对动物造成损伤,因此该方法可相对可靠地反应动物是否出现耳鸣行为[12]。本研究中采用了100 dB SPL 白噪声环境中单次暴露2 h 后,发现了小鼠在3 d、14 d 和28 d 时间节点时GPIAS%值较Control组均降低,提示造模成功。100 dB SPL 宽频噪声诱发的耳鸣行为更显著,可在毛细胞和听觉中枢上产生明显变化,从造模角度证明这类噪声有利于构建稳定、便捷的耳鸣动物模型,同时可有效节约时间。唐薇等[13]研究证实,100 dB SPL 宽频带白噪声可能更适合高效、便捷地构建噪声性耳鸣动物模型,且噪声可能通过上调GAP-43 表达介导耳鸣的发生发展。
作为中国传统中药材之一,柴胡历史悠久,并可根据形状分为南柴胡和北柴胡。其具有多种功效,如和解少阳、疏肝解郁、热血入室等。柴胡主要药理活性成分包括柴胡皂苷A、B、C、D,其中柴胡皂苷A 具有较好的抗癫痫、抗抑郁和抗炎作用[14]。近年来发现[15],尽管耳鸣的发病率较高,但只有少数患者(不到20%)会对其适应不良而严重影响生活质量,导致焦虑和抑郁等精神情绪障碍。本研究通过旷场实验、高架十字迷宫实验、强迫游泳实验来评估小鼠的焦虑抑郁情绪,结果发现耳鸣小鼠有明显的抑郁行为、且听力受到明显损伤,柴胡皂苷A 干预后发现,小鼠的GPIAS%值、进入中央区时间、进入中央区距离、进入开放臂次数和时间均增加,小鼠不动时间及在Click 和8、16、32 kHz 声刺激下ABR 阈值均减少,提示柴胡皂苷A 可明显改善耳鸣小鼠的抑郁行为,保护耳鸣小鼠听力。研究发现[16],柴胡皂苷A 可以抑制利血平诱导的抑郁小鼠表现出的怠倦和上睑下垂的现象。吴启洋等[17]在强迫游泳实验和悬尾实验中发现,SSA 可以明显改善表现绝望行为的抑郁小鼠,从而缓解其抑郁症状。
炎症是一种免疫反应,通常是身体对伤害或感染的反应,其可导致身体产生一系列化学物质,包括炎症因子,如细胞因子、趋化因子和炎症介质。这些炎症因子会引发免疫反应,促使白细胞和其他免疫细胞进入炎症部位,以清除病原体或修复受损组织。近年来研究发现[18],炎症因子与耳鸣的发病机制可能存在一定的关联。炎症反应可以引发神经炎症,导致神经元的损伤或异常兴奋,可能会引起耳鸣的发生。此外,一些研究表明,炎症因子的产生和释放可能与听觉系统的功能失调相关。Tetteh 等[19]在对一项慢性耳鸣患者的研究发现,放松训练可显著减少患者的焦虑抑郁和耳鸣,这些症状的减轻和血清中TNF-α、IL-6 等减少密切相关。目前,对于柴胡皂苷A 治疗抑郁的机制研究主要关注于其对神经炎症的抑制以及对脑源性神经营养因子、神经递质和神经内分泌的调节。在抑郁过程中,抗炎性细胞因子和前炎性细胞因子都对其产生影响。其中,前炎性细胞因子如IL-1β、IL-6、TNF-α 等,在抑郁发病中起着重要的作用。研究表明[20],SSA 可通过抑制海马区IL-1β、IL-6、TNF-α 等表达发挥抗抑郁作用,表明SSA 抗抑郁的机制可能是通过介导围绝经期海马的神经炎症介导的。本研究结果显示,耳鸣小鼠听觉皮层中IL-6、TNF-α、IL-1β mRNA 和蛋白表达均升高,提示耳鸣小鼠存在神经炎症,和上述研究结果一致;经过柴胡皂苷A 干预后发现,耳鸣小鼠听觉皮层中IL-6、TNF-α、IL-1β mRNA 和蛋白表达均降低,提示柴胡皂苷A 可抑制耳鸣小鼠神经炎症,进而改善耳鸣小鼠抑郁行为。
综上所述,柴胡皂苷A 可改善耳鸣小鼠抑郁行为,对耳鸣发挥治疗作用,其可能和抑制耳鸣小鼠听觉皮层炎症因子密切相关。由于时间和成本等因素,本研究未能给予阳性药物进行干预,仅设置了和对照组比较,使文章的结果可能存在一定的局限性,在今后的研究中会增加相关的阳性对照分组,从而为临床治疗提供更真实有效的实验依据。

