柴胡总皂苷的大鼠体内代谢特征谱研究
王雅芝,王晓宁,张 艳,段灿灿,张建永
(1.遵义医科大学 药学院药物分析学教研室,贵州 遵义 563099;2.遵义医科大学 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099)
柴胡为传统中药,《中国药典》2020年版规定其为伞形科植物柴胡(北柴胡)BupleurumchinenseDC.或狭叶柴胡(南柴胡)Bupleurumscorzonerifoliumwilld.的干燥根,具有疏散退热,疏肝解郁,升举阳气等功效[1]。研究发现,柴胡中主要含有皂苷、黄酮、挥发油及多糖等化学成分[2-3],其中,柴胡皂苷是柴胡的主要活性成分群,是柴胡质量评价和控制的主要指标性成分[4]。现代药理学发现,柴胡及柴胡皂苷类成分具有解热、抗炎、抗肿瘤、保肝、免疫调节等生物活性[2-3,5]。目前现有含柴胡的成方制剂549个[6],如小柴胡颗粒、柴胡舒肝丸、小柴胡泡腾片等[7],这些成方制剂的主要给药方式为口服,探索其成分在体内的吸收情况,对于揭示柴胡皂苷类成分发挥药效的物质基础很有必要。
肠道是口服药物的主要吸收部位,有文献报道柴胡皂苷在酸碱环境、肠道菌群代谢等条件下极易水解,造成其生物利用度较低[8-11]。由此推测,柴胡皂苷类成分发挥药效的关键成分可能为原型化合物和肠道代谢产物。因此,本实验以柴胡总皂苷提取物为研究对象,运用UPLC-MS/MS技术,通过比较大鼠肠吸收成分、肠代谢的入血成分和肝代谢的血中成分的化学成分特征谱,分析其体内发挥药效的关键成分,为深入研究柴胡的药效物质提供新的依据。
1 材料与方法
1.1 仪器 Thermo QE Orbitrap高分辨质谱仪;Thermo UltiMate 3000超高效液相色谱仪(美国Thermo Fisher公司);离体肠灌流装置、数控恒温循环水槽(上海奥尔科特生物科技有限公司);超声仪(昆山舒美超声仪器有限公司);高速离心机(德国 Eppendorf 公司);多管涡旋振荡器(上海净心实业发展有限公司);电子天平(波兰 RADWAG 公司);混合氧气瓶(贵州望江气体有限公司)。
1.2 药材和试剂 柴胡药材由山西振东道地药材公司提供,经山西医科大学高建平教授鉴定为伞形科植物柴胡(北柴胡)BupleurumchinenseDC.的干燥根,晾干后粉碎,保存于阴凉干燥处。
乙腈(色谱纯,默克化工技术(上海)有限公司);甲醇(色谱纯,上海麦克林生化科技有限公司);甲酸(LC/MS,美国Fisher scientific公司);水(杭州娃哈哈集团有限公司)。
1.3 实验动物 SPF级SD大鼠15只,雄性,体重(230±20)g,由辽宁长生生物技术股份有限公司提供,许可证编号为SCXK(辽)2020-0001。实验动物饲养于遵义医科大学实验动物中心SPF级实验室,实验设施合格证编号为SYXK(黔)2021-0004,自由饮食,光照12 h明暗交替,相对湿度45%~55%,室温21~25 ℃。按照遵义医科大学实验动物饲养管理条例,并经过遵义医科大学实验动物伦理委员会审批,审批编号为ZMU21-2206-007。
1.4 UPLC-MS/MS分析条件
1.4.1 色谱条件 色谱柱:Waters ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm);柱温:50 ℃;流速:0.35 mL/min;进样体积:5 μL;流动相A:水(含6.5 mM碳酸氢铵);流动相B:95%甲醇水(含6.5 mM碳酸氢铵);梯度洗脱程序:(0~1 min,5% B;1~18 min,5%~100% B;18.1~22 min,100% B;22.1~25 min,5% B)。
1.4.2 质谱条件 应用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱技术(UPLC-QE-Orbitrap HRMS),采用加热电喷雾离子源(HESI),在Negative模式下,采用一级全扫描+DDA二级子离子扫描。喷雾电压:-3.0 kV;毛细管温度:320 ℃;辅助器加热温度:350 ℃;护套气体流量:35 Arb;辅助气体流量:8 Arb;S-透镜射频水平:50;分辨率:17500。
1.4.3 Tyrode液的配制 称取氯化钠(NaCl)8.0 g、氯化钾(KCl)0.2 g、氯化镁(MgCl2)0.1 g、碳酸氢钠(NaHCO3)1.0 g、磷酸二氢钠(NaH2PO4)0.05 g加500 mL蒸馏水溶解,氯化钙(CaCl2)0.2 g加500 mL蒸馏水溶解后混匀,再加入葡萄糖1.0 g即得。
1.4.4 柴胡总皂苷提取液的制备 参照文献中柴胡总皂苷的制备方法[12],称取北柴胡药材100 g,粉碎后加入8倍量80%乙醇浸泡1 h,回流提取3次,每次提取2 h,合并提取液,滤过,回收乙醇至无醇味,加水分散,旋转蒸发仪浓缩后,真空干燥箱中60 ℃烘干,即得柴胡总皂苷提取物。
柴胡总皂苷Tyrode液的制备:精密称取柴胡总皂苷提取物适量,加Tyrode液配得质量分数为8 g/mL的药液(按柴胡生药量计),备用。
柴胡总皂苷灌胃液的制备:精密称取柴胡总皂苷提取物适量,用0.1%羧甲基纤维素钠水超声溶解制得灌胃液,其质量浓度为8 g/mL(按生药量计),备用。
1.5 样品的采集
1.5.1 血浆样品的采集 取健康的9只雄性SD大鼠,随机分为3组(空白组,肝门静脉取血组,腹主动脉取血组),每组3只,适应性喂养一周后,禁食12 h,以200 mg/kg的剂量大鼠灌胃柴胡总皂苷灌胃液,期间自由饮水。在给药0.5 h时,分别在肝门静脉、腹主动脉取血,置于含0.1%肝素钠的EP管中,于4 ℃ 824×g转速离心15 min,取上清置于干净的EP管中,并置于-80℃冰箱冻存备用;空白血浆样品采集同上。
1.5.2 外翻肠囊法肠吸收液的采集 取健康的6只雄性SD大鼠,随机分为2组(空白组,实验组),每组3只,适应性喂养1周后,实验前禁食12 h,自由饮水,腹腔注射20%乌拉坦,麻醉后,将大鼠背部固定,沿腹中线和腹白线剪开皮肤与肌肉,分别取十二指肠、空肠和回肠各10 cm,用弯镊将各肠段表面附着的脂肪和肠系膜小心剥离,用0 ℃ Tyrode液冲洗肠管至无肠内容物流出为止,小心翻转各段肠道,使肠黏膜面向外,浆膜层向内,用37 ℃ Tyrode缓冲液冲洗肠内表面,用硅胶软管小心插入翻转后的各肠管一头,用线将肠段与硅胶软管扎紧,同时将肠段另一端结扎紧,让各肠段形成囊状。向肠囊中加入2 mL空白Tyrode液,将肠管放入盛有30 mL 37 ℃恒温Tyrode液的麦氏浴管中平衡5 min,然后将Tyrode液换成含药Tyrode液,期间向试管中持续通入氧及二氧化碳的混合气体(95% O2和5% CO2)。分别在15 、30 、60 、90 、120 min时吸取出肠囊内液体200 μL,同时迅速补加同温度同体积的空白Tyrode缓冲液[13]。样品放入干净的1.5 mL EP管中,-20 ℃保存待用。
1.6 样品处理方法
1.6.1 血浆样品的处理 冰上操作,取血浆样品50 μL于1.5 mL的EP管中,加入200 μL 4 ℃预冷的甲醇涡旋振荡2 min,低温静置10 min。在4 ℃ 20 625×g转速离心15 min,取200 μL上清液置于新的EP管中,氮气吹干浓缩后,用100 μL 20 %甲醇水复溶,直至完全溶解后,振荡离心取上清液,进行UPLC-MS/MS体内成分分析。空白血浆样品处理方法同上。
1.6.2 肠吸收液样品的处理 取不同时间点各肠段内的肠吸收液于4 ℃ 13198×g离心20 min,取上清液于-20 ℃冰箱保存,备用。
2 结果
2.1 柴胡总皂苷提取物的化学成分特征谱 如表1和图1所示,在柴胡总皂苷提取物中共鉴定出52种柴胡皂苷类成分。主要的柴胡皂苷类成分的裂解规律分析如下。其中柴胡皂苷H或柴胡皂苷I根据其一级、二级碎片离子,在一级质谱图中均可见m/z 925.518 6,在二级质谱图可见m/z 779.458 9,推测m/z 779.458 9为[M-H]-,再丢失一分子岩藻糖146 Da和一分子H2O 18 Da,推测其分别为柴胡皂苷H或柴胡皂苷I(tR=12.21或12.22);柴胡皂苷F根据其一级、二级碎片离子,在一级质谱图中可见m/z 927.531 2,在二级质谱图可见m/z 781.484 3,推测m/z 781.484 3为[M-H]-,再丢失一分子岩藻糖146 Da和一分子H2O 18 Da,推测其为柴胡皂苷F(tR=12.41);柴胡皂苷C根据其一级、二级碎片离子,在一级质谱图中可见m/z 941.5098,在二级质谱图可见m/z 779.4585,推测m/z 779.4585为[M-H]-,再丢失一分子岩藻糖146 Da和一分子H2O 18 Da,得到柴胡皂苷C(tR=13.84);柴胡皂苷A、柴胡皂苷B2和柴胡皂苷B1根据其一级、二级碎片离子,在一级质谱图中可见m/z 779.456 8,在二级质谱图可见m/z 617.4005,推测m/z 617.400 5为[M-H]-,再丢失一分子岩藻糖146 Da和一分子H2O 18 Da,得到柴胡皂苷A(tR=14.06)、柴胡皂苷B2(tR=14.33)和柴胡皂苷B1(tR=15.43);柴胡皂苷D根据其一级、二级碎片离子,在一级质谱图中可见m/z 779.4567,在二级质谱图可见m/z 617.4002,推测m/z 617.4002为[M-H]-,再丢失一分子岩藻糖146 Da和一分子H2O 18 Da,得到柴胡皂苷D(tR=14.60)。
2''-O-乙酰柴胡皂苷A、4''-O-乙酰柴胡皂苷A、6''-O-乙酰柴胡皂苷A、3''-O-乙酰柴胡皂苷A、2''-O-乙酰柴胡皂苷B2、2''-O-乙酰柴胡皂苷D、3''-O-乙酰柴胡皂苷D、6''-O-乙酰柴胡皂苷B2、4''-O-乙酰柴胡皂苷D、4''-O-乙酰柴胡皂苷B2、6''-O-乙酰柴胡皂苷D均呈现同样的裂解规律,在一级质谱图中分别可见m/z 821.4689(2''-O-乙酰柴胡皂苷A、4''-O-乙酰柴胡皂苷A、6''-O-乙酰柴胡皂苷A、6''-O-乙酰柴胡皂苷B2、4''-O-乙酰柴胡皂苷D)、m/z 821.4690(3''-O-乙酰柴胡皂苷A)、m/z 821.4687(2''-O-乙酰柴胡皂苷B2、6''-O-乙酰柴胡皂苷D)、m/z 821.4688(2''-O-乙酰柴胡皂苷D)、m/z 821.4691(3''-O-乙酰柴胡皂苷D)、m/z 821.4692(4''-O-乙酰柴胡皂苷B2),在二级质谱图可见m/z 779.4578(2''-O-乙酰柴胡皂苷A、4''-O-乙酰柴胡皂苷A、6''-O-乙酰柴胡皂苷A、3''-O-乙酰柴胡皂苷A、2''-O-乙酰柴胡皂苷B2、2''-O-乙酰柴胡皂苷D)、m/z 779.4588(3''-O-乙酰柴胡皂苷D、6''-O-乙酰柴胡皂苷B2、4''-O-乙酰柴胡皂苷D、4''-O-乙酰柴胡皂苷B2)、m/z 779.4573(6''-O-乙酰柴胡皂苷D),它们均是丢失C2H2O 42 Da,再丢失C2H2O 42 Da、一分子的葡萄糖 162 Da得到617.4001,同时根据它们在色谱图的出峰顺序,推测其分别为柴胡皂苷A、柴胡皂苷B2和柴胡皂苷D不同部位乙酰化后的化合物,即2''-O-乙酰柴胡皂苷A(tR=14.28)、4''-O-乙酰柴胡皂苷A(tR=14.34)、6''-O-乙酰柴胡皂苷A(tR=14.59)、3''-O-乙酰柴胡皂苷A(tR=14.60)、2''-O-乙酰柴胡皂苷B2(tR=14.70)、2''-O-乙酰柴胡皂苷D(tR=14.99)、3''-O-乙酰柴胡皂苷D(tR=15.20)、6''-O-乙酰柴胡皂苷B2(tR=15.61)、4''-O-乙酰柴胡皂苷D(tR=15.67)、4''-O-乙酰柴胡皂苷B2(tR=15.91)、6''-O-乙酰柴胡皂苷D(tR=16.10),具体碎片离子(见表1)。
2.2 柴胡总皂苷的肠吸收代谢研究
2.2.1 离体外翻肠囊法的肠吸收成分 如图2所示,与柴胡皂苷提取物成分谱图比较,离体外翻肠囊法收集的肠吸收成分谱图共有16种成分被检出吸收。如表2所示,通过柴胡皂苷提取物(CHZG)的峰面积与肠吸收(CXS)的峰面积之比,柴胡皂苷次G、2''-O-乙酰柴胡皂苷D、柴胡皂苷B1、6''-O-乙酰柴胡皂苷D在柴胡皂苷提取物的峰面积与肠吸收的峰面积比值较大,说明这4种成分的肠吸收能力较弱;羟基柴胡皂苷F、羟基柴胡皂苷A、柴胡皂苷元A在柴胡皂苷提取物的峰面积与肠吸收的峰面积比值较小,说明这3种成分的肠吸收能力较强。

图1 柴胡总皂苷提取物中柴胡皂苷类成分的LC-MS离子流质谱

表1 柴胡总皂苷提取物中柴胡皂苷类成分的LC-MS特征谱的成分鉴定
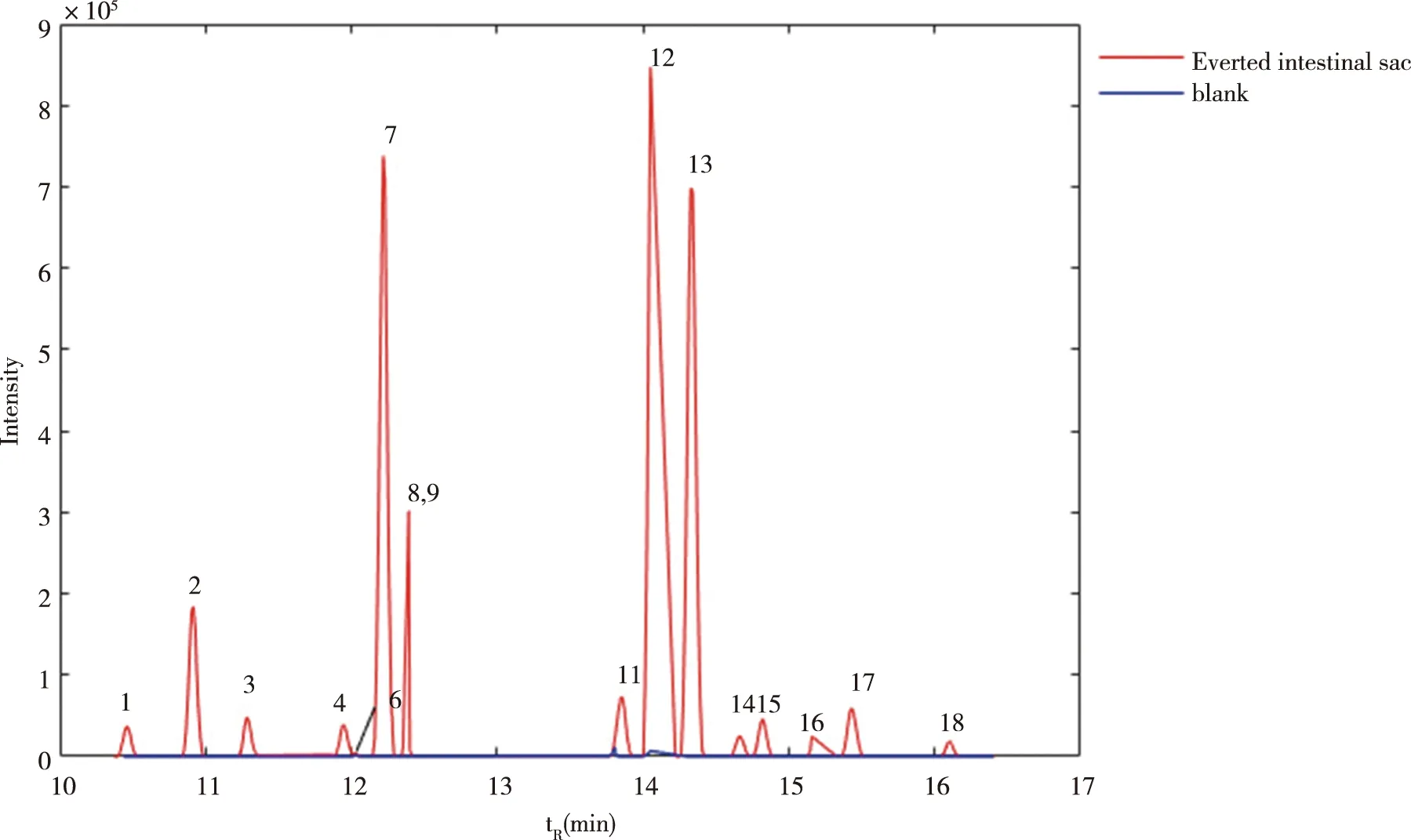
成分1、2、3、4分别为羟基柴胡皂苷F、羟基柴胡皂苷D、Rotundioside N、乙酰羟基柴胡皂苷D;成分6、7、8、9分别为柴胡皂苷元A、柴胡皂苷H/I、柴胡皂苷F、丙二酰柴胡皂苷A;成分11、12、13、14分别为柴胡皂苷C、柴胡皂苷A、柴胡皂苷B2、柴胡次皂苷G;成分15、16、17、18分别为柴胡皂苷E、2''-O-乙酰柴胡皂苷D、柴胡皂苷B1、6''-O-乙酰柴胡皂苷D。图2 离体外翻肠囊法肠吸收成分的提取离子流质谱

表2 肠吸收成分、肝门静脉入血成分和腹主动脉血中成分的峰面积比值
2.2.2 肝门静脉取血的入血成分 通过比较肝门静脉入血成分(MJM)谱图与离体肠吸收成分谱图,得到在肠道菌群中代谢后吸收入血成分和直接通过肠吸收入血成分之间的差异。如图3所示,在肝门静脉血中检测到6种成分,分别为乙酰柴胡皂苷E、柴胡皂苷元A、柴胡皂苷元G、柴胡皂苷A、柴胡皂苷B2、柴胡皂苷元C,而乙酰柴胡皂苷E、柴胡皂苷元G、柴胡皂苷元C在离体肠吸收液中未检测到,推测这3种成分可能是由原型成分柴胡皂苷E、柴胡皂苷A和柴胡皂苷C产生的代谢产物。通过比较肝门静脉入血成分的峰面积与离体肠吸收成分的峰面积比值得知,柴胡皂苷元A在肝门静脉入血成分的峰面积高于肠吸收的峰面积,柴胡皂苷A和柴胡皂苷B2在肝门静脉入血成分的峰面积低于肠吸收的峰面积。其中肝门静脉中柴胡皂苷元A的峰面积高于离体肠吸收峰面积,推测柴胡皂苷A可能在肠道菌群的作用下进一步代谢产生柴胡皂苷元A。

成分5、6、10、12、13、19分别为乙酰柴胡皂苷E、柴胡皂苷元A、柴胡皂苷元G、柴胡皂苷A、柴胡皂苷B2、柴胡皂苷元C。图3 肝门静脉入血成分的提取离子流质谱
2.3 柴胡总皂苷的肝代谢入血研究 通过比较肝门静脉入血成分谱图与腹主动脉血中成分(FDM)谱图,两者的成分基本一致。如表2所示,进一步比对肝门静脉入血成分与腹主动脉血中成分的峰面积比值可知,乙酰柴胡皂苷E、柴胡皂苷元G、柴胡皂苷B2、柴胡皂苷元C在肝门静脉入血成分的峰面积低于腹主动脉血中成分的峰面积,柴胡皂苷元A、柴胡皂苷A在肝门静脉入血成分的峰面积高于腹主动脉血中成分的峰面积。其中乙酰柴胡皂苷E、柴胡皂苷元G、柴胡皂苷B2、柴胡皂苷元C在腹主动脉中的峰面积增加,说明这4种成分在肝脏代谢时由其他成分生成(见图4)。

成分5、6、10、12、13、19分别为乙酰柴胡皂苷E、柴胡皂苷元A、柴胡皂苷元G、柴胡皂苷A、柴胡皂苷B2、柴胡皂苷元C。图4 腹主动脉血中成分的提取离子流质谱
2.4 柴胡皂苷类关键成分肠道内的代谢 柴胡皂苷类成分在肠道内代谢情况(见图5)。

图5 柴胡皂苷类关键成分肠道内的代谢
3 讨论
本研究基于UPLC-MS/MS技术,采用大鼠离体外翻肠囊法、肝门静脉取血、腹主动脉取血的方法,分别对外翻肠囊吸收成分、柴胡总皂苷提取物给药后15 min,0.5、1、2、4 h共5个时间点的肝门静脉血和腹主动脉血进行分析,结果发现给药0.5 h的样品中的出峰数量最多。因此,本研究选择灌胃柴胡总皂苷提取液后0.5 h采血,这与文献报道结果基本一致[14]。
本研究采用离体外翻肠囊法,在大鼠肠吸收中检测到16种柴胡总皂苷类成分,在肝门静脉和腹主动脉中各检测到6种柴胡总皂苷类成分。其中羟基柴胡皂苷F、羟基柴胡皂苷D、Rotundioside N、乙酰羟基柴胡皂苷D、柴胡皂苷H、柴胡皂苷F、丙二酰柴胡皂苷A、柴胡皂苷C、柴胡次皂苷G、柴胡皂苷E、2''-O-乙酰柴胡皂苷D、柴胡皂苷B1、6''-O-乙酰柴胡皂苷D 这13种成分是离体外翻肠囊法中特有的肠吸收成分,表明它们可以直接被肠道吸收;乙酰柴胡皂苷E、柴胡皂苷元G、柴胡皂苷元C仅在肝门静脉和腹主动脉中检测到,在离体外翻肠囊法肠吸收中未检测到,推测这3种成分不能直接被肠道吸收,而是由其原型药物肠道后吸收。有研究证实黄芪皂苷类成分的主要代谢途径是脱糖基、脱乙酰基和脱氢[15],根据柴胡皂苷结构的特点,推测乙酰柴胡皂苷E是由柴胡皂苷E代谢产生,但具体代谢过程鲜有报道。此外,有研究发现柴胡皂苷D在厌氧环境大鼠肠道内容物中孵化可代谢产生柴胡皂苷元G和柴胡次皂苷G[16-17]。因此本研究推测柴胡皂苷元G可能部分由柴胡皂苷D代谢产生,见图5(2);也有研究发现柴胡皂苷C在大鼠胃酸的条件下可转化成柴胡皂苷H和柴胡皂苷I,柴胡皂苷H可再继续转化,最终转化为柴胡皂苷元C[18],因此本研究推测柴胡皂苷元C是由柴胡皂苷C代谢产生,见图5(3)。因此,乙酰柴胡皂苷E、柴胡皂苷元G、柴胡皂苷元C可能是由柴胡皂苷E、柴胡皂苷D和柴胡皂苷C代谢产生。通过比较肝门静脉取血和腹主动脉取血结果,乙酰柴胡皂苷E、柴胡皂苷元G和柴胡皂苷元C在腹主动脉中的峰面积均高于肝门静脉中的峰面积,本研究推测它们在肝代谢时可能由柴胡皂苷E、柴胡皂苷D和柴胡皂苷C生成,从而增加腹主动脉中的峰面积,与上述分析结果一致。
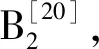
综上所述,通过比较3个代谢特征谱发现,离体外翻肠囊法可以简单快速的分析直接被肠道吸收的成分,但由于没有肠道菌群、胃肠道酶等影响,部分发挥药效的代谢产物尚不明确。因此,研究柴胡皂苷类成分发挥药效的关键成分需要同时建立其3种研究方法,结果表明乙酰柴胡皂苷E、柴胡皂苷元A、柴胡皂苷元G、柴胡皂苷A、柴胡皂苷B2、柴胡皂苷元C可能是柴胡皂苷类成分体内发挥药效的关键成分。

