miR-148a-3p 靶向SMURF2 调节牙髓干细胞和口腔上皮细胞共培养体系成骨分化及牙釉质发育的作用机制
徐 倩,崔玉梅,马思明,林云红,熊依菁,宋子珺,李旭东
(昆明医科大学附属口腔医院口腔修复科,云南 昆明 650106)
在牙科相关疾病中,牙齿的缺损或缺失已经成为全国主要的公共卫生和社会经济问题之一,组织工程体外牙再生技术有望解决这一问题[1]。以胶原蛋白凝胶为载体,成骨细胞与上皮细胞相互作用激活特定信号通路,通过使牙源性的间充质干细胞和上皮细胞相互作用可能实现体外牙齿诱导发生。发育过程中任何信号的干扰和突变都可能导致牙釉质形成的障碍,如釉质发育不全(amelogenesis imperfecta,AI)。牙釉质是羟磷灰石晶体按照一定的顺序相互排列形成坚硬的矿化组织,牙釉质保障了患者牙齿咬合功能[2]。除此之外,基层的成釉因子的分泌和晶体矿化能力,也一定程度上影响了牙釉质的形成[3]。目前有研究通过牙髓间充质干细胞与上皮细胞三维共培养,形成早期牙齿上皮内陷样结构[4],但是牙源性间充质干细胞与上皮细胞相互作用机制还未阐明。因此寻找牙源性间充质干细胞成骨细胞分化和调节牙釉质发育的基因靶点、探讨牙釉质发育的分子机制对提高牙釉质发育状况密切相关。有研究表明,微小RNA(miRNA)存在于成骨细胞细胞核内,作为非编码小分子,不但参与干细胞分裂、成骨细胞的分化与破骨细胞凋亡,而且影响着牙釉质生成和恢复的过程[5-6]。最近研究发现,miR-148a-3p 存在于骨髓间充质干细胞中[7],但是对于成骨分化的作用有争议[8-9],在牙源性间充质干细胞中的作用也还不清楚。为探究miR-148a-3p 在牙源性间充质干细胞成骨细胞分化和调节牙釉质发育中的作用及可能涉及靶向机制,观察过表达和抑制miR-148a-3p 对干细胞成骨细胞分化和调节牙釉质发育的影响,阐明其作用机制。现报道如下。
1 材料与方法
1.1 细胞系及主要试剂
人牙源性间充质干细胞选择牙髓干细胞,从健康受试者的第三磨牙牙髓获得;人正常口腔上皮细胞从健康受试者的牙龈组织获得。DMEM/F12 培养液、ASAP、胎牛血清、0.25%胰蛋白酶均采自Gbico 公司;Matrigel 基质凝胶购自康宁公司;TRIzol 试剂、Lipofectamine 2000 来自Invitrogen 公司;逆转录试剂盒和SYBR Green 荧光定量PCR 试剂盒,购自Ta Ka Ra 公司;miR-148a-3p mimics、miR-148a-3p 抑制剂和miR-NC购自赛默飞公司;MTT 细胞增值检测试剂盒购自Sigma 公司;双荧光素酶报告检测系统,购自Promega 公 司;RUNX2、E-cadherin、SMURF2、β-actin 抗体、HRP、标记的羊抗兔或鼠IgG 二抗来自Abcam 公司。本研究签署患者知情同意并经昆明医科大学附属口腔医院伦理委员会批准通过(KYKQ2020MECO20)。
1.2 细胞培养及转染
在DMEM/F12 培养液中,加入20%牛胎血清、100 kU/L 青霉素和100 mg/L 链霉素,在37 ℃和5%CO2条件下培养牙髓干细胞。当细胞融合率达到60%时,按照脂质体TM 2000 的转染方法转染。将细胞分成3 组,即miR-148a-3p 组(转染miR-148a-3p mimics)、miR-148a-3p 抑制剂(转染miR-148a-3p inhibitor)和NC 组(转染miR-NC),每组设3 个复孔。
1.3 三维共培养体系建立
将牙髓干细胞以1×106cells/mL 的密度接种到Matrigel 基质凝胶上,培养24 h,将口腔上皮细胞以5×105cells/mL 的密度接种到牙髓干细胞表面,培养1 d 后更换为无血清培养基。培养4 d后,将共培养转为气液界面培养,即将培养基减量到不覆盖细胞层。继续气液界面培养,1 周后采用 Corning Dispase 收获细胞进行分析。
1.4 qPCR 法检测细胞中miR-148a-3p 表达水平
用TRIzol 试剂盒提取细胞总RNA,并根据反转录试剂盒的指令进行逆转录合成cDNA。用qPCR 装置进行检测。反应条件:95°预变性15 s,95°10 s,60°20 s,72°30 s,共40 个循环。以U6 为内参,用2-△△Ct法计算各组组织和细胞中miR-148a-3p 的表达水平。
1.5 MTT 法检测细胞的增殖能力
三维共培养细胞收获后将各组细胞接种到96孔板上,分3 组:正常对照组(Con),miR-148a-3p 抑制剂和NC 组,每个孔设置3 个复孔,每孔加入100 µL 新鲜培养基,每隔 24 h、48 h、72 h和96 h 后,更换新鲜培养器,在每个孔中加入20 µL 的MTT 试剂,在培养器中再培养4 h,然后丢弃MTT 液。加入150 µL DMSO,充分溶解后,检测490 nm 波长的光密度(D)。将D 值(纵坐标)和时间(横坐标)绘制生长曲线。
1.6 荧光素酶报告实验
将SMURF2 3' UTR 中含有预测的miR-148a-3p 潜在结合位点的部分片段构建到psiCHECK-2载体中(SMURF2-wt reporter)。此外,构建含有miR-148a-3p 结合位点突变的SMURF2-mut 报告基因载体。转染前1 d 将牙髓干细胞以每孔5×104个细胞的密度接种于24 孔板中。使用Lipofectamine 2000 将相应的报告基因载体和miR-148a-3p 模拟物共同转染细胞。按照制造商的说明,使用双荧光素酶报告检测系统在转染后48 h分别测量Renilla 和Firefly 的荧光素酶活性。实验重复3 次。
1.7 WB 法检测细胞中成骨细胞分化和调节牙釉质发育相关蛋白的表达
采用细胞总蛋白提取试剂盒提取总蛋白,BCA 法测定蛋白质浓度后进行SDS-PAGE、转膜,用含5%脱脂奶粉的PBS 溶液室温封闭1 h。加入稀释比例均为1∶1 000 的RUNX2,E-cadherin及β-actin 一抗,4℃过夜。次日,洗膜后,加入HRP 标记的羊抗兔或鼠Ig G 二抗(1∶2 000),室温孵育2 h,于暗室中用ECL 发光,并采用Image J 软件进行图像分析。以目的蛋白条带的灰度值与内参照β-actin 条带灰度值的比值表示目的蛋白的相对表达量。
1.8 统计学处理
采用SPSS26.0 软件对实验数据进行系统分析。各实验指标条件间采用单因素方差分析,组间比较采用LSD-t检验;计数资料采用χ2检验;P<0.05 为差异具有统计学意义。
2 结果
2.1 miR-148a-3p 调控牙髓干细胞增殖
牙髓干细胞转染miR-148a-3p 抑制剂后,三维共培养得到的细胞进行MTT 检测,发现细胞活力明显降低(P<0.05),见图1。

图1 各组细胞MTT 活力检测Fig.1 MTT Detection of cell viability与Con 比较,*P<0.05。
2.2 miR-148a-3p 上调成骨细胞分化(RUNX2)和牙釉质发育标志物(E-cadherin)蛋白表达水平
牙髓干细胞转染miR-148a-3p mimics,RTPCR 检测miR-148a-3p 表达水平变化。相比NC 组,miR-148a-3p mimics 组的miR-148a-3p表达水平明显增加(P<0.05),见图2A。

图2 Western blotting 法检测miR-148a-3p 对RUNX2 和N-cadherin 蛋白表达水平的影响Fig.2 The effects of miR-148a-3p on the expression levels of RUNX2 and N-cadherin proteins were detected by Western blotting
联合口腔上皮细胞进行三维共培养之后,Western blotting 法检测成骨细胞分化(RUNX2)和牙釉质发育标志物(E-cadherin)蛋白表达水平变化。结果表明,相比NC 组,miR-148a-3p 组的RUNX2表达水平和N-cadherin 表达水平明显增加(P<0.05),见图2B。
2.3 miR-148a-3p 结合SMURF2 3'-UTR
Targetscan 预测表明,SMURF2 mRNA 的3'-UTR 有miR-148a-3p 的互补结合位点(图3A)。笔者构建了SMURF2 3'-UTR 的荧光素酶报告质粒,转染牙髓干细胞,进行双荧光素酶报告实验。结果表明,miR-148a-3p mimics 抑制野生型载体的荧光素酶活性(图3B,P<0.05),但是对突变型载体的荧光素酶活性没有影响(P> 0.05)。同时Western blot 结果显示(图3C),miR-148a-3p mimics 下调SMURF2 的表达(P<0.05),说明SMURF2 是miR-148a-3p 的潜在的靶基因。
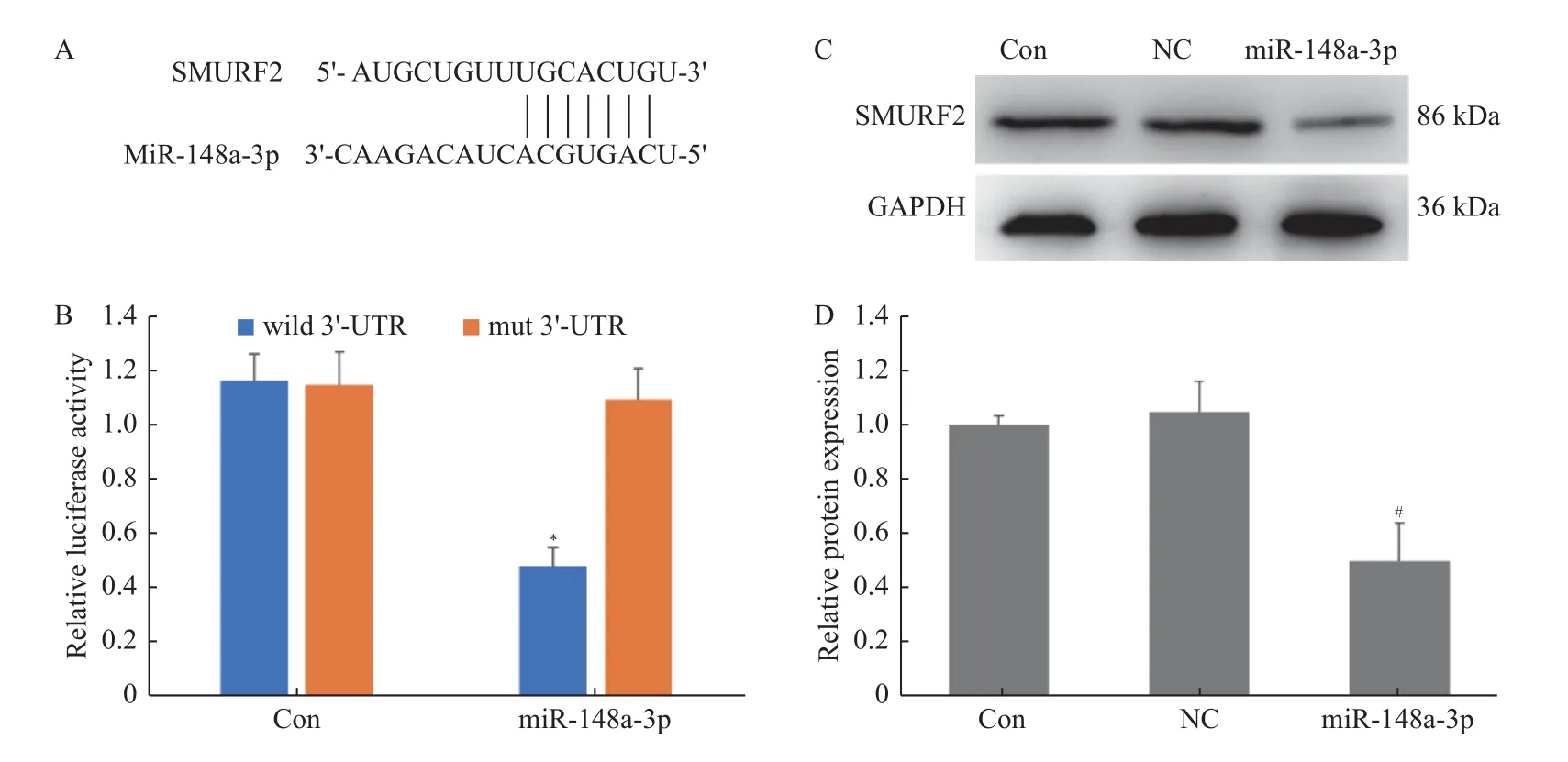
图3 miR-148a-3p 通过结合SMURF2 3'-UTR 调节SMURF2 表达水平Fig.3 miR-148a-3p regulates SMURF2 expression by binding to SMURF2 3-’ UTR
3 讨论
牙釉质是羟磷灰石晶体按照一定的顺序相互排列形成坚硬的矿化组织,釉柱与釉间柱有序组合使釉质在具备硬度的同时兼具一定弹性。目前研究证实,多种干细胞包括牙源性间充质干细胞和上皮细胞共同培养可以分化出骨细胞及牙釉质,形成牙体[10]。牙髓干细胞来源于牙髓组织,具有强大的自我更新能力和多向分化潜能,在组织工程中具有巨大的应用潜力。研究已证明牙髓干细胞与上皮细胞三维共培养,可以形成早期牙齿上皮内陷样结构(早期牙齿发育的关键特征)[4]。但是牙髓干细胞和上皮细胞之间的相互作用机制尚未阐明。目前大量文献表明[11-12],miRNA 作为遗传信息的载体,通过参与体内蛋白质合成,调节细胞增殖、凋亡等过程。当miRNA 调节功能失调将会引起细胞功能失调从而出现癌变。近年来,国内外实验室通过多种手段,观察分析小鼠牙胚组织发育过程中miRNAs 的转录表达,可见miRNA 与牙胚的生长发育过程密切相关。因此测定特定miRNA 表达变化在干细胞成骨细胞分化和调节牙釉质发育中过程中发挥着极其重要的作用,揭示其分子作用机制,具有较高的学术研究和指导价值。
miR-148a-3p 是一种多功能的调节因子,可以抑制肿瘤细胞发生转化[13],可能参与脂肪细胞分化[14]。Tian 的研究显示miR-148a-3p 通过靶向赖氨酸特异性去甲基化酶6b 抑制成骨细胞分化[8],但是Sheng[9]研究表明miR-148a-3p 也可以通过激活Wnt 通路和靶向DKK1 促进强直性脊柱炎成纤维细胞的成骨分化。miR-148a-3p 在牙源性间充质干细胞成骨分化中的作用,以及是否参与牙釉质的发育还不清楚。
笔者利用miR-148a-3p 抑制剂下调牙髓干细胞中miR-148a-3p 的水平,然后对三维共培养得到的混合细胞检测,发现细胞的增殖受到抑制,提示miR-148a-3p 参与了牙髓干细胞的生物学行为和相关作用。最近研究表明[15],过表达miR-148a-3p 可以促进牙龈成纤维细胞的增殖,牙髓干细胞是否存在相同机制还需要进一步验证。
笔者利用miR-148a-3p mimics 上调牙髓干细胞中miR-148a-3p 水平,结果发现三维共培养的细胞中,RUNX2 和E-cadherin 表达水平明显上调。RUNX2 是骨发育和骨再生过程中的关键调控因子,参与骨骼发育过程调节[16];E-cadherin 参与牙胚的发育,E-cadherin 在成釉前细胞中表达上调,在牙齿形态发生、细胞分化,尤其是在牙体形成过程中起重要作用[17-18]。因此推断,miR-148a-3p 可能调控牙发育过程中的成骨分化和牙釉质发育。
研究进一步通过 TargetScan 软件预测SMURF2(SMAD 特异性 E3 泛素蛋白连接酶2)3'-UTR 存在miR-148a-3p 结合位点。作为 E3 连接酶,SMURF2 具有调节多种蛋白质稳定性的重要功能,从而维持细胞迁移、增殖和凋亡等生理过程[19]。Schminke 等[20]研究发现SMURF2 诱导成骨细胞中RUNX2 降解,SMURF2 的缺乏增强了成骨细胞的分化。Zhao 等[21]发现过表达SMURF2抑制表达肾近端小管上皮(HK-2)细胞中Ecadherin 的表达。所以笔者推测miR-148a-3p 在牙髓干细胞中可能通过靶向SMURF2 上调RUNX2水平,促进成骨分化并可能通过细胞间相互作用,比如外泌体等靶向上皮细胞中SMURF2,调节Ecadherin 水平。
综上所述,miR-148a-3p 可能通过靶向SMURF2 调节成骨分化及牙釉质发育,在牙源性间充质干细胞和上皮细胞共同诱导的体外牙齿发生中发挥作用,提示miR-148a-3p 可作为牙齿修复和治疗的潜在靶标之一。

