小凹蛋白-1(CAV1)在肿瘤组织中的表达及其对生存预后的影响
刘一笑,受梦媛,张 莹,张荣强,孙 娜
(陕西中医药大学公共卫生学院流统教研室,陕西 咸阳 712046)
恶性肿瘤是人类机体在各种致癌因素下,局部组织细胞异常增生并转移扩散至其他组织的一类疾病,2020 年全球新发癌症病例约1 930 万例,每4 个人中就会有1 人患有癌症的风险[1]。癌症是世界范围内仅次于心脏病的第二大死亡原因[2],严重危害人类生命健康[3],给社会带来了重大的健康和经济问题,随着病例数量的持续增加,癌症的负担无疑会变得更加严重。
小凹蛋白-1(caveolin 1,CAV1)是细胞质膜小凹中一种重要的结构功能蛋白,结构可分为3 个区域,包括C 端跨域、N 末端支架结构和支架结构 域(caveolin-scaffolding domain,CSD),其 中CSD 区域能特异性地与多种信号分子结合[4],成为多条信号通路的枢纽,影响细胞的增殖、迁移和分化并具有介导内吞、胞吞、机械保护、细胞代谢和脂质稳态等丰富的功能[5]。CAV1 的广泛分布也决定了其功能的重要性,研究学者[6-10]发现CAV1 与逆转肿瘤耐药细胞耐药性有关,下调CAV1 的表达使ERK(extracellular regulated protein kinases)通路激活会促进黑色素瘤细胞的体内体外增殖,敲低CAV1 表达可抑制肺腺癌H1299 细胞增殖、迁移和侵袭并影响其生物学行为,CAV1在胶质瘤细胞中与ER-α36 相互作用共同参与肿瘤细胞生长;抑制CAV1 的活化和脂筏的聚集可以逆转胃癌细胞的迁移[11];绍伟伟等认为CAV1的表达与肿瘤患者的预后存在联系[12],并有多项研究指出其与肿瘤的发生发展关系密切[13]。
目前,临床上针对癌症的治疗主要包括手术、化疗、放疗、靶向治疗和免疫治疗[14],但由于耐药、副作用等问题,患者的预后和生存率仍不令人满意。因此,深入研究癌症的生存预后靶点,为临床治疗提供新的方向和策略就显得尤为重要。随着近年来生物信息学技术和遗传科学的发展,基因在各种肿瘤中的预后价值正在广泛被探讨,使用基因来识别、诊断和确定潜在肿瘤风险成为可能。本研究以CAV1 基因为研究对象,基于多种数据库探索该基因在人类肿瘤组织中的mRNA表达、蛋白表达、患者的预后、肿瘤免疫浸润相关性、相似基因功能富集与Nomogram 模型建立与验证,旨在揭示CAV1 在人类肿瘤发生发展过程中的影响,为其在肿瘤的预防、识别、诊断及其治疗提供参考依据。
1 材料与方法
1.1 CAV1 在人类肿瘤中的mRNA 表达
使 用 R 包:ggplot2[3.3.6]、stats[4.2.1]和car[3.1-0]分析经Toil 流程[15]统一处理TCGA 数据库(The Cancer Genome Atlas,TCGA)和GTEx 数据库(Genotype-Tissue Expression)中的TPM(transcripts per million reads)格式的RNAseq 数据,并对TPM格式的RNAseq 数据进行log2 转化,利用Mann-Whitney U 检验(Wilcoxon rank sum test)分析CAV1基因在33 种不同正常组织和肿瘤组织中的mRNA差异表达水平。
1.2 CAV1 在人类肿瘤中的蛋白表达
使用UALCAN 数据库(http://ualcan.path.uab.edu/analysis-prot.html)分析癌症组学数据,先将每个样品谱内归一化,然后再样品间归一化,Z 值代表给定癌症类型的样本中值的标准差,对CPTAC(Clinical proteomic tumor analysis consortium)数据库的11 种肿瘤进行蛋白表达分析[16],比较CAV1在人类正常组织和肿瘤组织中的蛋白表达水平。
1.3 CAV1 基因表达与人类肿瘤患者生存预后的相关性
选择TCGA 数据库中mRNA 表达具有差异统计学意义的肿瘤临床数据,使用R 包:survival[3.3.1]进行比例风险假设检验并进行拟合生存回归,数据格式为TPM,预后参数类型选择总生存期(overall survival,OS),使用单因素Cox 回归分析计算比较患者样本CAV1 表达高低组与患者生存之间的关系,利用survminer 包以及ggplot2 进行结果可视化处理。
1.4 CAV1 基因在BLCA、LGG 和HNSC 中的免疫组化
利用Mann-Whitney U 检验(Wilcoxon rank sum test)单独分析CAV1 在具有生存预后意义的肿瘤表达差异,通过HPA(Human Protein Atlas)(http:www.proteinatlas.org/)数据库下载TCGA 数据库中CAV1在正常组织和肿瘤组织中的免疫组织染色图,并对进行分析。
1.5 CAV1 在BLCA、LGG 和HNSC 中与免疫浸润细胞的相关性
基于R 包-GSVA[1.46.0]中的ssGSEA 算法,利用Immunity 提供的24 种免疫细胞[17]的markers计算对应的免疫浸润数据,主分子为CAV1,对数据中主变量的肿瘤和免疫浸润矩阵数据之间进行Spearman 相关性分析,分析结果用ggplot2 包进行可视化。
1.6 CAV1 生存预后Nomogram 模型的建立
从TCGA 数据库(https://portal.gdc.cancer.gov)下载整理肿瘤项目STAR 流程的RNAseq 数据并提取TPM 格式的数据以及临床数据,剔除无效数据。以CAV1 基因表达数据与主要临床信息参数作为自变量,以与CAV1 表达量具有生存预后意义的肿瘤总生存期(overall survival,OS)为因变量,进行单因素与多因素COX 回归模型,分析肿瘤总生存期的影响因素。使用R 软件“rms”包构建nomogram 相关模型并进行可视化,利用校准曲线对模型进行验证和评估。
2 结果
2.1 CAV1 基因在人类肿瘤中的mRNA 表达
通过对TCGA 和GTEx 数据库CAV1 基因进行分析,与正常组织相比,33 种肿瘤组织中有26 种mRNA 表达差异具有统计学意义(P<0.05),其中CAV1 基因在ACC 肾上腺皮质癌(ACC)、胆管癌(CHOL)、弥漫性大B 细胞淋巴瘤(DLBC)、多形性成胶质细胞癌(GBM)、头颈鳞状细胞癌(HNSC)、肾嫌色细胞癌(KICH)、肾透明细胞癌(KIRC)、急性髓性白血病(LAML)、脑低级别胶质癌(LGG)、肝脏肝细胞癌(LIHC)、胰腺癌(PAAD)、胸腺瘤(THYM)、12 种肿瘤组织中高表达(P<0.05);CAV1 基因在膀胱癌(BLCA)、乳腺癌(BRCA)、宫颈鳞癌(CESC)、结肠癌(COAD)、食管癌(ESCA)、肺腺癌(LUAD)、肺鳞癌(LUSC)、卵巢浆液性囊腺癌(OV)、前列腺癌(PRAD)、直肠腺瘤(READ)、皮肤黑色素瘤(SKCM)、THCA(甲状腺癌)、子宫内膜癌(UCEC)、子宫肉瘤(UCS)14 种肿瘤组织中呈现低表达(P<0.05),见图1。
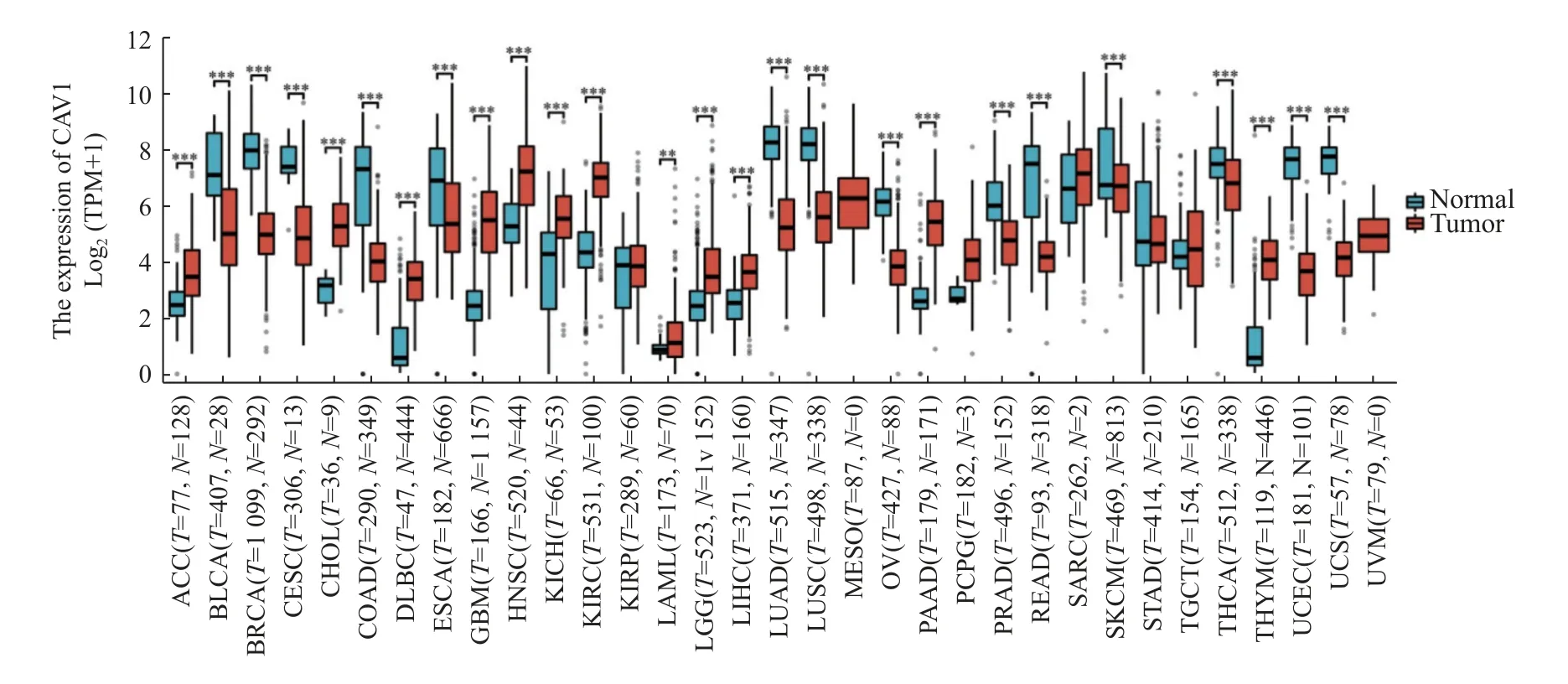
图1 CAV1 基因在人类肿瘤组织和正常组织中的mRNA 表达分析Fig.1 mRNA expression analysis of CAV1 gene in human tumor tissues and normal tissues
2.2 CAV1 基因在人类肿瘤中蛋白的表达
从CPTAC 数据集获得11 组蛋白质差异表达数据,结果表明:与正常组织相比,CPTAC 数据库中CAV1 蛋白在结肠癌(COAD)、乳腺癌(BRCA)、头颈鳞状细胞癌(HNSC)、肝脏肝细胞癌(LIHC)、肺腺癌(LUAD)、肺鳞癌(LUSC)、卵巢浆液性囊腺癌(OV)、子宫内膜癌(UCEC)这8种肿瘤组织中的表达降低,而在肾透明细胞癌(KIRC)中表达增高,差异均具有统计学意义(P<0.05),在多形性成胶质细胞癌(GBM)、胰腺癌(PAAD)这2 种肿瘤中表达,差异无统计学意义(P>0.05),见图2。

图2 CAV1 基因在不同癌症组织和正常组织中的总蛋白表达分析Fig.2 Total protein expression analysis of CAV1 gene in different cancer tissues and normal tissues
2.3 CAV1 基因与肿瘤患者预后的相关性
TCGA 数据库中分析CAV1 表达与mRNA 表达具有统计学差异的26 种肿瘤生存预后之间的相关性,结果显示CAV1 只在BLCA(HR=1.49,95%CI[1.11~2.00]),LGG(HR=2.43,95%CI[1.67~3.54])和HNSC(HR=1.43,95%CI[1.09~1.87])中存在预后相关,且差异均具有统计学意义(P<0.01),而与其他肿瘤预后相关无统计学意义。K-M 生存曲线结果显示LGG、HNSC、BLCA这3 种肿瘤中的高表达组生存预后较低表达组更差,见图3,提示CAV1 高表达是其危险因素,可能表现为促癌基因,因此CAV1 可能作为LGG、HNSC 和BLCA 患者预后的候选基因。

图3 CAV1 基因在BLCA、LGG 与HNSC 肿瘤组织中的预后KM 曲线图Fig.3 Prognostic KM curve of CAV1 gene in BLCA,LGG and HNSC tumors
2.4 CAV1 在BLCA、LGG 和HNSC 中的免疫组化
通过对HPA 数据库提供的免疫组化结果进行分析,结果表明CAV1 在膀胱组织中低表达,在BLCA 组织中高表达,与其mRNA 基因表达结果相反。CAV1 在LGG 和HNSC 中免疫组化结果显示CAV1 在大脑与头颈部均低表达,在LGG 与HNSC 中均高表达,mRNA 表达结果与其免疫组化数据一致,IHC 染色均为中等或强染色,见图4。

图4 BLCA、LGG 和HNSC 肿瘤组织和正常组织的免疫组化图(×100)Fig.4 Immunohistochemical maps of BLCA,LGG and HNSC tumor tissue and normal tissue(×100)
2.5 CAV1 在BLCA、LGG 和HNSC 中与免疫浸润细胞的相关性
TCGA 数据库中CAV1 在3 种具有生存预后意义的肿瘤与24 种免疫浸润细胞数据的相关性结果显示,CAV1 在LGG 中与21 种免疫浸润细胞具有相关性,其中与Macrophages、Neutrophils等18 种免疫浸润细胞表达呈正相关,与Treg 细胞、pDC 细胞和NK CD56bright 细胞表达呈负相关,与Mast 细胞、Tem 细胞和TFH 细胞表达无统计学意义,其中正相关最高的为Macrophages细胞(R=0.518),负相关最高的是NK CD56bright细胞(R=-0.248)。CAV1 在HNSC 中与14 种免疫浸润细胞具有相关性,正负相关各有7 种,其中正相关最高的为Tgd 细胞(R=0.488),负相关最高的是B 细胞(R=-0.250)。CAV1 在BLCA 中与23 种免疫浸润细胞具有相关性,其中正相关为21 种,与其负相关的细胞为Th17 细胞和NK CD56bright 细胞,与其无统计学意义的细胞为T helper 细胞,正相关最高的是Macrophages 细胞(R=0.629),负相关最高的是NK CD56bright 细胞(R=-0.339),见图5。

图5 CAV1 基因在3 种不同肿瘤组织中与免疫浸润细胞相关性棒棒糖图Fig.5 Lollipop map of CAV1 gene correlation with immunoinfiltrating cells in three different tumor tissues
2.6 CAV1 表达对BLCA、LGG 和HNSC 生存预后影响的Nomogram 模型建立与验证
单因素COX 回归分析表明,CAV1 和年龄是BLCA 患者生存预后的危险因素且均具有统计学差异(P<0.05),多因素COX 回归显示年龄是影响BLCA 生存预后的独立危险因素。CAV1 表达量与BLCA 临床病例相关数据构建Momogram 模型的一致性良好(Concordance,C-index=0.643,95%CI[0.619~0.668],多因素模型满足比例风险假设且不存在多重共线性(0<VIF<10),该模型校准曲线稳定,见图6。
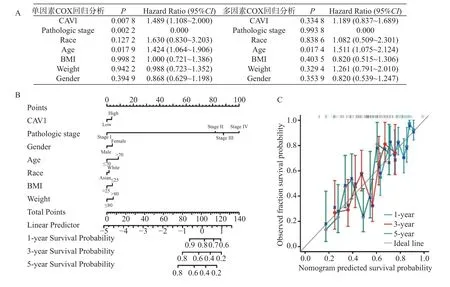
图6 CAV1 表达对BLCA 总生存期的影响因素COX 回归分析及其Nomogram 模型的构建与评估Fig.6 COX regression analysis of influencing factors of CAV1 expression on overall survival of BLCA and Nomogram model construction and evaluation
单因素COX 回归分析显示,CAV1 与WHO grade 是LGG 患者生存预后的危险因素,均具有统计学意义(P<0.05),种族、病灶位置和性别均无统计学意义(P> 0.05);同时多因素COX 回归分析表明CAV1 与WHO grade 是影响LGG 患者OS 的独立危险因素,均具有统计学意义(P<0.05)。通过CAV1 表达量与LGG 临床病例相关数据构建的Nomogram 模型结果显示,CAV1、WHO grade和年龄对LGG 患者的OS 具有良好效果,模型的一致性良好(Concordance,C-index=0.770),95%CI[0.748~0.792],多因素模型满足比例风险假设,不存在多重共线性(0<VIF<10),该模型校准曲线稳定,见图7。
单因素COX 回归分析表明CAV1 和临床病理分型是HNSC 患者生存预后的危险因素,均具有统计学差异(P<0.05),多因素COX 回归分析显示CAV1 与临床病理分型是影响HNSC 患者OS 的独立危险因素,均具有统计学差异(P<0.05)。基于CAV1 表达量与HNSC 患者临床相关数据构建的Nomogram 模型一致性良好一致性(Concordance,C-index=0.615),95%CI[0.592~0.638],满足比例风险假设且不存在多重共线性(0<VIF<10),该模型校准曲线稳定,见图8。

图8 CAV1 表达对HNSC 总生存期的影响因素COX 回归分析及其Nomogram 模型的构建与评估Fig.8 COX regression analysis of factors influencing CAV1 expression on HNSC overall survival and Nomogram model construction and evaluation
3 讨论
2020 年全球近1 000 万人因肿瘤而死亡,肿瘤的高发病率和高死亡率严重威胁着人类的健康[18],现有的研究证实大多数环境致癌物并不能直接导致肿瘤的发生,需要先在人体内激活活化并结合形成亲电子中间产物才呈现致癌性[19],而基因异常表达是肿瘤发生的内在因素[20],其与各种癌症的发生发展存在一定联系[21-24],从基因角度探索人类肿瘤的发生发展关系,对其生存预后的预测与治疗进行研究是重点。
CAV1 具有与多种信号分子相同的氨基酸序列,其表达量的差异会影响细胞的增殖与迁移[25],通过互补结合调控相关信号通路,形成枢纽中心,调控细胞分化、增殖与衰老,从而参与到肿瘤的形成过程中。生物学中蛋白质合成是通过mRNA分子中碱基排列顺序转变或多肽链中的氨基酸排列组合形成的,本研究结果显示,CAV1 基因在26 种肿瘤中mRNA 表达不同,且差异有统计学意义(P<0.05),CAV1 在HNSC 肿瘤组织中mRNA表达上调,但在蛋白水平上却显示为低表达,这有可能与mRNA 的翻译调控或蛋白质稳定性有关[26]。
通过对TCGA 数据库中CAV1 有差异表达结果的肿瘤与其OS 的相关性分析表明:CAV1 表达与BLCA、LGG 和HNSC 患者预后不良密切相关,K-M 生存曲线显示CAV1 的高表达不利于BLCA、LGG 和HNSC 患者的生存预后。mRNA 基因通过翻译为蛋白质进而在人体内行使复杂的生物学活动,通过HPA 数据库对BLCA、LGG 和HNSC 及其正常组织进行免疫组化分析发现CAV1 在BLCA 中的mRNA 表达与免疫组化结果相反,提示CAV1 在BLCA 患者中行使某些生物学功能表达与mRNA 表达有区别,不过这也可能与HPA数据库中的组织样本量较少有关。
免疫浸润细胞能够影响临床治疗疗效及患者生存期长短[27]。CAV1 在BLCA、LGG 和HNSC这3 种肿瘤中与24 种免疫浸润细胞具有紧密相关性且正相关较多,提示CAV1 参与了免疫反应过程,可能是这3 种肿瘤患者生存预后的潜在免疫调节基因。单因素COX 回归发现CAV1 均是BLCA、LGG 和HNSC 肿瘤患者生存预后的危险因素,其低表达可能会对这3 种肿瘤患者的不良预后具有一定的抑制效果。
综上所述,本研究从多个角度探讨了CAV1在人类肿瘤生存预后中的潜在价值,抑制CAV1在体内的表达对恶性肿瘤的发生可能具有一定作用,CAV1 在多种肿瘤中 与正常组织有差异表达,与BLCA、LGG、HNSC 患者的预后有关且在免疫调节中发挥着巨大作用。但同时也存在着一些局限性:(1)研究基于多个数据库进行分析,各个数据库中存在的组织样本数有一定差别,可能导致分析结果存在偏差;(2)未进行实验分析,缺乏体内体外验证。
本研究对CAV1 在人类肿瘤中的分析结果表明,CAV1 在BLCA、LGG 与HNSC 中可能是一个新的诊断、治疗和预后标志物基因,通过介导多条信号通路从而影响肿瘤的发生发展过程,为癌症的临床服务提供一定的理论基础。

