钙网蛋白通过调节线粒体功能和线粒体合酶促进胃癌细胞转移*
李宁, 张美航, 孟爱国, 王沂, 刘海颖, 王彤
(1华北理工大学附属医院检验科,河北 唐山 063000;2华北理工大学人事处,河北 唐山 063000;3华北理工大学研究生学院,河北 唐山 063000)
胃癌是我国较为常见的恶性上消化道肿瘤之一,我国新发和死亡胃癌患者人数众多,随着早期手术和靶向治疗,胃癌5年存活率显著提高,但其死亡率仍位于全球肿瘤统计的前五位,转移和复发仍然是临床面临的关键问题[1-2],因此寻找调控胃癌转移的关键因子是实现胃癌靶向治疗,提高生存率的关键。
钙离子是细胞内多功能信号分子,参与多种肿瘤的发生[3]。钙网蛋白(calreticulin, CALR)是一种存在于内质网中的钙结合蛋白,参与钙离子稳态、免疫反应、细胞黏附和迁移、基因表达调控、细胞凋亡等多种细胞生物学过程[4-5]。Ye等[6]的研究显示,CALR在胆囊癌组织中表达升高,与胆囊癌细胞增殖、凋亡以及化疗耐药有关。Han等[7]的研究报道,敲减钙网蛋白会导致细胞内游离Ca2+水平失衡,并泄漏到线粒体中,从而激活肿瘤细胞死亡机制。虽然已经有研究报道了CALR在肿瘤进展中的作用,但是其在胃癌转移过程中的作用机制并不清楚。本研究拟通过胃癌AGS和HGC-27细胞和裸鼠腹腔种植转移模型,探讨CALR在胃癌转移中的作用及机制,为胃癌细胞靶向治疗提供参考资料。
材料和方法
1 实验对象
收集2019年1月~2021年1月华北理工大学附属医院病理科胃癌根治术患者胃癌组织及相应的癌旁组织标本各65例,以及16例大网膜转移组织样本作为研究对象。患者术前均未接受其他治疗,本研究患者已签署知情同意书,并通过华北理工大学医学伦理委员会批准。本实验所用胃癌AGS和HGC-27细胞系购自国家模式与特色实验细胞资源库。SPF级雄性BALB/c裸鼠10只,4~5周龄,18~22 g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2021-0006,饲养于华北理工大学动物中心。
2 主要试剂
F-12K培养液、RPMI-1640培养液、胎牛血清、青霉素和链霉素均购自Gibco;CALRsiRNA和CALR过表达质粒(pcDNA3.1-CALR)均由上海生工生物工程股份有限公司合成;CALR抗体、肌浆/内质网Ca2+转运ATP酶A2(ATPase sarcoplasmic/endoplasmic reticulum Ca2+transporting 2,ATP2A2)抗体、ATP酶Na+/K+转运亚基beta 3(ATPase Na+/K+transporting subunit beta 3,ATP1B3)抗体、ATP合酶-偶联因子6(ATP synthase-coupling factor 6,ATP5J)抗体和β-肌动蛋白(β-actin)抗体均购自Proteintech;辣根过氧化物酶标记的山羊抗兔IgG购自北京中杉金桥生物技术有限公司;活性氧(reactive oxygen species,ROS)检测试剂盒、pCMV-Mito-AT1.03(线粒体ATP荧光探针)检测试剂盒、线粒体膜电位检测试剂盒(JC-1)、LipofectamineTM8000转染试剂盒均购自上海碧云天生物技术有限公司;4%多聚甲醛溶液、0.1%结晶紫染液均购自北京索莱宝科技有限公司;Transwell小室购自Corning。
3 主要方法
3.1 细胞培养与实验分组 用含10%胎牛血清和1%青、链霉素的F-12K基础培养液和RPMI-1640培养液在37℃、5% CO2条件下分别对AGS和HGC-27细胞株进行培养,每2~3天传代1次。按照实验设计将细胞分为siRNA-NC组(转染siRNA无义序列)、siRNA-CALR组(转染CALRsiRNA序列)、pcDNA3.1-NC组(转染pcDNA3.1空白质粒)和pcDNA3.1-CALR组(转染CALR过表达质粒),每组实验重复3次。其中CALRsiRNA(hCALR-446)上游序列为5′-GCACGGAGACUCAGAAUACAATT-3′,下游序列为5′-UUGUAUUCUGAGUCUCCGUGCTT-3′;siRNA无义序列上游序列为5′-UUCUCCGAACGUGUCACGUTT-3′,下游序列为5′-ACGUGACACGUUCGGAGAATT-3′。构建CALR过表达质粒(NM_004343.4),克隆位点为Hind III和XhoI,载体为pcDNA3.1(+)ZB02427。取处于对数生长期的细胞,接种于6孔板中,每孔1×105个细胞,细胞融合度达到70%~80%时,严格按照LipofectamineTM8000转染试剂说明书操作进行转染,转染6 h后更换培养液继续培养48 h。
3.2 免疫组织化学检测 将组织样本用甲醛固定,梯度乙醇脱水、二甲苯透明、石蜡包埋、切片机连续组织切片,置于载玻片上67 ℃烘烤15 min;按照免疫组化二步法试剂盒说明书和参考文献[6]步骤进行操作,用二甲苯脱蜡,经梯度乙醇处理,蒸馏水浸泡,抗原修复,滴加Ⅰ抗CALR(1∶100),4 ℃孵育过夜,磷酸盐缓冲溶液(phosphate-buffered saline, PBS)清洗3次,滴加Ⅱ抗,37 ℃孵育1 h,二氨基联苯胺(diaminobenzidine, DAB)显色,苏木素复染,返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封片,采用Image-Pro Plus 6.0图像分析软件对CALR蛋白表达水平进行定量分析,实验重复3次。
3.3 Transwell实验检测 取各组对数生长期的细胞,无血清培养液重悬至1×105/mL,Transwell小室上室中加入200 μL细胞悬液,下室内加入600 μL含10%胎牛血清的细胞培养液,放入24孔板中培养24 h后采用4%多聚甲醛溶液固定20 min,0.1%结晶紫染色20 min,将小室正置于载玻片上,在倒置显微镜下随机取中央及四周5个视野进行观察、拍照并计数,实验重复3次[8]。
3.4 细胞划痕实验检测 取各组对数生长期的细胞加入6孔板中,每孔约5×105个细胞,培养24 h后用200 μL吸头垂直划横线,PBS清洗3次,加入无血清培养液继续培养24 h,200倍显微镜下观察并拍照,细胞迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,实验重复3次[9]。
3.5 细胞内ROS检测 严格按照ROS检测试剂盒说明书操作,取各组细胞接种于6孔板中,无血清培养液清洗2次,将稀释好的2′,7′-二氯荧光素二乙酸酯(2′,7′-dichlorofluorescin diacetate, DCFH-DA)工作液加入到各组细胞中,37℃孵育20 min,无血清培养液清洗3次,荧光显微镜下观察、拍照,采用Image-Pro Plus 6.0图像分析软件对各组细胞ROS荧光强度进行定量分析,实验重复3次。
3.6 线粒体ATP荧光探针检测 严格按照pCMVMito-AT1.03(线粒体ATP荧光探针)检测试剂盒说明书操作,取各组细胞接种于6孔板中,细胞的融合度达到70%~80%时,按照LipofectamineTM8000转染试剂说明书操作,将pCMV-Mito-AT1.03质粒转染到细胞中,48 h后荧光显微镜下观察、拍照,采用Image-Pro Plus 6.0图像分析软件对各组细胞ATP荧光强度进行定量分析,实验重复3次。
3.7 JC-1线粒体膜电位检测 参照线粒体膜电位检测试剂盒说明书进行操作,取各组处理后的细胞接种于6孔板中,加入1 mL细胞培养液,向各组细胞中加入0.5 mL JC-1染色工作液,混匀后放入37 ℃细胞培养箱中孵育20 min,吸除上清液,用JC-1染色缓冲液洗涤2次。加入1 mL细胞培养液,荧光显微镜下观察并拍照,采用Image-Pro Plus 6.0图像分析软件对各组细胞线粒体膜电位水平进行定量分析,实验重复3次。
3.8 细胞Western blot法检测 取各组处于对数生长期的细胞,PBS清洗2次,加入500 μL细胞裂解液,转移至离心管中,16 102×g离心20 min后取上清,BCA法测定总蛋白浓度,100 ℃沸水浴5 min 使蛋白变性,上样、十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)、转膜,0.5%脱脂奶粉封闭2 h,加入Ⅰ抗CALR(1∶1 000)、ATP2A2(1∶1 000)、ATP1B3(1∶1 000)和ATP5J(1:1 000),4 ℃孵育过夜,次日复温后加入Ⅱ抗,37 ℃孵育1 h,PBS清洗3次,滴加增强化学发光(enhanced chemiluminescence, ECL)液暗室曝光显影,以β-actin为内参照,采用ImageJ图像分析软件测定各条带灰度值,实验重复3次[10]。
3.9 胃癌裸鼠腹腔移植瘤模型 将裸鼠随机分为2组,每组5只,取生长状态良好的预培养HGC-27细胞悬液(2×106个细胞),对照组为转染siRNA无义序列的HGC-27细胞,实验组为转染CALRsiRNA序列的HGC-27细胞,胰蛋白酶消化,离心,取细胞悬液注入裸鼠腹腔,两组裸鼠均饲养在相同的SPF环境和营养条件下,21 d后处死裸鼠,剥离肿瘤,按公式(长×宽2/2)计算肿瘤体积[11]。
3.10 组织Western blot法检测 取裸鼠胃癌种植瘤组织,匀浆后加入200 μL组织裂解液,16 102×g离心20 min后取上清液,BCA法测定总蛋白浓度。100 ℃沸水浴 5 min使蛋白变性后存储,其余操作同3.8,实验重复3次[10]。
4 统计学处理
采用SPSS 22.0进行统计学分析,计量资料均采用均数±标准差(mean±SD)表示。两组样本均数间的比较采用t检验;多组样本均数间的比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结果
1 胃癌组织、大网膜转移组织和癌旁组织中CALR蛋白表达水平
免疫组化结果显示,与癌旁组织比较,胃癌组织和大网膜转移组织中CALR蛋白表达水平显著增高(P<0.05),见图1。
2 CALR表达与胃癌患者临床病理特征的关系
CALR阳性表达与胃癌患者的性别和年龄无关(P>0.05),而与浸润深度、TNM分期、淋巴结转移、大网膜转移及存活状态有关(P<0.05),见表1。

表1 CALR表达与胃癌患者临床病理特征的关系Table 1. Relationship between CALR expression and clinical pathological features in gastric cancer patients
3 CALR对AGS和HGC-27细胞侵袭的影响
siRNA-CALR组AGS和HGC-27侵袭细胞数量较siRNA-NC组显著减少(P<0.05),pcDNA3.1-CALR组AGS和HGC-27侵袭细胞数量较pcDNA3.1-NC组显著增加(P<0.05),见图2。

Figure 2. Effect of CALR on invasion ability in AGS and HGC-27 cells (scale bar=50 μm) was detected by Transwell assay. Knockdown of CALR expression significantly inhibited the invasion of AGS and HGC-27 cells, whereas overexpression of CALR significantly promoted the invasion of AGS and HGC-27 cells. Mean±SD. n=3. *P<0.05 vs siRNA-NC group; #P<0.05 vs pcDNA3.1-NC group.图2 CALR对AGS和HGC-27细胞侵袭的影响
4 CALR对AGS和HGC-27细胞迁移的影响
siRNA-CALR组AGS和HGC-27细胞迁移率较siRNA-NC组显著降低(P<0.05),而pcDNA3.1-CALR组AGS和HGC-27细胞迁移率较pcDNA3.1-NC组显著升高(P<0.05),见图3。

Figure 3. Effect of CALR on migration ability in AGS and HGC-27 cells (scale bar=200 μm) was detected by the cell scratch test.Knockdown of CALR expression significantly inhibited the migration of AGS and HGC-27 cells, whereas overexpression of CALR significantly promoted the migration of AGS and HGC-27 cells. Mean±SD. n=3. *P<0.05 vs siRNA-NC group; #P<0.05 vs pcDNA3.1-NC group.图3 CALR对AGS和HGC-27细胞迁移的影响
5 CALR对AGS和HGC-27细胞ROS水平的影响
pcDNA3.1-CALR组AGS和HGC-27细胞ROS荧光强度较pcDNA3.1-NC组显著降低(P<0.05),而siRNA-CALR组AGS和HGC-27细胞ROS荧光强度较siRNA-NC组显著升高(P<0.05),见图4。

Figure 4. Effect of CALR on ROS fluorescence intensity in AGS and HGC-27 cells (scale bar=20 μm) was detected using an ROS detection kit. The ROS fluorescence intensity of AGS and HGC-27 cells was significantly increased after CALR siRNA interference, whereas the ROS fluorescence intensity of AGS and HGC-27 cells was significantly decreased after CALR overexpression. Mean±SD. n=3. *P<0.05 vs siRNA-NC group; #P<0.05 vs pcDNA3.1-NC group.图4 CALR对AGS和HGC-27细胞ROS荧光强度的影响
6 CALR对AGS和HGC-27细胞ATP水平的影响
与siRNA-NC组比较,siRNA-CALR组AGS和HGC-27细胞ATP水平显著降低(P<0.05),与pcDNA3.1-NC组比较,pcDNA3.1-CALR组AGS和HGC-27细胞ATP水平显著升高(P<0.05),见图5。

Figure 5. Effect of CALR on mitochondrial ATP fluorescence intensity in AGS and HGC-27 cells (scale bar=20 μm) was detected by mitochondrial ATP fluorescent probe. The mitochondrial ATP fluorescence intensity of AGS and HGC-27 cells was significantly decreased after CALR siRNA interference, whereas the ATP fluorescence intensity of AGS and HGC-27 cells was significantly increased after CALR overexpression. Mean±SD. n=3. *P<0.05 vs siRNA-NC group; #P<0.05 vs pcDNA3.1-NC group.图5 CALR对AGS和HGC-27细胞线粒体ATP荧光强度的影响
7 CALR对AGS和HGC-27细胞线粒体膜电位水平的影响
siRNA-CALR组AGS和HGC-27细胞线粒体膜电位水平较siRNA-NC组显著降低(P<0.05),而pcDNA3.1-CALR组AGS和HGC-27细胞线粒体膜电位水平较pcDNA3.1-NC组显著升高(P<0.05),见图6。
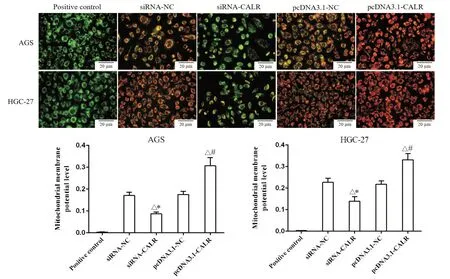
Figure 6. Effect of CALR on the mitochondrial membrane potential in AGS and HGC-27 cells(scale bar=20 μm) were detected by JC-1 Kit. The mitochondrial membrane potential level of the siRNA-CALR group was significantly decreased, while the mitochondrial membrane potential level of the pcDNA3.1-CALR group was significantly increased. Mean±SD. n=3. △P<0.05 vs positive control group; *P<0.05 vs siRNA-NC group; #P<0.05 vs pcDNA3.1-NC group.图6 CALR对AGS和HGC-27细胞线粒体膜电位水平的影响
8 CALR对AGS和HGC-27细胞ATP2A2、ATP1B3和ATP5J蛋白表达的影响
siRNA-CALR组AGS和HGC-27细胞中CALR、ATP2A2、ATP1B3和ATP5J蛋白表达水平较siRNANC组均显著降低(P<0.05),而pcDNA3.1-CALR组AGS和HGC-27细胞中CALR、ATP2A2、ATP1B3和ATP5J蛋白表达水平较pcDNA3.1-NC组均显著升高(P<0.05),见图7。
9 CALR对胃癌裸鼠腹腔移植瘤体积的影响
与siRNA-NC组比较,siRNA-CALR组胃癌裸鼠腹腔移植瘤体积显著减小(P<0.05),见图8。

Figure 8. Effect of CALR on the tumor volume of transplanted tumors in nude mice with gastric cancer. A: nude mouse model of gastric cancer HGC-27 cell transplantation tumor (red arrows indicate the location of the transplanted tumor); B: the volume of HGC-27 cell transplantation tumors. Mean±SD. n=5. *P<0.05 vs siRNA-NC group.图8 CALR对胃癌裸鼠移植瘤体积的影响
10 CALR对胃癌裸鼠腹腔移植瘤组织中ATP2A2、ATP1B3和ATP5J蛋白表达的影响
与siRNA-NC组比较,siRNA-CALR组胃癌裸鼠腹腔移植瘤组织中CALR、ATP2A2、ATP1B3和ATP5J蛋白表达水平显著降低(P<0.05),见图9。

Figure 9. The protein expression of CALR, ATP2A2, ATP1B3 and ATP5J in nude mice with gastric cancer. Mean±SD. n=3. *P<0.05 vs siRNA-NC group.图9 CALR对胃癌裸鼠移植瘤组织中ATP2A2、ATP1B3和ATP5J蛋白表达的影响
讨论
胃癌细胞转移是导致胃癌患者复发率高、生存率低的主要原因,尽管针对胃癌的靶向药物研发取得了显著的成果,但胃癌的预后效果并不理想。近年来,内质网钙稳态信号在癌症发展中的作用逐渐被证实,钙离子稳态调节异常可刺激细胞异常增殖,最终导致肿瘤的发生[12-13]。研究证明,CALR参与多种肿瘤的发生和转移机制,在乳腺癌中,CALR高表达可显著促进乳腺癌细胞的侵袭和迁移[14]。在肺癌中,CALR高表达可显著促进A549 细胞的增殖和裸鼠移植瘤的生长速度[15]。本研究结果也显示,CALR在胃癌组织和大网膜转移组织中高表达,可显著促进两种不同分化程度胃癌细胞的侵袭和迁移,与胃癌患者TNM分期和生存期有关,此外,动物实验还显示,抑制CALR表达可显著抑制胃癌裸鼠移植瘤的体积和生长速度,这些研究说明,CALR在胃癌转移中的关键作用,提示CALR可能是胃癌细胞转移潜在的治疗靶点。
线粒体作为细胞能量代谢的调控中心,通过调控ROS的产生和细胞能量代谢来维持机体内环境稳态。线粒体功能障碍可以通过激活ROS途径促进胃癌细胞的进展和顺铂耐药,在肿瘤的发生中发挥重要作用[16-18]。近期有研究表明,内质网和线粒体间存在脂质转移途径,揭示了内质网与线粒体功能的密切联系[19]。Han等[7]的研究也证实,敲减CALR后内质网释放的钙离子被线粒体摄取,进而影响癌细胞的线粒体功能。本研究细胞实验结果显示,CALR过表达可促进胃癌细胞ATP产生,提高线粒体膜电位水平,抑制ROS生成,而干扰CALR表达可显著抑制ATP产生,降低线粒体膜电位水平,促进ROS生成,提示,调节CALR表达可以影响线粒体功能,并且伴随着胃癌细胞转移能力的改变。我们推测CALR可能调节内质网-线粒体能量代谢的作用路径,并且通过调节ROS影响胃癌细胞转移,本研究虽然观察了线粒体膜电位的变化,但是并没有关注钙离子水平的改变,未来我们将进一步展开研究。
ATP2A2、ATP1B3、ATP5J是ATP合酶相关蛋白,通过调控内质网对钙离子摄取,参与ATP酶分子调节和线粒体能量传导,进而影响线粒体功能[20-22]。本研究结果显示,CALR可以调控ATP合酶相关蛋白ATP2A2、ATP1B3、ATP5J的表达,进而影响AGS、HGC-27细胞线粒体功能,尤其是在动物实验中,敲减CALR可显著抑制胃癌细胞腹腔种植瘤的生长,并显著降低ATP2A2、ATP1B3、ATP5J的表达。我们从体内和体外实验中,揭示了CALR在内质网-线粒体能量代谢路径中的作用,表明CALR可能成为有效防治胃癌细胞转移的靶点。
综上所述,CALR在人胃癌组织和大网膜转移组织中过表达,CALR可通过调节线粒体膜电位和ATP合酶相关蛋白(ATP2A2、ATP1B3和ATP5J)表达介导线粒体功能,进而影响胃癌细胞的转移,敲减CALR可抑制胃癌细胞腹腔种植瘤的生长,本研究为靶向内质网-线粒体能量代谢路径提供了新的依据。[1]Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3):209-249.

