三叉神经节初级感觉神经元在偏头痛中的机制研究进展*
闵晓曼, 崔文强, 孙宁, 张光明, 吴宏赟△
(1山东中医药大学中医学院,山东 济南 250355;2山东中医药大学附属医院神经内三科,山东 济南 250014;3山东中医药大学第一临床医学院,山东 济南 250355)
偏头痛是一种常见的慢性神经血管性疾患,是世界上比较严重的致残性疾病之一。在我国偏头痛的发病率可达9.3%[1]。在美国,偏头痛的患病率大约15%[2]。世界范围内,偏头痛影响15%到18%的人口[3]。偏头痛除了疾病本身对身体造成的伤害之外,还可以导致患者认知功能下降、伴发焦虑抑郁甚至导致缺血性脑卒中发作。偏头痛常发生在一侧头部,患者会伴有恶心、呕吐及对光、声敏感的症状[3]。偏头痛可分为有先兆偏头痛和无先兆偏头痛。有先兆偏头痛患者在发作之前会出现神经系统的先兆症状如视野缺损、构音障碍、面部或四肢末梢的麻木、一侧的轻度偏瘫等;无先兆偏头痛在发作前无明显征兆,但是其发作频率比有先兆偏头痛高,患者经常需要频繁应用止痛药物。目前对偏头痛的治疗以药物为主,急性期常用的治疗药物有非甾体抗炎药、阿片类、曲坦类等,常用的预防性药物有抗癫痫药、β-受体阻滞剂、抗抑郁药、钙通道阻滞剂等,还有5-HT1F受体激动剂、CGRP受体拮抗剂、抗CGRP单克隆抗体等新药物。
三叉神经节(trigeminal ganglion, TG)初级感觉神经元参与偏头痛的发生发展过程,三叉神经节中的离子通道开放之后,突触将兴奋性神经递质、神经肽[如P物质、降钙素基因相关肽(calcitonin gene-related peptide, CGRP)]释放到突触间隙中。神经肽会进一步促进神经源性炎症的发生并导致硬脑膜血管舒张,进而引发或加剧偏头痛。
1 TG初级感觉神经元解剖及生理特点
三叉神经是假单极神经,其神经元在TG中有细胞体并且有向外周和中枢投射的分叉轴突[4]。TG神经元细胞体被卫星胶质细胞紧密包裹着,而其外周端和中枢端末梢被雪旺细胞包裹,TG中的成纤维细胞形成了胶原纤维、小血管和一些免疫细胞,TG从喙外侧缘产生周围神经——眼神经(V1),上颌神经(V2)和下颌神经(V3)[5],TG主要通过V1的神经纤维支配硬脑膜及周围血管,TG神经元的中枢轴突可以投射至三叉神经尾核(trigeminal nucleus caudalis,TNC),TNC整合来自眶周皮肤和颅周肌肉投射的信号,其上行轴突将伤害性信息传递给下丘脑、脑干、基底节核等核团并引起不同的偏头痛症状,如自主神经症状(呕吐、恶心、打哈欠、流泪、排尿)、下丘脑调节功能异常引起的症状(食欲不振、疲劳)、情绪异常(焦虑、易怒)和头痛本身引起的抑郁等[4,6-7](图1)。
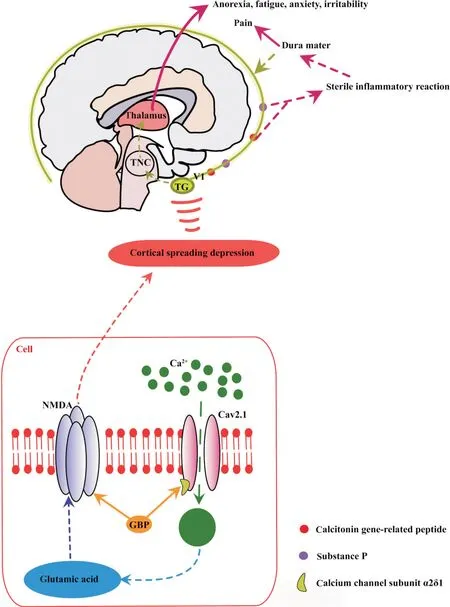
Figure 1. The mechanism of CaV2.1 channels and trigeminal ganglion (TG)causing migraine and drug therapy targets related to CaV2.1 channels. TNC: trigeminal nucleus caudalis; NMDA: N-methyl-D-aspartic acid receptor; GBP: gabapentin.图1 三叉神经节与CaV2.1通道在偏头痛中的作用机制及加巴喷丁药物治疗靶点
缝隙连接在中枢神经系统中大量分布,它们可以连接相邻细胞的细胞质使小分子通过[8]。在正常的神经系统中,缝隙连接通过细胞间通讯促进重要细胞离子(如K+、Na+、Ca2+)的空间缓冲来维持体内环境的平衡,在许多细胞之间都可以观察到以缝隙连接为基础的细胞间通信[8]。在星形胶质细胞、少突胶质细胞、神经元(电突触)、小胶质细胞、室管膜细胞之间,神经元和星形胶质细胞之间以及星形胶质细胞和少突胶质细胞之间都可以观察到以缝隙连接为基础的细胞间通讯。在TG中可以观察到神经元和卫星神经胶质细胞之间的缝隙连接通讯增加,这是三叉神经化学活化的证据之一,通过允许离子和其他小分子在这些细胞之间通过,增加的缝隙连接可以调节神经元和胶质细胞的兴奋性[9]。小胶质细胞和星形胶质细胞会被从各种炎症细胞、受损细胞和神经中释放出来的分子如Ca2+、活性氧等激活并分泌胶质细胞递质,通过间隙连接在星形胶质细胞、小胶质细胞之间直接进行胞质通讯并影响邻近的胶质细胞和神经元,扩大疼痛的范围。
2 初级感觉神经元的离子通道
2.1 电压门控钙通道(voltage-gated calcium channels, VGCC) VGCCs在TG和TNC中大量存在,VGCCs激活和Ca2+内流可使突触囊泡通过胞吐作用将兴奋性神经递质(如谷氨酸)、神经肽(如P物质、CGRP)释放到突触间隙中并导致疼痛[10]。CaV2.1属于VGCC,它的激活可以促进Ca2+内流并导致谷氨酸的释放增多,谷氨酸与N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体的相互作用可以引发皮质扩散抑制(cortical spreading depression, CSD)[10](图1)。P/Q型CaV2.1通道的α1A亚基是由CACNA1A基因编码的,CACNA1A基因突变会引起Ca2+通道的功能改变,导致神经元过度兴奋及持续去极化并引发CSD,介导了家族性偏瘫性偏头痛1型(家族性偏瘫性偏头痛非常罕见,其患者在偏头痛发作时会出现偏瘫、共济失调、昏迷等症状)[11]。钙通道亚单位α 2δ1(calcium channel subunit α2δ1, CaVα2δ1)是VGCC的一个结构亚基,CaVα2δ1的表达上调导致兴奋性突触增多以及突触前兴奋性神经递质的释放增加,进而导致口面部神经病理性疼痛[12-13],加巴喷丁可以与CaVα2δ1结合,通过减少慢性偏头痛患者谷氨酸的释放减少CSD的发生,它也可以直接作用于NMDA受体起到镇痛作用,加巴喷丁还可以通过减少CGRP的释放起到镇痛作用,是偏头痛的临床预防性药物之一(图1)。这说明Ca2+通道可能与CSD以及相关神经肽的释放有关,TG中的Ca2+通道参与了偏头痛的病理过程。
2.2 瞬时受体电位(transient receptor potential,TRP)通道 TRP通道是非选择性阳离子通道,它有6个亚型:TRPC、TRPM、TRPV、TRPA、TRPP和TRPML[14]。TRP通道参与病理性疼痛,特别是炎症性疼痛[15]。在患有神经病理性疼痛的动物中,TRPM8在感觉神经元中的表达与正常的相比显著增加,从而导致其对寒冷的敏感性增加,而很多偏头痛患者会出现冷痛觉超敏(由正常情况的冷刺激引起的异常性疼痛)。在对3组不同偏头痛患者进行的三个独立的全基因组关联分析中,检测到一种与TRPM8通道相关的基因变异与普通偏头痛易感性增加有关,但是尚未有研究证明这种基因突变可以改变TRPM8的功能或者表达[16]。在TG和背根神经节(dorsal root ganglia,DRG)中,大多数TRPV1和TRPA1共表达,TRPV1和TRPA1都可以促进CGRP释放,引起神经源性炎症反应并诱发偏头痛[17-20]。缓激肽类是一种炎症介质,可以激活TRPV1和TRPA1通道,诱导一些炎症的经典症状如血管扩张,在偏头痛发作期,大的颅外动脉和颅内动脉都会出现扩张进而引起疼痛[21-22],TG中的缓激肽类物质可能与TRP通道相互作用进而促进了偏头痛的发作。A型肉毒杆菌神经毒素(botulinum toxin type A, BTX-A)可被用于治疗慢性偏头痛,它可以降低TG中TRPV1和TRPA1的表达并阻断它们的功能[18](图2)。在临床上,TRPV1拮抗剂SB-705498对偏头痛并没有起到明显的改善作用[14],还有许多TRPV1拮抗剂因其在早期临床试验中出现严重副作用而未被批准应用[18]。在小鼠偏头痛模型中,TRPA1受体拮抗剂HC-030031可以显著减轻机械性痛觉超敏和冷痛觉过敏[23]。上述结果表明,TRP通道可能与偏头痛易感性及CGRP、缓激肽类等神经肽的释放存在着关联,TRP通道受体拮抗剂可能是治疗偏头痛的药物研究方向。
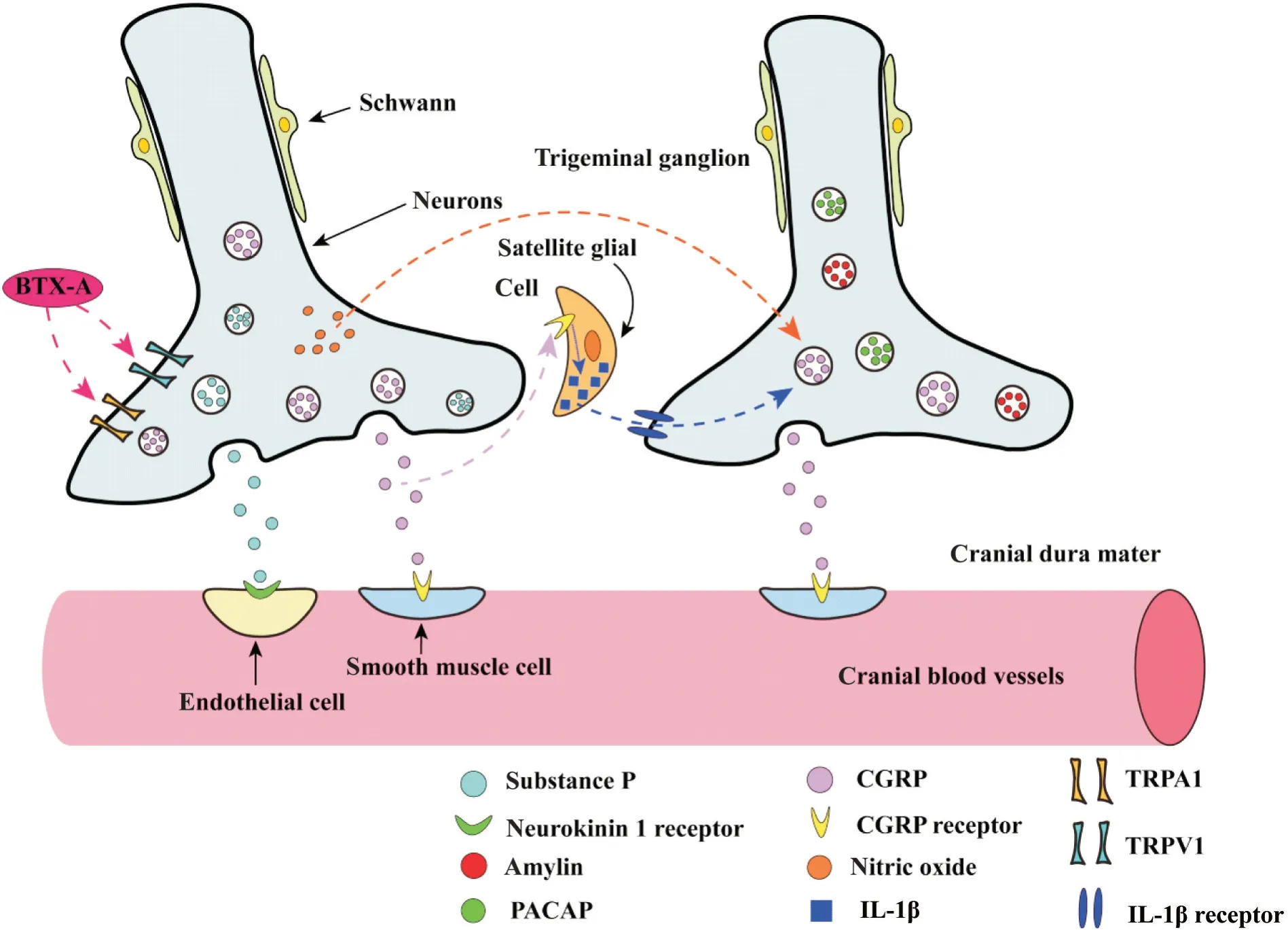
Figure 2. The role of the transient receptor potential (TRP) channels and related neuropeptides in trigeminal ganglion and dura mater during migraine. BTX-A: botulinum toxin type A; PACAP: pituitary adenylate cyclase-activating peptide; IL-1β: interleukin 1β; TRPA1: transient receptor potential ankyrin 1 receptor; TRPV1: transient receptor potential vanilloid 1 receptor.图2 偏头痛发作时TRP通道及相关神经肽在三叉神经节和硬脑膜中的作用
2.3 Na+离子通道 电压门控钠通道(voltage-gated sodium channel, VGSC)对神经元兴奋性有着重要作用,它们可以影响感觉刺激的初始传导、动作电位生成和神经递质的释放[24]。VGSC通道可能与偏头痛存在着联系,编码Nav1.1的SCN1A基因突变会导致散发性/家族性偏瘫性偏头痛[25]。Nav1.7参与人类疼痛的发生和传导,在慢性炎症、神经性疼痛和炎性疼痛中Nav1.7的表达都会上调[26],当人类Nav1.7通道不表达时,除了嗅觉障碍外似乎并没有其他病理症状[27],小鼠伤害感受器中Nav1.7的特异性敲除虽然不能减轻神经病理性疼痛,但能缓解炎症引起的机械痛觉过敏[25],阻断Nav1.7通道可减少 TG 神经元的诱发放电[26]。Nav1.8在小鼠的冷痛和机械性疼痛中起着关键作用[25]。Nav1.8通道阻滞剂A-803467被观察到可以减轻病理性疼痛动物模型中的痛觉超敏和痛觉过敏的发生[28],痛觉过敏和痛觉超敏是慢性偏头痛和先兆偏头痛患者的常见症状。上述实验均表明VGSC的特异性敲除或通道阻滞剂的使用可能是偏头痛新的治疗靶点,但是仍需更多临床前实验来完善。
2.4 K+通道 K+通道包括钙激活型钾离子(calcium-activated potassium, KCa)通道、双P区型钾(twopore-domain potassium, K2P)通道、内向整流型钾(inward rectifier potassium, Kir)通道以及电压门控性钾(voltage-gated potassium,Kv)通道。KCa通道是一类被Ca2+激活的K+通道。MaxiK通道是KCa通道的一种,它们在神经元和平滑肌细胞中的主要功能是维持和恢复静息膜电位[29],在感觉神经元上表达的MaxiK通道在调节炎症性疼痛状况中发挥作用[16];MaxiK通道的激活能够减少神经元放电,并可能减少支配硬脑膜的三叉神经元释放神经递质,减少硬脑膜无菌性炎症的发生。K2P通道在慢性疼痛过程中起着关键作用,在感觉神经元中高度表达的K2P通道的一个亚型TRESK,通过编码TRESK通道的KCNK18基因中的移码突变即F139WfsX24突变可以产生TRESKMT,TRESK-MT已被证明可诱导TG神经元的高兴奋性,与先兆偏头痛的发生可能相关[6]。KATP通道具有血管舒张作用,而引起偏头痛发作的内源性神经递质通常与颅动脉扩张有关。KATP通道开放剂可以激活KATP通道并诱导偏头痛患者的偏头痛发作[30-31]。可见K+通道可能与硬脑膜无菌性炎症、血管舒张以及偏头痛先兆的发生等偏头痛病理过程均有关系。
3 神经肽及其受体
TG表达多种神经肽如CGRP、P物质等,它们诱导的血浆外渗、血管舒张、肥大细胞脱粒都可能在硬脑膜伤害感受器的激活或敏化中发挥作用,血浆外渗和血管舒张都是神经源性炎症反应的重要组成部分[32],在偏头痛的发生发展过程中起到重要的作用。
3.1 CGRP及其受体 CGRP可以舒张TG内的血管,并诱导神经炎症的发生,对偏头痛的触发和疼痛范围的扩大有重要的作用。在偏头痛的发作期,CGRP表达水平增高[33]。TG中分泌的CGRP与邻近神经元和卫星胶质细胞相互作用,维持外周敏化[4]。在外围,CGRP靶向于脑膜以及TG中的神经细胞体,在脑膜中,CGRP可能通过促进神经源性炎症发生导致硬脑膜血管舒张[34]。脑膜中神经活动的调节可能触发反馈回路,最终导致伤害感受器的敏化[34]。TG神经元激活释放的CGRP可以刺激TG胞体分泌NO等信号分子,进而刺激相邻卫星胶质细胞释放白细胞介素1β,合成并释放更多的CGRP,使偏头痛加剧[17](图2)。
目前在临床上已经出现了以CGRP为靶点的药物。CGRP受体拮抗剂rimegepant、ubrogepant和atogepant已被美国食品药品管理局批准用于临床。抗CGRP单克隆抗体也可以有效的与CGRP进行靶向结合,进而预防发作性与慢性偏头痛,目前已经有erenumab、eptinezumab、fremanezumab、galcanezumab等抗CGRP单克隆抗体被用于美国临床。血清素,又名5-HT,5-HT1B/1D亚型与CGRP共表达[35],它们参与调控TG和三叉神经核中CGRP和P物质的释放[36],曲坦类药物是5-HT1B/1D受体激动剂[37],其通过阻断CGRP的释放来缓解偏头痛的急性发作,已经在临床上得到广泛应用。地坦类(Ditans)药物是5-HT1F受体激动剂,Lasmiditan可以激活5-HT1F受体从而减缓偏头痛患者的疼痛。CGRP参与了偏头痛的外周敏化,直接作用于CGRP和间接作用于5-HT的新型偏头痛治疗或预防药物都已经开始在临床上应用,通过减弱外周CGRP 活性来阻断三叉神经敏化可能足以阻断偏头痛发作。
3.2 P物质 P物质是速激肽的一种,一直在偏头痛的病理生理学上备受关注[38]。它广泛的参与了疼痛的传递过程,包括诱导血浆外渗、血管扩张,还参与疼痛信号的中枢传递[39]。P物质和CGRP在TG中共表达[4,17](图2),血浆P物质水平在偏头痛的发作期显著增加[40]。P物质的受体是神经激肽(neurokinin, NK)[39],NK1受体拮抗剂可以在体内抑制P物质诱导的软脑膜动脉血管舒张(图2)。在临床试验中,NK1受体拮抗剂在口服或静脉给药时对治疗或预防偏头痛无效[17]。神经肽Y(neuropeptide Y, NPY)在神经系统中表达,NPY受体Y1亚型在TG和三叉神经尾侧核中都有分布[41]。临床前研究显示,NPY可以通过作用于脊髓背角中的Y1受体抑制P物质的释放[41]。NPY可能影响了偏头痛发生时P物质的释放。以上实验表明,P物质可能诱导了偏头痛发作相关的神经源性炎症,NPY可能调节了P物质的释放。
3.3 垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase-activating peptide, PACAP) PACAP有PACAP-38和PACAP-27两种类型,其中PACAP-38在TG中和CGRP共定位(图2)。在实验中,静脉输注PACAP可以引起健康受试者和无先兆偏头痛患者的偏头痛发作,与非发作期相比,偏头痛患者在发作期的PACAP表达会增加[42]。PACAP和血管活性肠肽都可以[43]结合VPAC1受体(VIP and PACAP receptor 1)和VPAC2受体,但是在偏头痛患者中注射血管活性肠肽不会导致患者偏头痛的发生。同时,PACAP受体1(PAC1)对PACAP的亲和力远远高于血管活性肠肽[43],PAC1受体可能是PACAP诱发偏头痛的重要中间结构,注射血管活性肠肽竞争性抑制PACAP与VPAC1受体结合可能是PACAP干预偏头痛的潜在靶点。
3.4 胰岛淀粉样蛋白(Amylin) Amylin与CGRP具有多处相似,比如它们都属于降钙素肽类[44],长度都是37个氨基酸并且其中有16个氨基酸是相同的[45-46],它们都可以激活AMY1受体[47],并且它们在TG和DRG中共表达(图2)。慢性偏头痛患者的发作间期的Amylin血浆水平较高,这可能是慢性偏头痛诊断的生物标志物之一[48]。Pramlintide是Amylin类似物,Pramlintide诱导的偏头痛发作与CGRP诱导的偏头痛发作具有相似的发作率[47]。Amylin可能与CGRP一样参与了偏头痛,还需要大量实验来明确Amylin与偏头痛的关系。
4 总结与展望
偏头痛病理机制复杂,发病剧烈且难以控制,严重影响患者的正常生活和工作质量[49],甚至会引起严重的心理问题,比如焦虑抑郁。目前,偏头痛机理研究已经取得较大进展,对中枢脑区、核团和外周TG相关靶点机制有了更为深入的认识。本文系统综述了TG初级感觉神经元参与偏头痛发生发展的机制研究进展,包括其相关靶点如Ca2+、Na+、K+离子通道以及CGRP、P物质、PACAP等神经肽。尽管如此,目前对于TG在偏头痛中作用机制的认识仍然是零散的,还需要大量的实验不断补充完善,进而寻找偏头痛发作的确切分子机制。
偏头痛的治疗目前仍是一项挑战,患者偏头痛的急性发作期可能会伴随着恶心、呕吐的症状,导致口服药物的吸收较差。现阶段偏头痛的预防和治疗药物都有着一定的局限性,如非甾体抗炎药、阿片类镇静药可能会引起消化道不良反应,冠心病患者禁用曲坦类药物等。目前CGRP相关药物的研发已经取得了重大进展,治疗用药CGRP受体拮抗剂rimegepant、ubrogepant、atogepant和预防用药抗CGRP单克隆抗体erenumab、eptinezumab、fremanezumab、galcanezumab已经开始在临床上被应用。如前文所述,偏头痛发病机制复杂,治疗或预防药物靶点众多,单一靶向CGRP的药物可能疗效欠佳,改变离子通道的表达并进一步调控相关神经肽的释放的多靶点复方药物可能是未来的研究方向。我们相信新的偏头痛药物或治疗方式将应用于临床,偏头痛患者的生活质量将得到明显改善。

