N-Ac-PGP通过激活TLR4诱导巨噬细胞的M1极化并提高慢性阻塞性肺疾病炎症水平*
刘倩, 杨姣▲, 石西南, 徐悦, 杜晓华△
(1昆明医科大学第一附属医院,云南 昆明 650032;2云南中医药大学,云南 昆明 650500)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种渐发性疾病,主要由吸入刺激性物质引起呼吸道炎症反应,从而导致气流受阻和气管粘膜上皮病变[1-2]。该病在全球范围内发病率和死亡率较高,且目前只有对症的保守治疗方法,例如减少吸入刺激物、增加适量运动、减轻炎症反应等[3]。COPD发病的分子机制很复杂,多种炎性细胞参与了COPD的发病过程。研究显示,在COPD患者的呼吸道组织中,巨噬细胞数量比健康组织高5-10倍,并且巨噬细胞的极化对于COPD的炎症反应有决定性作用[1,4]。进一步的研究观察,巨噬细胞中CD86的表达增加是许多炎性疾病发展的重要因素[5]。同时,CD86和iNOS等的增加,CD11b和CD45等的减少与M0巨噬细胞向M1型的转化有关[6]。研究报道,在LPS诱导的急性肺损伤中,巨噬细胞的Toll样受体4(Toll-like receptor 4, TLR4)表达显著增强[7]。此外,巨噬细胞还可与香烟烟雾中的某些提取物相结合诱导TLR2和TLR4通路的激活,加重肺细胞的损伤,提高炎症水平[8]。呼吸道内TLR4信号通路激活会释放炎性物质,诱导大量炎性因子释放,并聚集巨噬细胞使其向促炎型的M1型极化,加重COPD的病情[9]。由于COPD患者肺组织中的巨噬细胞吞噬功能存在缺陷,未被清除的细菌、凋亡的细胞和一些化学物质持续刺激呼吸系统,导致炎症持续存在[10]。
N-乙酰化脯氨酸-甘氨酸-脯氨酸(N-acetylated proline-glycine-proline, N-Ac-PGP)是由肺部的慢性炎症和肺泡损伤过程中由胶原蛋白经基质蛋白酶降解产生的活性三肽[11]。腰椎间盘中的N-Ac-PGP诱导软骨终板干细胞骨架重排和促炎表型分化,最终促进退行性椎间盘的炎症反应[12]。此外,在COPD患者的痰液和血清中均检测到N-Ac-PGP的表达[13],同时被发现N-Ac-PGP存在于COPD的炎症反应中,因此将N-Ac-PGP视为COPD潜在的生物标志[14]。研究表明,N-Ac-PGP与IL-8的结构和功能相似,可以通过趋化作用将炎性细胞聚集到损伤组织,进一步加重组织的炎症反应促进COPD的发展[15]。据报道,中性粒细胞是慢性炎症的先天免疫细胞,可以被N-Ac-PGP诱导到肺组织炎症部位。但是,N-Ac-PGP在COPD中调节巨噬细胞表型促进炎症的研究还未见报道。
人单核细胞白血病细胞系THP-1被广泛运用于巨噬细胞功能、机制和通路的研究中。根据以前的实验研究,使用佛波脂(phorbol 12-myristate 13-acetate, PMA)诱导处理便能将THP-1细胞转化为M0型巨噬细胞[6]。本研究采用N-Ac-PGP处理M0型巨噬细胞,分析N-Ac-PGP对M1型巨噬细胞诱导的机制。TLR4的异常表达与COPD的炎症有关,故探究N-Ac-PGP是否通过TLR4诱导巨噬细胞M1极化从而促进COPD炎症反应,为减轻COPD的炎症和免疫失调提供参考资料。
材料和方法
1 实验材料
THP-1细胞购于中国科学院昆明动物研究所细胞库;10%胎牛血清、双抗、DMEM培养液和反转录试剂盒购于北京索莱宝科技有限公司;TRIzol RNA提取液和脂多糖(lipopolysaccharide, LPS)购自Invitrogen;PMA购于Sigma-Aldrich;N-AC-PGP购自南京肽谷生物科技有限公司;TLR4抑制剂TAK-242购自AbMole BioScience;BCA蛋白浓度检测试剂盒、ECL试剂、Ⅰ抗、Ⅱ抗和ELISA检测试剂盒购自碧云天生物技术有限公司。
2 方法
2.1 痰液样本纳入及分组 收集2022年8~12月我院呼吸内科因COPD而入院治疗病人13例作为研究对象,纳入符合以下标准的患者:(1)患者病情稳定,近3月病情未恶化;(2)无严重心脑血管疾病;(3)无自身免疫疾病;(4)无恶性肿瘤放化疗。对照组纳入经肺功能和电子支气管镜检查无异常发现者10例作为研究对象,两组在年龄和性别方面的差异均无统计学意义(P>0.05)。根据痰液诱导标准方法[16],雾化前生理盐水清理鼻腔,诱导前15 min吸入200 μg沙丁胺醇,雾化吸入3%高渗盐水以5 min微间隔持续15~20 min,咳出痰液,收集于无菌干燥培养皿中。合格痰液标本使用0.9%的盐水按1∶1稀释,置于-80 ℃冰箱保存。所有受试者均遵循自愿参加原则,签署知情同意书,并经过昆明医科大学第一附属医院伦理委员会批准。
2.2 电喷雾离子化-液相色谱-质谱/质谱(electrospray ionization-liquid chromatrography-mass spectrum/mass spectrum, ESI-LC-MS/MS)检测人痰液中N-Ac-PGP含量 取痰液样本进行质谱分析。使用配备Shimadzu HPLC的MDS Sciex API-4000光谱仪(Aplied Biosystems)测量N-Ac-PGP。采用2.1×150 mm Develosil C30色谱柱进行HPLC(缓冲液A:0.1%甲酸,缓冲液B:乙腈加0.1%甲酸;0~0.6 min内80%缓冲液A/20%缓冲液B,0.6~5 min内0%缓冲液A/100%缓冲液B)。用100%异丙醇/0.1%甲酸冲洗去除背景。N-Ac-PGP的正电喷雾质量跃迁为312-140和312-112。
2.3 ELISA检测COPD患者痰液炎性细胞因子白细胞介素1α(interleukin-1α, IL-1α)和IL-12的表达 痰液离心,取上清液,用ELISA试剂盒按说明书测量细胞因子IL-1α和IL-12的表达量。
2.4 细胞培养及分组 THP-1细胞接种于含10%胎牛血清、1%抗生素(1×105U/L青霉素和100 mg/L链霉素)的DMEM培养液中,37 ℃、5% CO2培养箱中培养。将细胞分成THP-1组(正常培养的THP-1细胞)、PMA组/M0组(使用10 μg/L的PMA处理THP-1细胞24 h,诱导THP-1细胞分化为M0型巨噬细胞[17])、PMA+LPS组/LPS组(使用100 μg/L LPS处理M0型巨噬细胞24 h,进一步诱导M0型巨噬细胞极化为M1型巨噬细胞[18])、N-Ac-PGP组(使用1 μg/L N-Ac-PGP处理M0型巨噬细胞24 h)和N-Ac-PGP+TAK-242组(使用TLR4抑制剂TAK-242和N-Ac-PGP同时处理M0型巨噬细胞,培养24 h)。
2.5 RT-qPCR检测CD11b、CD45、CD86和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的mRNA表达水平 Trizol法提取收集各组细胞总RNA,DNA酶处理后按反转录试剂盒说明书反转录。取2 μL cDNA放入EP管为模板,采用SYBR Green Master Mix反应体系进行扩增,扩增体系为20 μL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次。以GAPDH为内参照,检测目的基因的相对表达。测定模板Ct值,2-ΔΔCt法定量相对表达量。引物由昆明擎科生物科技有限公司合成,序列见表1。

表1 引物序列Table 1. Sequences of the primers
2.6 Western blot检测CD11b、CD45、CD86和iNOS蛋白表达水平 收集各组巨噬细胞,用含有蛋白酶抑制剂的裂解缓冲液裂解细胞,加入胰酶裂解蛋白,用BCA蛋白浓度检测试剂盒测定蛋白浓度。10%SDS-PAGE分离蛋白样本,电转印法将蛋白转印至PVDF膜,加入5%脱脂奶粉封膜处理1小时。加入稀释好的Ⅰ抗4 ℃孵育过夜;次日,去除Ⅰ抗,TBST清洗3次后,加入Ⅱ抗室温孵育2小时。最后进行ECL显色,凝胶成像采集仪收集图像,使用ImageJ分析图像灰度值。
2.7 ELISA检测肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、IL-1β、IL-23和IL-6的水平 收集各组细胞上清液,使用ELISA检测试剂盒,按说明书对细胞上清液中TNF-α、IL-1β、IL-6和IL-23的含量进行检测,绘制标准曲线,计算各个细胞因子的含量。
3 统计学处理
使用SPSS 22.0进行统计分析,所得数据以平均数±标准差(mean±SD)表示。使用Pearson相关系数(r)测试痰液样本中变量之间的关系。两组间差异比较采用t检验,多组间差异比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结果
1 COPD患者痰液中检测到N-Ac-PGP,且与患者痰液中细胞因子IL-α和IL-12显著相关
ESI-LC-MS/MS检查10名对照者和13名COPD患者的诱导痰中的N-Ac-PGP,有11名COPD患者痰液中N-Ac-PGP高出检出限呈阳性,而对照者痰液中N-Ac-PGP呈阴性(图1A)。ELISA检测观察到IL-1α和IL-12在COPD患者中高表达(图1B、C)。COPD患者痰液中的N-Ac-PGP水平与IL-1α和IL-12的表达水平呈显著正相关(图1D、E)。
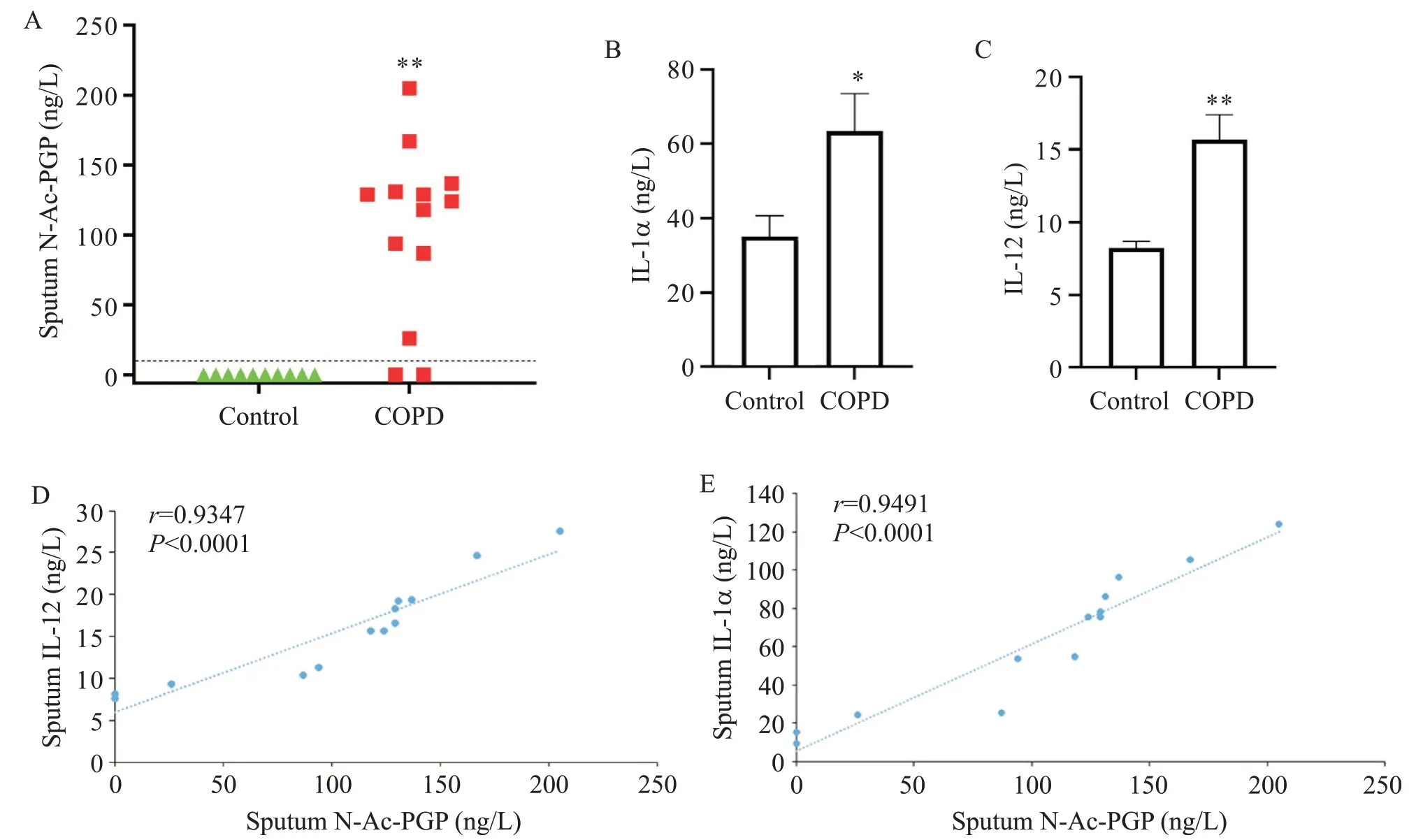
Figure 1. The detection results of sputum samples. A: N-Ac-PGP was measured by ESI-LC-MS/MS with a detection limit of 10 ng/L(dashed line); B and C: the expression of IL-1α and IL-12 in the sputum was detected by ELISA; D and E: the correlation between N-Ac-PGP and IL-12/IL-1α in the sputum of COPD patients was measured by Pearson analysis. Mean±SD. n=10 in control group; n=13 in COPD group. *P<0.05, **P<0.01 vs control group.图1 痰液样本检测结果
2 M0和M1型巨噬细胞模型的构建情况
RT-qPCR和Western blot结果显示,与THP-1和PMA+LPS组相比,PMA组M0型巨噬细胞表面标志蛋白CD11b和CD45的mRNA和蛋白表达水平均显著升高(P<0.01);PMA组M1型巨噬细胞表面标志蛋白CD86和iNOS的mRNA和蛋白表达水平与THP-1组相比无显著差异(P>0.05),但PMA+LPS组CD86和iNOS的mRNA和蛋白表达水平均较其他两组显著升高(P<0.01),见图2。

Figure 2. The mRNA and protein expression levels of M0 and M1 macrophage surface markers. A: the mRNA expression levels detected by RT-qPCR; B: the protein expression levels detected by Western blot. Mean±SD. n=3. **P<0.01 vs THP-1 group; #P<0.05, ##P<0.01 vs PMA group.图2 M0和M1型巨噬细胞表面标志物的mRNA和蛋白表达
3 N-Ac-PGP促进M0型巨噬细胞向M1型极化
RT-qPCR和Western blot结果显示,与M0组相比,LPS和N-Ac-PGP处理M0型巨噬细胞后M1型巨噬细胞表面标志物CD86和iNOS的mRNA和蛋白表达水平均显著升高(P<0.05或P<0.01),见图3A、B。ELISA结果显示,LPS组和N-Ac-PGP组细胞上清液中炎性细胞因子TNF-α、IL-1β、IL-6和IL-23的含量与M0组相比均显著增多(P<0.01),见图3C。

Figure 3. Treatment with N-Ac-PGP promoted the polarization of M0 macrophages to M1-type. A: the mRNA expression levels detected by RT-qPCR; B: the protein expression levels detected by Western blot; C: the expression of cytokines detected by ELISA. Mean±SD. n=3. *P<0.05, **P<0.01 vs M0 group.图3 N-Ac-PGP处理促进M0型巨噬细胞的M1极化
4 N-Ac-PGP通过TLR4促进M0型巨噬细胞的M1极化
RT-qPCR和Western blot结果显示,与N-Ac-PGP组相比,N-Ac-PGP与TAK-242联合处理后M0型巨噬细胞表面标志蛋白CD86和iNOS的mRNA和蛋白表达水平均显著下降(P<0.05或P<0.01),见图4A、B。ELISA结果显示,N-Ac-PGP与TAK-242联合处理后细胞上清液中炎性细胞因子TNF-α、IL-1β、IL-6和IL-23的含量较N-Ac-PGP组均显著减少(P<0.05或P<0.01),见图4C。

Figure 4. Inhibition of the TLR4 pathway by TAK-242 attenuated the promoting effect of N-Ac-PGP on M0 macrophage polarization to M1-type. A: the mRNA expression levels tested by RT-qPCR; B: the protein expression levels detected by Western blot;C: the expression of cytokines detected by ELISA. Mean±SD. n=3. *P<0.05, **P<0.01 vs N-Ac-PGP group.图4 抑制TLR4通路减弱N-Ac-PGP促进M0型巨噬细胞向M1型极化的作用
讨论
COPD是一种慢性疾病,早期症状不明显,确诊时往往已发展至中晚期,严重影响患者的身心健康和家庭生活[19]。COPD发病由炎症、细胞生长、细胞凋亡、细胞异常修复等多种因素引起[2]。COPD患者的痰液和肺中观察到的巨噬细胞数量增加,表明巨噬细胞与疾病的严重程度有关[20]。研究表明,吸入的刺激物会激活呼吸道内的巨噬细胞M1型极化促进炎症增加,M1巨噬细胞在分泌炎性细胞因子引起炎症反应的同时,其较强的吞噬功能也会持续损伤组织[20]。肺部疾病的慢性炎症会导致肺组织破坏,从而导致趋化性胶原蛋白片段N-Ac-GPG的形成。有学者观察到香烟烟雾刺激机体产生N-Ac-PGP,NAc-PGP特异性趋化嗜中性粒细胞入侵肺组织,加速肺组织稳态的破坏[24],但尚未有N-Ac-PGP与巨噬细胞相互作用在COPD中的研究。
本研究初步探讨N-Ac-PGP通过激活TLR4促进巨噬细胞M1极化促进COPD的炎症发生。通过检测COPD患者痰液样本中的N-Ac-PGP和M1巨噬细胞的表达情况,观察到COPD患者痰液中N-Ac-PGP和M1型标志物的表达升高,并且N-Ac-PGP的水平与M1分泌的炎性细胞因子表达水平显著相关,表明N-Ac-PGP可能通过促进巨噬细胞M1极化促进COPD的炎症发生。为了进一步探究N-Ac-PGP与COPD炎症中巨噬细胞M1型极化的联系,使用LPS和N-Ac-PGP处理M0巨噬细胞,结果表明LPS和NAc-PGP对巨噬细胞M1极化均有促进作用。巨噬细胞M1极化后会释放IL-23、IL-1β、IL-6、TNF-α等炎性细胞因子从而引起一系列炎症反应[25]。同样实验结果显示TNF-α、IL-1β、IL-6和IL-23等炎性因子表达上调,可见N-Ac-PGP诱导M0巨噬细胞向M1型极化。已有研究表明,TLR4的高表达对巨噬细胞M1极化有促进作用,例如香烟烟雾中的提取物可以通过直接或间接作用与TLR4受体结合,激活TLR4/NF-κB信号通路参与巨噬细胞的M1极化[26]。此外,在COPD中,紫苏叶提取物或一些药物通过抑制TLR4通路减轻COPD的气道炎症[27]。综合以上因素,接下来探究TLR4通道对于N-Ac-PGP促进巨噬细胞M1极化的影响。在N-Ac-PGP处理的基础上采用TLR4抑制剂处理M0细胞,检测对比巨噬细胞M1极化情况,结果表明TLR4抑制剂对N-Ac-PGP促进的巨噬细胞M1极化有显著的抑制作用,综上所述,N-Ac-PGP激活巨噬细胞M1极化促进炎症需要通过TLR4受体通道。
总之,本研究使用N-Ac-PGP处理M0型巨噬细胞,结果表明N-Ac-PGP对M0型巨噬细胞向M1型极化的有正向调节作用,并通过TLR4通路抑制剂验证了N-Ac-PGP通过TLR4通路促进巨噬细胞M1极化。

