应激诱导蛋白sestrin 3在疾病中的作用*
李彩莉, 潘燕飞, 陶品月, 潘晓, 欧阳子瑶, 樊德净, 潘琪妮, 黄惠桥
(广西医科大学第二附属医院,广西 南宁 530007)
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是细胞功能的中心调节因子,通过mTOR复合物1(mTOR complex 1, mTORC1)和mTORC2在细胞运动、增殖与存活、基因转录、蛋白质合成、自噬等不同的细胞基本过程中发挥重要作用[1-2]。活性氧(reactive oxygen species, ROS)的长期积累会扰乱自由基产生与内源性抗氧化酶清除自由基之间的微妙平衡,导致氧化应激[3]。ROS积累和mTOR信号通路失调发生在广泛的疾病中,包括肿瘤、糖尿病、心血管疾病、神经和精神疾病、衰老等。sestrin (Sesn)是高度保守的应激诱导蛋白,有2个主要的生物学功能:(1)作为抗氧化剂减少ROS的积累;(2)作为mTORC1靶标的抑制剂[4-5]。以往研究表明,Sesn3具有激活AMP活化蛋白激酶(AMP-activated protein kinase, AMPK)、活化mTORC2、抑制ROS积累和mTORC1靶标等多种功能,使Sesn3成为许多病理生理过程潜在调控因子[6-7]。本文就Sesn3在心血管疾病、脂肪性肝病、糖尿病、恶性肿瘤和癫痫中的作用做一综述,为今后Sesn3作为疾病治疗靶点提供一个可能方向。
1 Sesn3背景
Sesn是在动物中普遍存在的进化上高度保守的应激诱导蛋白家族,其通过响应不同内、外部环境压力执行各种生物学功能,保护生物体免受各种有害刺激,包括DNA损伤、氧化应激、饥饿、内质网应激和缺氧等[8-9]。无脊椎动物表达一个Sesn直系同源物,如秀丽隐杆线虫和果蝇(分别为cSesn和dSesn);而哺乳动物表达3个Sesn旁系同源物,分别为Sesn1、Sesn2和Sesn3[5]。Sesn1(或PA26)通过使用四环素调控的方法激活p53,在人骨肉瘤细胞系中被鉴定出来[10]。Sesn2(或HI95)在人神经胶质瘤细胞系缺氧筛选微阵列中检测到[11]。Sesn3是对PA26基因结构的分析中鉴定出的一种新PA26相关基因家族[12]。据预测,Sesn家族成员都是α螺旋区域组成的球状结构域蛋白,其紧密结构相似性表明伴随的功能相似性[11]。X射线晶体学测定人SESN2结构表明[13],Sesn2包含两个结构相似的子结构域Sesn-A和Sesn-C,通过螺旋-环-螺旋结构域(Sesn-B)连接;Sesn-A起到烷基过氧化氢还原酶的作用,而Sesn-C则起到mTORC1抑制作用。但迄今为止Sesn1和Sesn3结构特征仍有待进一步研究。
Sesn是在成人中普遍表达的蛋白质[12],不同Sesn基因表达水平存在组织特异性差异。Sesn3作为Sesn家族的一员,在大脑、肾脏、小肠、结肠、胎盘和骨骼肌中表达较高[12]。Sesn3基因位于人染色体11q21上,编码一个由492个氨基酸组成的蛋白质,其产生两种选择性剪接变体分别编码分子量为44 kD (Sesn3S)和53 kD (Sesn3L)的蛋白[6]。不同于Sesn1和Sesn2受肿瘤抑制蛋白p53调节,Sesn3主要由叉头框蛋白O(forkhead box protein O, FoxO)激活。激活的FoxO可特异性提高Sesn3的表达[14]。FoxO1与Sesn3第一内含子内的250 bp区域结合,转录上调Sesn3 mRNA的表达,提高AMPK活性,以TSC2依赖的方式抑制mTORC1信号转导,调节自噬、葡萄糖和脂质代谢[6]。Sesn3还可通过Rictor (rapamycin-insensitive companion of mTOR)与mTORC2交互,直接激活mTORC2-Akt信号通路,在胰岛素敏感性和葡萄糖稳态中发挥有益作用,且独立于mTORC1-S6K反馈调节[15-16]。ROS的积累会导致细胞对脂质、核酸、蛋白质的氧化损伤,与各种病理因素密切相关[17]。Sesns在氧化应激下被p53、Nrf2、FoxO等转录因子激活,通过自噬的AMPK-mTORC1信号传导途径及mTORC1的负反馈来促进氧化还原稳态,抑制ROS的形成[18]。据报道,Sesn N端的一个保守区域与结核分枝杆菌烷基过氧化氢还原酶D(alkyl hydroperoxide reductase, AhpD)蛋白具有序列和结构同源性,该同源性跨越了Sesn保守区域的至少5个N端螺旋结构域和AhpD的C端螺旋结构域[4]。AhpD是一种参与抗氧化防御的过氧化物酶,可以催化AhpC的再还原,直接或间接清除过量ROS[19]。Sesn3与AhpD的同源性及ROS稳态的间接调控表明,其通过发挥氧化还原酶活性及激活抗氧化信号通路来降低细胞内的ROS水平。Sesn3作为一种多功能蛋白,通过不同机制参与生理病理状态下细胞稳态的维持,在疾病中发挥重要作用。
2 Sesn3在疾病中的作用
2.1 Sesn3与心血管疾病 心血管疾病包括冠心病、心房颤动、高血压等,目前仍是全球死亡的主要原因[20],动脉粥样硬化是其最常见的病理基础。动脉粥样硬化已知的主要危险因素,如血脂异常、糖尿病、高血压都与氧化应激有关,氧化应激的特征是氧化剂和抗氧化系统之间的不平衡,导致ROS增加[21]。过量产生的ROS影响脂质/DNA的氧化修饰、内皮功能障碍和炎症,从而成为促动脉粥样硬化发生发展的主要危险因素[22]。Sesn3具有抗氧化特性,能够抑制ROS水平发挥抗氧化应激作用保护心血管疾病。
欧洲动脉粥样硬化炎症和血管壁重塑-血管内超声(ATHEROREMO-IVUS)合作项目对斑块形态进行了全基因组关联研究,发现IVUS衍生的易损斑块指标与斑块内或附近8个不同基因中的12个单核苷酸多态性(single nucleotide polymorphisms, SNPs)之间有很强的相关性;进一步分析显示有两个SNPs与冠状动脉疾病/心肌梗死之间显著关联,这两个SNPs编码两个基因,Sesn3是其中之一[23],表明Sesn3与动脉粥样硬化的发展有一定的关联。据Dong等[24]报道,永久性心房颤动患者心房内Sesn3蛋白在细胞质和细胞核中广泛可见,其表达水平显著高于窦性心律患者;Sesn3过表达显著降低了HL-1起搏细胞ROS的产生,提高细胞存活率,而Sesn3敲低增加了ROS积累,表明Sesn3被诱导发挥抗氧化应激并在房颤中提供保护。在冠状动脉疾病患者中,其血浆Sesn3的水平升高,且与丙二醛的水平及Gensini评分呈正相关[25]。Sesn3水平亦在高血压患者血浆中升高,与血压值呈正相关,与经动脉粥样硬化斑块的存在呈负相关[26],表明Sesn3可能有助于预防和延缓动脉粥样硬化的发展。因此,Sesn3水平可能通过响应氧化应激而增加,并充当抗氧化剂保护器官组织免受损害。此外,与Sesn3同源的Sesn2促进p62依赖性自噬,上调Keap1/Nrf2信号通路,抑制ROS产生,从而保护内皮祖细胞免受血管紧张素II的影响[27]。总之,Sesn3可能基于结核分枝杆菌AhpD蛋白与Sesn家族序列和结构的同源性,直接发挥抗氧化酶活性和调节抗氧化信号传导来调节氧化还原平衡,在心血管疾病中发挥抗氧化应激作用,但其确切的机制仍需进一步研究。
2.2 Sesn3与脂肪性肝病 脂肪肝是一种常见的肝脏病理变化,由各种原因导致肝细胞中脂肪过度堆积的病变,分为酒精性肝病和非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD),二者均是慢性肝炎和肝硬化的主要原因,其发病机制复杂,肝脏脂质的积累、纤维化起了重要作用[28-29]。脂肪肝特别是NAFLD已成为一种流行的慢性肝病,因此确定新的靶点对于脂肪肝的早期干预和治疗至关重要。已有证据表明Sesn3能够减轻肝脏炎症、纤维化和损伤[30-31],在肝脏疾病中起到保护因子的作用。
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)是NAFLD更严重的形式,也更容易发展为肝硬化和肝癌[32]。已有文献报道TGFβ-Smad3信号通路的激活在促进肝纤维化的发生发展中具有至关重要的作用[33]。Huang等[31]报道,Sesn3在NASH患者肝脏中表达降低,且随着肝纤维化程度加重而降低。Sesn3敲除小鼠和野生型小鼠相比,在高脂饮食喂养中表现出了严重的肝脂肪病变,肝脏/血清甘油三酯和胆固醇水平显着升高,肝纤维化加剧。人肝星状细胞Sesn3过表达使TGFβ刺激的Smad3磷酸化降低了75%,抑制纤维化基因Acta2、Col1a1、Col3a1和Timp1表达,且TGFβ缺失几乎没有核Smad3,表明Sesn3抑制TGFβ-Smad3途径阻断了纤维化[31]。此外,免疫共沉淀显示Sesn3与Smad7相互作用并抑制TGFβ受体[31]。Sesn3对TGFβ-Smad3信号传导表现出双重抑制,提供了一种针对肝纤维化的新型调节机制。Sesn2被报道可部分通过激活AMPK及抑制ROS产生,拮抗TGFβ-Smad信号通路[34],提示Sesn3存在类似作用机制。在小鼠酒精性肝损伤中,Sesn3过表达消除酒精对AMPK磷酸化的影响,抑制mTOR主要下游靶标p70 S6激酶磷酸化,增加自噬标志物LC3-II水平,减轻肝脂肪变性[30]。Sesn1/2/3不仅能与JNK2直接通过蛋白与蛋白相互作用抑制JNK磷酸化和活性,还可以通过抑制MKK7对JNK磷酸化来抑制JNK信号通路,保护肝脏免受脂毒性相关的氧化应激[35]。由此可见,Sesn3调节AMPK/mTOR、TGFβ-Smad3及JNK信号转导通路在脂肪性肝病中发挥有益作用。
2.3 Sesn3与糖尿病 2型糖尿病是一种代谢性慢性疾病,胰岛素抵抗和胰岛素分泌损伤是其病理生理学关键因素[36]。胰岛素抵抗是胰岛素敏感性降低和(或)胰岛素反应性下降的状态,当组织对胰岛素不敏感伴胰腺胰岛素分泌不足时,会发生2型糖尿病[37]。AMPK和mTORC1在能量和营养稳态中起着关键作用,AMPK激活能促进β细胞的存活,并抑制胰岛素抵抗,还能促进葡萄糖代谢和摄取,有助于维持机体葡萄糖稳态[38]。已有证据显示,Sesn3可通过激活AMPK和mTORC2以及抑制mTORC1在代谢控制和葡萄糖稳态中起关键作用[15-16],从而在糖尿病中发挥有益作用。
据一项研究分析显示,受试对象血清Sesn3的mRNA表达与空腹血糖、餐后血糖及糖化血红蛋白水平和HOMA-IR呈负相关,提示Sesn3与胰岛素敏感程度有关[39]。Sesn3在糖尿病小鼠血清中显著降低,全身Sesn3敲除小鼠加重高脂饮食诱导的血脂异常和葡萄糖耐受不良[16,40]。Sesn3与Rictor(mTORC2的特定成分)结合高于与Raptor (regulatory-associated protein of mTOR; mTORC1关键成分)的结合[16]。C2C12成肌细胞Sesn3过表达增强了Rictor与mTOR的结合,同时降低Raptor与mTOR的关联,提升mTOR的S2481位点及蛋白激酶B(protein kinase B,PKB/AKT)的S473位点磷酸化水平,提示Sesn3促进mTORC2的活性,激活AKT[16]。Rictor-siRNA减弱了Sesn3的上述作用,同时降低pAS160-Thr642蛋白与葡萄糖转运蛋白4表达,削弱SESN3促成肌细胞摄取葡萄糖作用,表明Sesn3通过mTORC2/AKT信号通路调节糖代谢[16]。此外,AMPK活性降低会负性调控胰岛素信号传导,同时增加mTORC1活性,促进胰岛素抵抗[41]。Sesn2基因敲除小鼠、Sesn3基因敲除小鼠和dSesn-null苍蝇均容易发生胰岛素抵抗及随后的血糖稳态失调[42]。Sesn2被证明提高AMPK活性来负调节mTORC1-S6K轴,还能直接与GATOR2蛋白相互作用活化mTORC2,激活AKT信号转导维持肝胰岛素敏感性[42-43]。Sesn3和Sesn1/2一样,能提高AMPK活性[6]。此外,Sesn3受到FoxO转录上调被证明可引起AMPK/TSC1/2轴激活,从而抑制mTORC1活性[6],参与调节肝胰岛素敏感性和葡萄糖代谢。
2.4 Sesn3与恶性肿瘤 恶性肿瘤作为一种严重威胁人类健康的疾病,因机体细胞失去正常调控,过度增殖而引起[44]。其疾病机制复杂,Sesn3通过降低癌肿瘤细胞的生长、增殖、转移参与恶性肿瘤抑制,但Sesn3在肿瘤疾病中的作用似乎是有矛盾的。Liu等[45]研究发现,Sesn3敲除小鼠在致癌物质和高脂饮食联合喂养后,肝总肿瘤计数和肿瘤体积均显著增加;且相较于野生型小鼠未观察到肝肿瘤转移,30%的Sesn3敲除小鼠出现肝肿瘤转移,表明Sesn3具有抑制肝肿瘤发展和转移的作用。Gli2具有致癌作用,是Hedgehog信号通路的核心组成部分之一,Sesn3表达上调阻断了Gli2核易位,提示Sesn3可通过调控Hedgehog信号通路的传导,成为肝细胞癌的肿瘤抑制因子[45]。据报道,mTORC1的慢性激活与各种代谢性疾病的风险增加有关,Sesn2通过激活AMPK,抑制mTORC1的活性来减弱子宫内膜癌细胞增殖和迁移,发挥抗癌作用[46]。Sesn3的表达随着子宫内膜样腺癌的发展而下降,且Sesn3阴性死亡病例生存时间短与Sesn3阳性[47],提示Sesn3发挥抑癌基因的作用,可能与Sesn3的转录激活是抑制mTORC1慢性激活的负反馈机制之一有关。然而,有研究提出了Sesn3在肿瘤发展的相反作用,即发挥癌基因的作用。在食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)中,lncRNA SNHG22敲低抑制的ESCC细胞增殖被Sesn3过表达抵消[48],表明Sesn3在ESCC中的致癌作用。此外,Sesn3的同源家族Sesn2也被证明具有癌基因作用,能促进肺癌、胰腺癌等恶性肿瘤的发展[49]。总而言之,Sesn3调节癌症中的功能是双向的,其机制需要进一步探索和验证。
2.5 Sesn3与癫痫 癫痫是一种严重的神经系统疾病,是由不同病因导致脑部神经元高度同步化异常放电所致,神经退行性蛋白的积累、细胞炎症因子的释放(如TNF-α和IL-1β)、神经元电压和配体门控离子通道的变化、神经递质的释放等参与癫痫发生的过程[50]。目前针对Sesn3在癫痫中的研究似乎也是存在矛盾的。Johnson等[51]发现,Sesn3在颞叶癫痫患者海马体中高表达,与Module-1(含炎症基因如与癫痫相关的IL-1和TLR信号通路)表达呈正相关;Sesn3敲除后减弱化学诱导的斑马鱼癫痫发作及c-Fos蛋白和Module-1表达;Sesn3过表达致海马神经元中Module-1基因上调,特别是促炎基因的上调,从而诱导神经元兴奋性变化,提示Sesn3对癫痫中促惊厥转录程序的遗传调控。同样,Shi等[52]也发现Sesn3表达的上调通过下调Kv4.2介导的IA电流在糖尿病动物的海马兴奋过度中起重要作用,并促进缺血后癫痫的发生。有证据表明,mTOR失调可能通过调节Kv4.2介导的IA电流致复发性癫痫发作[53],提示Sesn3可能通过调节mTOR通路在癫痫发展中起作用。前两项研究表明了Sesn3可能作为调节脑炎症和中枢神经系统兴奋性的靶点,影响癫痫的基因网络成为更加有效的治疗方法。然而Huang等[54]的研究显示,沉默rno-miR-155可以抑制癫痫的相关病理特征,Sesn3是rno-miR-155的靶基因,rno-miR-155拮抗剂促进Sesn3表达,从而间接减少氧化应激,保护大脑免受癫痫发生相关的损伤。虽然Sesn3在癫痫的作用机制似乎存在不一致,但是Sesn3被证明是癫痫疾病中的重要靶点,具有极大治疗潜力。
3 小结与展望
综上所述,Sesn3通过激活AMPK、调节ROS形成和mTOR,感知细胞内外环境,维持代谢稳态,对年龄相关的细胞病变具有多种生物学功能。因此,利用生物活性分子靶向调节Sesn3的研究可以确定其作为各种疾病的治疗靶点。目前,Sesn3在各种人类疾病中的保护作用仍有极大吸引力,但Sesn3在疾病中的作用机制复杂(图1),其确切的机制仍需进一步研究。此外,Sesn3在调节恶性肿瘤与癫痫中的作用似乎是双向的,故其机制需进一步探索与验证。
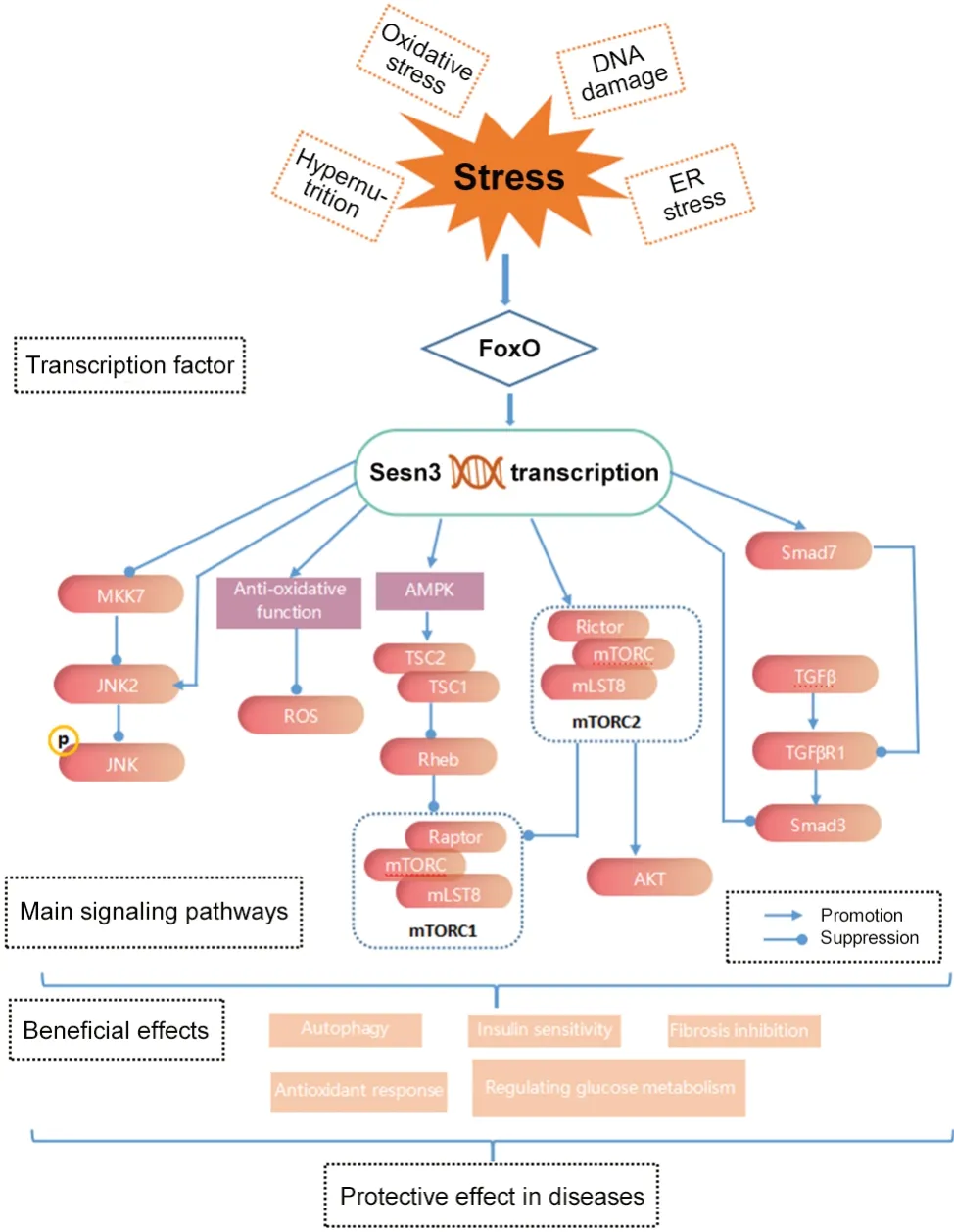
Figure 1. Protective mechanisms of Sesn3 in related diseases.ER: endoplasmic reticulum; FoxO: forkhead box O protein; ROS: reactive oxygen species; AMPK: AMP-activated protein kinase; TSC1: tuberous sclerosis complex 1/hamartin; TSC2: tuberous sclerosis complex 2/tuberin; mTOR: target of rapamycin; mTORC1:mTOR complex 1; Rheb: Ras homolog enriched in brain; Raptor: regulatory-associated protein of mTOR;MLST8: mTOR-associated protein, LST8 homolog;Rictor: rapamycin-insensitive companion of mTOR;TGFβ: transforming growth factor β; TGFβR1: TGFβ receptor 1; MKK7: mitogen-activated protein kinase kinase 7; JNK: c-Jun N-terminal kinases; p: phosphorylation.图1 Sesn3在相关疾病中的保护机制

