不同细胞系对胃癌来源外泌体的吸收差异①
王 炜 郭玲慧 张 岱 任伟宏(河南中医药大学第一附属医院,郑州 450000)
细胞外囊泡(extracellular vesicles,EVs)是由细胞主动分泌的纳米级膜囊泡,根据大小、生物学特征及形成机制的不同,通常将EVs分为微囊泡、外泌体和凋亡小体。目前认为外泌体是细胞在正常或病理条件下分泌的直径为40~180 nm 的双层脂质囊泡[1]。它们由晚期内体形成,并表达内体通路的特定标志物,例如四跨膜蛋白(CD63、CD9、CD81),但也表达HSP70 和Rab 家族蛋白、Tsg101 和Alix,这些标志蛋白在其他类型的囊泡中检测不到。四跨膜蛋白(CD63、CD81 和CD9)在过去的二十年中已被用作外泌体标志物。最近的研究显示,含有CD9/CD81 或CD63 标记的EVs 产生方式存在差异[2]。带有少量CD63标记的EVs主要从质膜出芽;而带有大量CD63 和少量CD9 的EVs 在内体隔室中形成并被分泌出细胞,这部分EVs称为外泌体。
外泌体中含有各种生物分子,如蛋白质、RNA(mRNA、miRNA 和其他非编码RNA)、DNA(线粒体DNA 和病毒DNA 等)、脂质、氨基酸和代谢物[3-4]。肿瘤细胞来源的外泌体可以作为信息的传递者,将其携带的生物分子传递给邻近或者远处的受体细胞,在肿瘤微环境中发挥着免疫抑制作用[5-8]。目前的研究多是针对免疫细胞,是否有正常组织细胞可以摄取肿瘤细胞来源外泌体以及免疫细胞摄取肿瘤来源外泌体的比例。而分析不同组织细胞摄取肿瘤外泌体的情况可以帮助理解肿瘤分泌的外泌体对机体各组织的影响范围。
为了观察不同细胞系摄取外泌体的能力,使用绿色荧光蛋白(green fluorescent protein,GFP)融合CD63(hCD63)分子示踪外泌体。使用流式细胞术分析不同组织来源的细胞系对胃癌细胞来源外泌体的摄取情况。
1 材料与方法
1.1 材料 pLVX-puro质粒、psPAX2质粒、pMD2.G质粒由本实验室保存。RPMI1640、DMEM、胰蛋白酶、青链霉素、嘌呤霉素购自索莱宝公司;opti-MEM购自Gibco 公司;胎牛血清购自Biological Industries公司;高保真DNA 聚合酶、限制性核酸内切酶、T4 DNA 连接酶、DNA marker 购自TaKaRa 公司;聚乙烯亚 胺(Ethylene imine polymer,PEI)、聚凝胺和HEPES 钠购 自Sigma 公司;Milipure 超滤管购自默克;NucleoBond Xtra Midi 试剂盒购自德国MN 公司;MGC803、GES-1 细胞购自湖南丰晖生物有限公司;HEK293T 细胞本实验室保存;THP-1 细胞、A549 细胞及CACO-2 细胞由河南省病毒性疾病中医药防治重点实验室馈赠。引物合成及基因测序由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 质粒的构建 采用逆转录PCR 方法,从GES-1 细胞中克隆hCD63 分子。设计hCD63 和mNeptune 的引物,融合蛋白N 端基因的3´端引物与C 端基因的5´端引物重叠20 bp 碱基,先分别使用各引物进行扩增25 个循环,扩增产物稀释500 倍后,使用融合基因的上游及下游引物进行第二轮PCR合成融合基因;用限制性核酸内切酶酶切融合基因和pLVX-Puro 慢病毒载体,琼脂糖凝胶电泳纯化酶切产物。T4 DNA连接酶连接融合基因和pLVX-Puro慢病毒载体。连接产物转化E.coliDH5α 感受态细胞后挑取菌落送生工生物工程(上海)股份有限公司进行基因测序,检测插入的基因是否完整和正确。hCD63 基因通过酶切连接入pLVX-AcGFP1 载体中,引物序列见表1。

表1 质粒构建中使用的引物Tab.1 Primers used in plasmid construction
1.2.2 不同标记方法的比较 采用瞬时转染方法比较荧光蛋白与hCD63不同融合方式对荧光强度的影 响。pLVX-CD63/mNeptune-puro、pLVX-mNeptune/CD63-puro、pLVX-CD63-AcGFP1 质粒使用PEI转染HEK293T。转染72 h 后采用倒置荧光显微镜观察荧光信号并收集细胞,采用流式细胞仪检测细胞中含有红色荧光信号细胞的比例及平均荧光强度。实验重复2次,结果采用独立样本t检验分析。
1.2.3 慢病毒包装浓缩 目前有两种方式标记hCD63 分子,一种是在hCD63 分子的氨基端标记荧光蛋白,另一种是在hCD63 分子的羧基端标记荧光蛋白[9-10]。为比较两种方法的优劣,使用mNeptune红色荧光蛋白基因分别融合在hCD63 基因的氨基端和羧基端,构建了两种慢病毒转移质粒。此外使用AcGFP1 绿色荧光蛋白对hCD63 分子进行标记,并与红色荧光标记的hCD63 进行比较。慢病毒颗粒的包装采用修改的方法[11]。简而言之,HEK293T细胞生长到60%融合时,使用25 mmol/L氯喹处理5 h后加入基因转移质粒、psPAX2、pMD2.G(4∶3∶1)。转染后分别在48 h 和72 h 收集细胞培养液上清。含有慢病毒颗粒的上清液结合差速离心、过滤及超滤进行感染颗粒的浓缩。使用ELISA 检测P24,对浓缩后的感染颗粒浓度进行估算[12]。
1.2.4 标记细胞的筛选及鉴定 使用pLVXCD63-AcGFP1 包装的慢病毒颗粒感染MGC-803 细胞,感染细胞4 d 后,加终浓度为10 µg/ml 嘌呤霉素筛选稳定表达重组hCD63-AcGFP1的MGC-803细胞系。嘌呤霉素筛选4 周后,交替使用有限稀释法和克隆挑取法筛选稳定表达绿色荧光蛋白的MGC-803 细胞株。使用共聚焦显微镜观察荧光信号的定位。
1.2.5 标记外泌体的制备及鉴定 外泌体采用饥饿培养及超速离心机制备[13]。使用RPMI1640 基础培养基培养荧光标记的MGC-803 细胞48 h 后收取上清。2 000 g 离心20 min 去除细胞,10 000 g 离心30 min除细胞碎片。并采用0.22 µm 一次性过滤器过滤,去除>200 nm 囊泡。用截留分子量为100 kD的超滤管进行超滤,去除杂蛋白。浓缩后的外泌体使用超速离心机收集外泌体。并用透射电镜观察制备的外泌体形态。通过BCA 蛋白检测试剂盒检测外泌体浓度。将外泌体的浓度调整为4 mg/ml。
1.2.6 流式细胞术分析标记外泌体的摄取 终浓度为500 µg/ml的标记外泌体和2×105个不同组织来源细胞(HEK293T 人胚肾细胞、CACO-2 结肠癌细胞、GES-1人胃黏膜细胞、A549人肺癌细胞和THP-1单核细胞系样细胞)加入12孔板中孵育24 h后使用流式细胞仪检测细胞荧光信号[14]。空白对照组使用未标记的外泌体进行共孵育培养。
2 结果
2.1 hCD63 与荧光蛋白融合基因的构建 使用重叠PCR 构建融合基因,如图1。Marker1 是DL2000;Marker2 是DL15000。图1A 显示在750 bp marker 旁有两条带,分别与hCD63 和mNeptune 基因大小近似;在1 000 bp 和2 000 bp marker 旁有一条带与融合基因hCD63/mNeptune 大小近似。使用酶切连接方法将融合基因与pLVX-puro 连接。重组质粒进行双酶切验证结果如图1B。pLVX-CD63-AcGFP1-PURO 质粒双酶切结果如图1C。融合基因Sanger 测序峰如图2,hCD63 和mNeptune 基因以正确的读码框连接在一起。

图1 重组质粒构建结果Fig.1 Construction result of recombinant plasmid

图2 融合基因测序结果Fig.2 Results of fusion gene sequencing
2.2 不同标记方法的比较 质粒pLVX-CD63/mNeptune-puro、pLVX-mNeptune/CD63-puro 转染HEK-293T 细胞后的流式细胞仪分析结果,如图3。图3A显示不同标记方法使HEK293T 细胞携带荧光的细胞比例。hCD63分子羧基端标记方法转染细胞的荧光携带比率为96.8%;氨基端标记的荧光携带比率为88.5%。携带荧光信号细胞比例在两种标记方法中差异无统计学意义(P>0.05)。不同标记方法在细胞内产生的荧光强度比较,如图3B。hCD63 羧基端标记和氨基标记方法在细胞中产生的荧光信号存在差异。hCD63分子羧基端标记的荧光蛋白发出的荧光信号在细胞内的平均荧光强度比氨基端标记的强,差异具有统计学意义(P<0.05)。图4B绿色荧光蛋白标记的细胞在显微镜下的显示的亮度比图4A 红色荧光强。绿色荧光标记的细胞可以清晰显示出细胞膜轮廓,红色荧光标记的细胞轮廓较为模糊。

图3 细胞携荧光强度的比较Fig.3 Comparison of cell fluorescence intensity
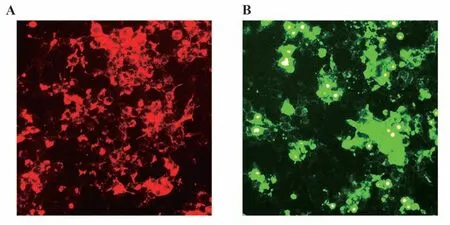
图4 不同荧光颜色标记hCD63在HEK293T细胞的比较Fig.4 Comparison of hCD63 labeled with different fluorescent colors in HEK293T cells
2.3 荧光标记细胞的筛选结果 选择绿色荧光蛋白AcGFP1 对hCD63 标记。筛选得到的细胞克隆如图5A所示。绿色荧光信号分布于细胞表面,在细胞与细胞连接处荧光信号增强。提示标记的hCD63与天然分子一样定位于细胞膜上。为进一步确定荧光信号在细胞内的定位,使用共聚焦显微镜进行观察,结果如图5B。绿色荧光信号主要聚集在细胞膜上,荧光蛋白的标记没有干扰hCD63 分子在细胞内的点位。白色箭头所示为即将从细胞膜上分离的细胞囊泡结构。
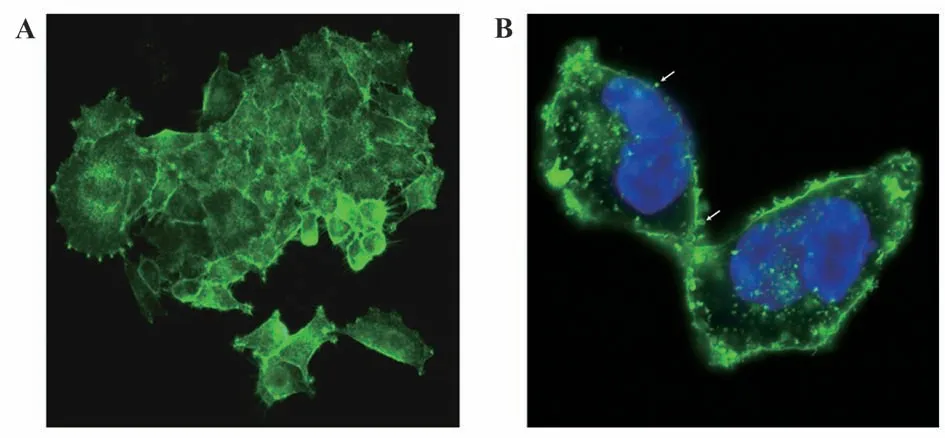
图5 绿色荧光标记hCD63细胞株的筛选Fig.5 Screening of hCD63 cells labeled with green fluorescence
2.4 制备外泌体的鉴定 使用透射电镜观察制备的外泌体,如图6 所示。在透射电子显微镜下观察到呈典型茶托状的外泌体,直径大多为40~160 nm。荧光蛋白标记不能改变外泌体的形状。增加超滤管处理步骤后,电镜照片背景中蛋白杂质较少看见。

图6 制备荧光标记外泌体的电子显微镜观察Fig.6 Electron microscope observation of preparation of fluorescently labeled exosomes
2.5 不同细胞株摄取外泌体分析 不同受体细胞摄取胃癌细胞来源外泌体的能力存在差异,如图7。HEK293T 细胞摄取CD63 标记外泌体比例为(0.038 0±0.005 6)% ;CACO-2 细胞为(0.260±0.021)%;GES-1 细胞为(0.260±0.028)%;A549 细胞为(1.10±0.11)%;THP-1 细胞为(5.76±0.66)%。CACO-2 细胞空白组与实验组组间差异无统计学意义(P>0.05),其余各细胞株空白对照组与其实验组组间差异有统计学意义(P<0.05),提示CACO-2 细胞株不摄取MGC-803 细胞的外泌体。人单核细胞THP-1 携带绿色荧光的细胞百分比最高[(5.76±0.66)%],提示外泌体更易被THP-1细胞摄取。

图7 不同组织来源细胞摄取胃癌细胞外泌体的分析Fig.7 Analysis of exosomes uptake by gastric cancer cells from different tissue sources
3 讨论
本研究以胃癌细胞MGC803来源的外泌体为研究对象,分析各种组织来源细胞对其的摄取情况。CD63 分子是外泌体上含量最多的标记分子。为追踪外泌体在细胞之间的传递,使用荧光蛋白对CD63分子进行了标记,从而进一步对外泌体进行标记。比较了CD63 分子不同标记方法对荧光强度的影响。荧光蛋白融合在CD63 分子的羧基端会产生最强的荧光信号。标记外泌体与细胞共孵育后的流式细胞术分析结果显示,不同组织来源的细胞株摄取外泌体存在差异。结肠腺癌细胞(CACO-2)不摄取MGC803 细胞来源外泌体,人胚肾细胞(HEK293T)、肺癌细胞(A549)、人胃黏膜细胞(GES-1)和单核细胞系样细胞(THP-1)可以摄取MGC803 细胞来源的外泌体,但不同组织细胞摄取外泌体的比例存在较大差异,THP-1 细胞摄取外泌体的比例最大。提示MGC803 细胞来源外泌体更容易与免疫细胞结合。在摄取外泌体的4 种细胞株中,HEK293T 细胞、A549 细胞、GES-1 细胞分别来源于肾组织、肺组织及胃组织,均不具有分化能力。THP-1 是单核细胞系样细胞,是具有分化潜能的细胞,可以被细胞因子诱导分化成巨噬细胞和树突状细胞。细胞的分化能力是否会影响外泌体的摄取,或者外泌体是否更倾向于被幼稚细胞摄取,还需要进一步去证明。胃癌组织来源的外泌体更容易进入到单核细胞样的THP-1 细胞系,也提示胃癌细胞对免疫系统的影响大于对其他组织细胞的影响,与之前的报道结果一致[8]。
本研究比较了两种CD63 标记方法的差异,并确定了最优的标记方式。同时,使用示踪技术证明了胃癌细胞来源外泌体对各种免疫细胞的影响。

