基于Aβ病理学特征探讨固本健脑液对APP/PS1睡眠障碍小鼠的作用①
毛剑琴 袁德培 张誉丹 曾楚华(湖北中医药大学,武汉 430000)
阿尔茨海默病(Alzheimer´s disease,AD)俗称老年痴呆症,其发病症状呈持续性脑部神经系统衰退,患者逐步出现认知功能障碍、记忆功能障碍及行为功能障碍,属于痴呆症的一种,统计显示,AD患者人数占全球痴呆症患者人数的50%~75%,且发病人数持续增长[1-2]。AD 发病隐匿、不可逆,目前临床缺乏有效的治疗方法,因此寻找具有防治AD 效果的药物十分必要。AD 发病机制复杂,一方面已知其发病与遗传有关,另一方面睡眠障碍可能是导致AD 的原因之一。研究发现,不同程度的昼夜节律紊乱多发生于AD 患者或动物,国外学者也指出AD 病情发展进程与睡眠障碍相关,推测睡眠障碍可能是导致AD的重要病因[3-6]。中医将AD归于“痴呆”“善忘”一类,主治以“固本健脑”为原则[7-8]。固本健脑液是代表方剂,具有补肾健脾、健脑安神功效,能够通过多靶点保护AD 小鼠神经元不受损伤[9]。本实验以APP/PS1 双转基因痴呆小鼠为研究对象,观察固本健脑液对其睡眠障碍的干预效果,并分析可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 30 只雄性SPF 级6 月龄APP/PS1 小鼠及10 只雄性SPF 级6 月龄正常小鼠均由南京生物医药研究院提供,生产许可证号:SCXK(苏)2015-0001,小鼠适应性喂养1周,APP/PS1小鼠随机分为模型组及实验组(固本健脑液低、高剂量组)。本研究经湖北中医药大学伦理学委员会批准(HUCMS202011010),实验操作均符合医学伦理学要求。
1.1.2 药物及试剂 固本健脑液方剂为15 g 板桥党参、15 g枸杞、15 g茯苓、12 g酸枣仁、12 g山楂,加入药材6 倍量冷水浸泡30 min 后武火煎煮30 min,转文火煎煮30 min,滤出药液(该过程重复2 次)。将2 次滤出的药液混匀,高温加热浓缩制成0.625、2.5 g/ml 药液,低温保存备用[10]。HE 染液(货号:G1120,北京索莱宝科技有限公司);尼氏染液(货号:E607316-0100,上海生工生物工程股份有限公司);TNF-α、IL-1β、β 样淀粉蛋白1-42(Aβ1-42,货号:AD20104、AD20079、AD21893)ELISA 试剂盒(武汉艾迪抗生物科技有限公司)。
1.1.3 实验仪器 GS-15R 型离心机(美国Beckman 公司);BIOBASE-EL10A 型酶标仪(山东博科再生医学有限公司);CX23 型生物显微镜(日本Olympus 公司);CytoFLEX 流式细胞仪(美国Beckman Coulter公司)。
1.2 方法
1.2.1 建模及给药 采用多平台水环境法建立小鼠模型,用自制睡眠剥夺箱对除对照组外的其他组进行睡眠剥夺,剥夺时间为每天12 h,连续剥夺4 周[11]。模型组及实验组(固本健脑液低、高剂量组)均为APP/PS1 双转基因小鼠,对照组为正常小鼠。实验组(固本健脑液低、高剂量组)分别灌胃0.625、2.5 g/ml 固本健脑液,剂量为10 ml/(kg·d),对照组及模型组灌胃等量生理盐水。
1.2.2 小鼠行为学检测 采用Morris 水迷宫检测小鼠行为,使用虚线将水迷宫水池分为4 个象限,第三象限内放置1 个有机玻璃平台,加水至水面超过平台2 cm,滴加牛奶将水池染白。提起小鼠尾部将其面朝4 个象限固定位置的池壁放入水池,记录其找到平台所用时间(即逃避潜伏期),时间越短表示小鼠学习记忆能力越强(实验前持续训练小鼠5 d,第6天开始实验)。
1.2.3 小鼠昼夜节律检测 观察小鼠自主活动时间,将小鼠置于12 h/12 h 光暗循环条件下培养(光照时间为早8:00 至晚8:00,黑暗时间为晚8:00 到第2 天早8:00),每3 h 记录1 次小鼠自由活动时间(记录时间为3 min),记录各组小鼠光照活动时间、黑暗活动时间及总自由活动时间。
1.2.4 小鼠血清TNF-α、IL-1β 水平检测 取小鼠尾静脉血5 ml,3 000 r/min 离心10 min,取上清,采用ELISA 试剂盒检测小鼠血清炎症因子TNF-α、IL-1β水平。
1.2.5 小鼠海马组织Aβ1-42水平检测 处死小鼠,取出完整脑组织,分离得到海马组织,使用PBS缓冲液制成海马组织混悬液,4 ℃、3 000 r/min离心10 min,取上清,采用ELISA 试剂盒检测小鼠海马组织Aβ1-42水平。
1.2.6 小鼠海马组织细胞凋亡水平检测 取部分海马组织加入胰蛋白酶消化,反复吹打制成单层细胞悬液,3 000 r/min离心10 min,弃上清,PBS缓冲液清洗2 次,Annexin X 染色,流式细胞仪、flowcytometry软件检测分析。
1.2.7 小鼠海马组织病理学特征检测 取小鼠脑部海马组织,4%多聚甲醛固定,脱水后石蜡包埋,切5 µm片,脱蜡,HE、Nissl染色观察病理学情况。
1.3 统计学处理 使用SPSS20.0软件进行统计学分析,符合正态分布的计量资料以xˉ±s 表示,单因素方差分析用于多组间比较,LSD 分析用于组间两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠逃避潜伏期时间比较 相较于对照组,模型组小鼠逃避潜伏期时间明显延长(P<0.05);相较于模型组,固本健脑液各剂量组小鼠逃避潜伏期时间均不同程度缩短(P<0.05,表1)。
表1 各组小鼠逃避潜伏期时间比较(,n=10)Tab.1 Comparison of latency time of escape of mice in each group(,n=10)
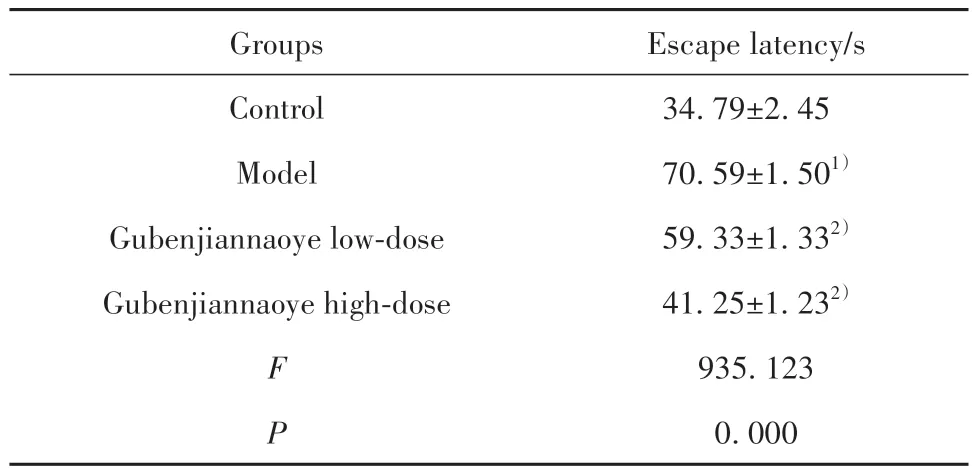
表1 各组小鼠逃避潜伏期时间比较(,n=10)Tab.1 Comparison of latency time of escape of mice in each group(,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.2 各组小鼠自由活动时间比较 相较于对照组,模型组小鼠光照活动时间、黑暗活动时间及总活动时间均明显延长(P<0.05);相较于模型组,固本健脑液各剂量组小鼠光照活动时间、黑暗活动时间及总活动时间均不同程度缩短(P<0.05,表2)。
表2 各组小鼠自由活动时间比较(,n=10)Tab.2 Comparison of free movement time of mice in each group(,n=10)

表2 各组小鼠自由活动时间比较(,n=10)Tab.2 Comparison of free movement time of mice in each group(,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.3 各组小鼠血清TNF-α、IL-1β 水平比较 相较于对照组,模型组小鼠血清TNF-α、IL-1β 水平均明显升高(P<0.05);相较于模型组,固本健脑液各剂量组小鼠血清TNF-α、IL-1β 水平均不同程度降低(P<0.05,表3)。
表3 各组小鼠海马组织TNF-α、IL-1β 水平比较(,n=10,pg/L)Tab.3 Comparison of TNF-α and IL-1β levels in hippocampal tissues of mice in each group(,n=10,pg/L)
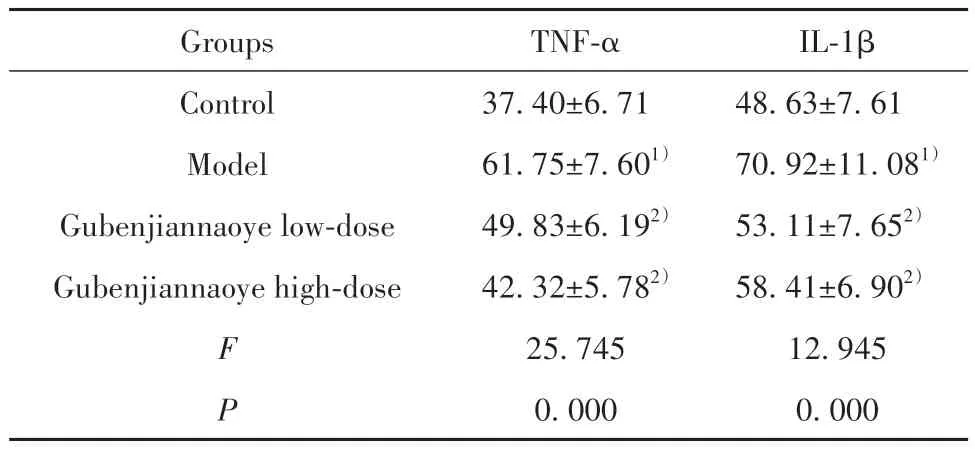
表3 各组小鼠海马组织TNF-α、IL-1β 水平比较(,n=10,pg/L)Tab.3 Comparison of TNF-α and IL-1β levels in hippocampal tissues of mice in each group(,n=10,pg/L)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.4 各组小鼠海马组织Aβ1-42水平比较 相较于对照组,模型组小鼠海马组织Aβ1-42水平明显升高(P<0.05);相较于模型组,固本健脑液各剂量组小鼠海马组织Aβ1-42水平均不同程度降低(P<0.05,表4)。
表4 各组小鼠海马组织Aβ1-42水平比较(,n=10)Tab.4 Comparison of Aβ1-42 level in hippocampal tissues of mice in each group(,n=10)
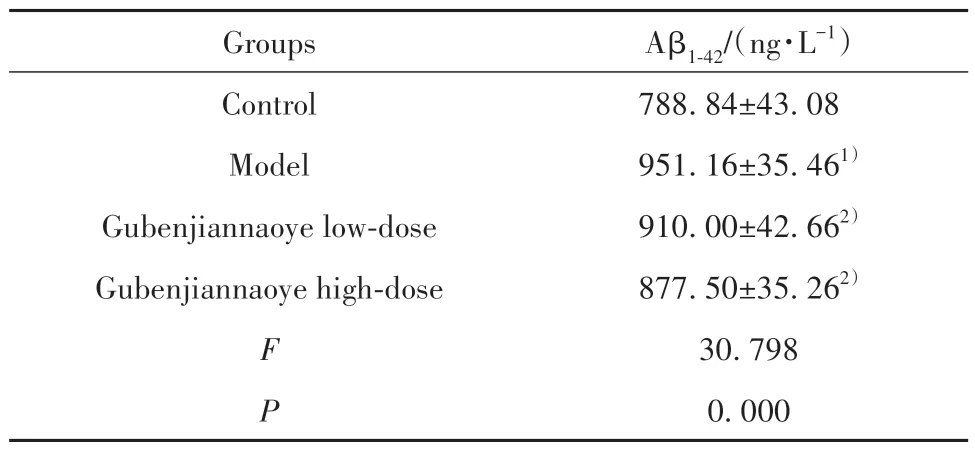
表4 各组小鼠海马组织Aβ1-42水平比较(,n=10)Tab.4 Comparison of Aβ1-42 level in hippocampal tissues of mice in each group(,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.5 各组小鼠海马组织细胞凋亡率比较 相较于对照组,模型组小鼠海马组织细胞凋亡率明显升高(P<0.05);相较于模型组,固本健脑液各剂量组小鼠海马组织细胞凋亡率均出现不同程度降低(P<0.05,表5、图1)。
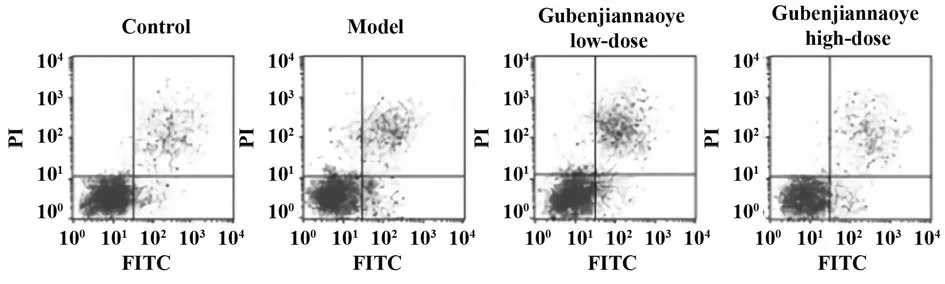
图1 各组小鼠海马组织细胞凋亡率比较Fig.1 Comparison of apoptosis rate in hippocampal tissues of mice in each group
表5 各组小鼠海马组织细胞凋亡率比较(,n=10)Tab.5 Comparison of apoptosis rate in hippocampal tissues of mice in each group(,n=10)
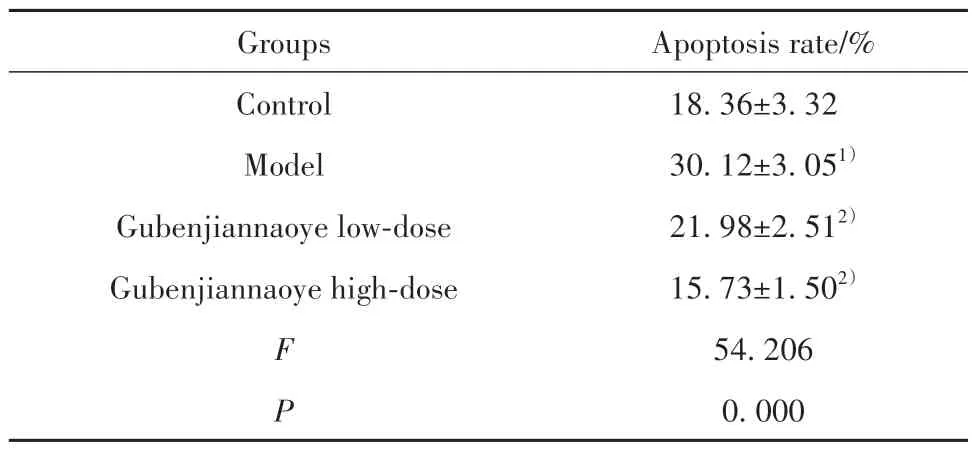
表5 各组小鼠海马组织细胞凋亡率比较(,n=10)Tab.5 Comparison of apoptosis rate in hippocampal tissues of mice in each group(,n=10)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.6 各组小鼠海马组织病理学特征比较 对照组小鼠海马组织神经细胞排列整齐,形状完整且数量较多,细胞内尼氏体数量密集丰富;模型组小鼠海马组织神经细胞排列混乱,细胞体积皱缩且数量减少,细胞内尼氏体数量减少;相较于模型组,固本健脑液各剂量组小鼠海马组织神经细胞及尼氏小体均明显改善(图2)。
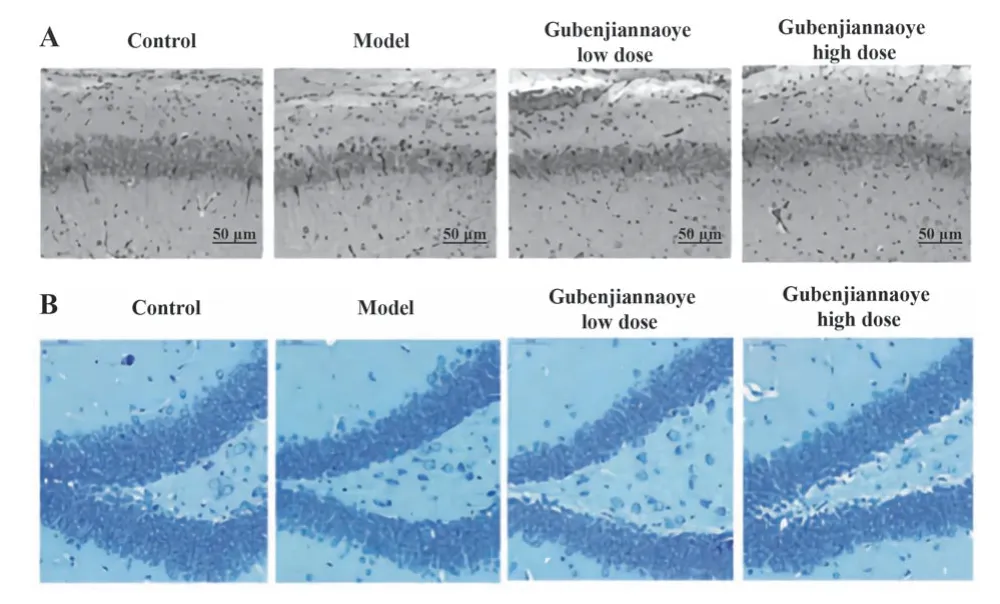
图2 各组小鼠海马组织病理学特征比较(×400)Fig.2 Comparison of histopathological characteristics of hippocampus in each group of mice(×400)
3 讨论
随着社会老龄人口不断增加,AD 患病率也逐渐升高,目前仍普遍认为其发病机制为脑组织Aβ异常沉积,因此临床可通过调节Aβ 沉积影响AD 发病进程[10-11]。另有研究表明,睡眠是调节学习记忆和情绪的重要脑部活动,而睡眠障碍会导致记忆功能减退、认知能力降低,从而增加患AD 的可能性,且大部分AD 患者均存在不同程度的睡眠节律紊乱[12-14]。固本健脑液是具有健脑安神功效的一种方剂,早期研究提示其汤剂能够明显改善AD 模型小鼠睡眠障碍及学习记忆能力[15]。本研究在此基础上进一步分析其作用机制。
脑组织Aβ 沉积是目前已知的AD 主要发病机制之一,研究表明通过慢性睡眠剥夺能够促进AD模型小鼠脑组织Aβ 沉积,进一步损害AD 小鼠记忆功能,推测睡眠节律紊乱可能造成脑组织内Aβ 异常沉积,促发AD[16]。AD 患者脑组织内存在大量炎症反应,脑组织炎症反应能够抑制神经元新生、加速神经元丢失,进一步加重脑组织损伤[17];AD 脑组织炎症反应主要由神经胶质细胞及星形胶质细胞在病理条件下过度激活引发[18]。以上两种细胞被脑组织内Aβ 等毒性物质过度激活促进炎症因子表达,包括TNF-α、IL-1β 等,TNF-α、IL-1β 一方面加速神经细胞凋亡,另一方面降低神经细胞增殖分化能力,两方面作用共同造成脑神经损伤[19]。
本研究表明,与正常小鼠相比,AD 模型小鼠逃避潜伏时间、光照活动时间、黑暗活动时间及总活动时间、血清TNF-α、IL-1β 水平、海马组织Aβ1-42水平及细胞凋亡率均明显升高,通过HE、Nissl 染色观察其海马组织病理情况,对照组小鼠海马组织神经细胞排列整齐,形状完整且数量较多,细胞内尼氏体数量密集丰富,而模型组小鼠海马组织神经细胞排列混乱,细胞体积皱缩且数量减少,细胞内尼氏体数量减少。提示相较于正常小鼠,AD 模型小鼠睡眠节律紊乱、学习记忆能力下降、炎症反应加剧、海马组织神经细胞凋亡增加且Aβ1-42含量增多,与既往研究结果相符。与AD 模型小鼠相比,固本健脑液灌胃给药后小鼠睡眠障碍、学习记忆能力、炎症反应、海马组织神经细胞凋亡水平及病理情况均明显改善,海马组织Aβ1-42含量比较发现实验组小鼠Aβ1-42含量明显降低,推测可能由于固本健脑液抑制了AD 脑组织Aβ1-42沉积,在一定程度对AD 小鼠发挥了治疗作用。
综上,固本健脑液对APP/PS1 睡眠障碍小鼠的神经功能具有一定保护作用,其作用机制可能与抑制AD 脑组织Aβ 沉积、进一步抑制脑组织炎症反应及神经细胞凋亡有关。固本健脑液对AD 患者的临床治疗作用未来还需进一步验证。