羟基法舒地尔对实验性自身免疫性脑脊髓炎小鼠氧化应激的影响①
褚果果 王 婧 鞠文媛 陈阳阳 李晓慧 张海飞 宋丽娟 黄建军 王 青 肖保国马存根(山西医科大学第一医院神经内科/细胞生理学教育部重点实验室,太原 030001)
多发性硬化(multiple sclerosis,MS)是一种由自身免疫功能紊乱引起多灶性和散在性轴突和神经元损伤的中枢神经系统(central nervous system,CNS)疾病,也是导致年轻人残疾的常见病之一[1]。作为一种慢性炎症性、脱髓鞘性、神经变性疾病,MS的具体病因仍不清楚,但多项研究表明,CNS内氧化应激可导致神经组织多种损伤,如炎症、髓鞘破坏和轴突变性,是导致MS 发生、进展和临床症状的重要因素。因此,近年来应用多种抗氧化剂改善MS,如辅酶Q10、褪黑素和维生素C等[2]。
实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是MS的经典动物模型。法舒地尔是最早获批主要用于改善脑血流异常的ROCK抑制剂,但其具有抗氧化作用,可明显减轻EAE 的临床症状[3-6]。然而,法舒地尔在临床实践中存在安全窗窄、半衰期短等缺点,限制了其治疗慢性疾病的长期应用。作为法舒地尔的代谢产物,羟基法舒地尔(Hydroxyfasudil,HF)也被发现对ROCK 具有选择性抑制作用,且其生物学活性更高,半衰期更长,然而目前关于HF 治疗EAE 的研究较少[7]。HF 是否可以通过抑制氧化应激发挥对EAE小鼠的治疗作用值得探讨。因此,本实验拟通过观察HF 对EAE 小鼠的治疗效果及其对氧化应激的影响,探究可能的机制。
1 材料与方法
1.1 材料
1.1.1 细胞与动物 BV2 小胶质细胞系由中国科学院上海分院细胞库提供;16只8~10 周龄清洁级健康C57BL/6 小鼠,体质量17~22 g,购于北京维通利华实验动物有限公司。适应性饲养,饲养环境:22~25 ℃,自由进食和饮水,保持12 h/12 h 明暗交替。饲养1周后开展实验。本实验已通过山西中医药大学医学伦理委员会批准。
1.1.2 主要试剂与仪器 羟基法舒地尔(美国MedChemExpress 公司);MOG35-55肽段(中国西安联美生物科技有限公司);灭活结核分枝杆菌H37Ra(mycobacterium tuberculosis,TB,美国BD公司);百日咳毒素(pertussis toxin,PTX,美国Enzo Life Sciences公司);完全弗氏佐剂(complete Freund´s adjuvant,CFA,美国Sigma 公司);MTT 细胞活力检测试剂盒、脂多糖(lipopolysaccharide,LPS)、牢固蓝(luxol fast blue,LFB)染色液、HE 染色试剂盒、DPPH、ABTS 自由基清除检测试剂盒(北京索莱宝科技有限公司);活性氧(reactive oxygen,ROS)、活性氮(reactive nitrogen species,RNS)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)ELISA 试剂盒(中国泛柯实业有限公司);核因子E2 相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)抗体(美国Cell Signaling Technology 公司);血红素加氧酶-1(heme oxygenase 1,HO-1)抗体(中国爱必信生物科技有限公司);anti-β-actin(美国Bioworld 公司)。冰冻切片机、显微镜(德国Leica公司)。
1.2 方法
1.2.1 分组及给药 BV2 细胞铺于96 孔板,贴壁后加入不同浓度的HF 孵育24 h。BV2 细胞随机分为正常对照组、LPS组和LPS+HF 组。HF(15 µg/ml)预处理2 h 后给予LPS(1 µg/ml)刺激24 h。小鼠根据体质量随机分为EAE 组和HF 组,分笼饲养,每组8 只。每只小鼠于腰背部分两点皮下注射CFA 乳化剂,由MOG35-553.2 mg 和TB 64 µg 充分混悬配制,注射剂量为100 µl/只。于免疫后当天和48 h 后腹腔注射PTX,剂量为300 ng/只。HF 组小鼠于免疫后第3 天起腹腔注射HF 干预,剂量为40 mg/(kg·d),EAE组小鼠注射等量生理盐水。
1.2.2 症状评估 从第0 天起由至少两名观察者隔天对小鼠症状进行观察并评分。5 分法评分标准:无临床症状,不发病计0分;尾部柔软,张力部分丧失计1分;后肢无力或共济失调,左右摇晃步态计2 分;双侧后肢完全瘫痪计3 分;双后肢及尾部瘫痪伴前肢力弱计4分;精神萎靡,四肢瘫痪或濒死状态计5 分。若症状介于两者之间,则记录中间分数(±0.5分)。
1.2.3 组织制备 每组取4只小鼠,生理盐水经心尖处灌注后,固定,然后迅速剥离脊髓组织,10%、20%、30%蔗糖溶液梯度脱水,将腰膨大段用OCT胶包埋,冰冻切片机切片,用于染色。每组剩余小鼠剥离的脊髓组织匀浆提取蛋白用于Western blot检测。
1.2.4 MTT 检测细胞活力 每孔加入10 µl MTT溶液,继续培养4 h,弃去上清液加入100 µl DMSO,振荡10 min后于490 nm处测量吸光度(OD)值。
1.2.5 DPPH、ABTS自由基清除实验
1.2.5.1 DPPH 实验 将空白提取液、阳性标准品溶液和不同浓度的HF 溶液各10 µl 加入190 µl DPPH 工作液中,避光室温静置30 min,于515 nm 处检测OD值。清除率(%)=(A空白-A测定)/A空白×100%。
1.2.5.2 ABTS实验 空白组:将24 µl蒸馏水加至180 µl ABTS 混合液中,测定组和阳性对照组(positive contral,PC):将阳性标准品溶液和不同浓度的HF 溶液各6 µl 加至180 µl ABTS 混合液和18 µl 蒸馏水中反应10 min,于593 nm 处测定OD 值。清除率(%)=(A空白-A测定)/A空白×100%。
1.2.6 HE染色 脊髓切片复温,苏木素染色10 min,快速冲洗2 次,每次2 min,水洗后分化15 s,自来水冲洗,伊红染色1.5 min,蒸馏水清洗5 min,快速脱水,透明,封片,观察。
1.2.7 LFB 染色 脊髓冰冻切片复温,60 ℃浸泡于LFB 染液中20 h,95%乙醇浸泡10 min 去除多余染液,分化液分化15 s,70%乙醇分色30 s,至灰白质清晰,蒸馏水冲洗,脱水,透明,封片,观察。
1.2.8 氧化抗氧化指标ROS、RNS、MDA、SOD、CAT 和GSH-Px 的检测 将BV2 细胞上清液和小鼠脊髓匀浆于5 000 r/min 离心10 min。取包被好的96 孔板,每个样品设置3 个复孔,分别将10 µl 上清液或小鼠脊髓匀浆加入孔中,然后每孔中再加入40 µl样品稀释液和100 µl酶标二抗溶液,37 ℃静置1 h,清洗3~5 次后,每孔各加入50 µl A、B 显色液,避光静置10 min,每孔加入50 µl 终止液,即刻使用酶标仪于450 nm处检测各孔OD值。
1.2.9 免疫荧光染色 脊髓切片恢复至室温,PBS中浸泡除去OCT 胶,1%BSA 封闭30 min 后,分别加Nrf2(1∶300)和HO-1(1∶200)抗体稀释液,4 ℃孵育过夜,洗去一抗,加入二抗稀释液孵育2 h,洗去抗体,封片,观察。
1.2.10 Western blot 检测 取各组小鼠脊髓蛋白样品,100 ℃加热10 min。每条泳道加入30 µg 蛋白,于10%聚丙烯酰胺凝胶上恒压(120 V)电泳分离蛋白,然后湿转至PVDF 膜。将膜浸泡于5%脱脂牛奶中1 h,TBST 洗涤3~5 次后,加入Nrf2 一抗(1∶1 000)、HO-1 一抗及内参β-actin 一抗(1∶5 000),4 ℃孵育过夜,次日经TBST 充分洗涤后,加入HRP标记的二抗(1∶5 000)室温静置2 h,TBST 洗涤3~5 次,每次5 min。化学发光法显影曝光,观察拍照,以Nrf2、HO-1条带灰度值与内参β-actin灰度值的比值表示蛋白相对表达量。
1.3 统计学分析 计量数据的统计分析采用GraphPad Prism8.0 进行,各项实验指标均以表示。多组均数间比较采用单因素方差分析,两组均数采用t检验进行比较。当P<0.05时认为差异有统计意义。
2 结果
2.1 HF 在体外对自由基的清除作用 与PC 组[(95.33±2.52)%、(95.00±2.00)%]相比,HF 在体外对DPPH 和ABTS自由基几乎没有清除作用,且在3.75~60 µg/ml 的浓度范围内自由基清除率无明显差异。见图1。
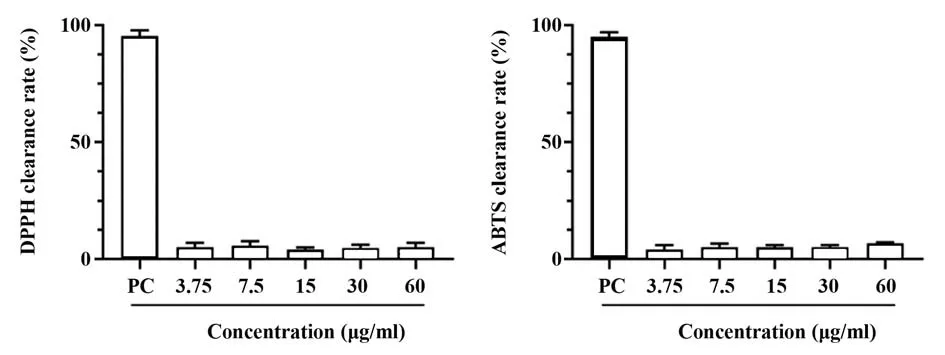
图1 不同浓度HF对自由基的清除作用Fig.1 Scavenging effect of different concentrations of HF on free radicals
2.2 HF 对BV2 细胞活力的影响 当HF 在低浓度范围内(3.75、7.5、15 µg/ml),细胞活力与对照组(0 µg/ml)间差异无统计学意义,不同浓度组间细胞活力差异也无统计学意义。当HF 浓度达到较高浓度(30、60 µg/ml)时,细胞活力显著下降(P<0.05)。根据MTT 结果,后续的体外细胞实验采用对细胞活力没有影响的15 µg/ml HF。见图2。
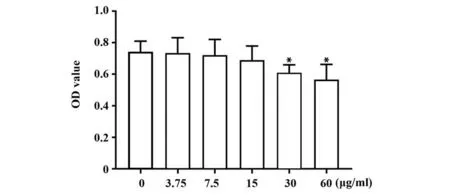
图2 不同浓度HF对BV2细胞活性的影响Fig.2 Effects of different concentrations of HF on viability of BV2 cells
2.3 HF对BV2细胞氧化应激的影响 与LPS组相比,经HF 干预后BV2 小胶质细胞中氧化产物ROS、RNS 和MDA 产生均减少(P<0.05),抗氧化酶SOD和GSH-Px 含量显著增加(P<0.05),而CAT 含量在两组间差异无统计学意义(P>0.05)。见图3。
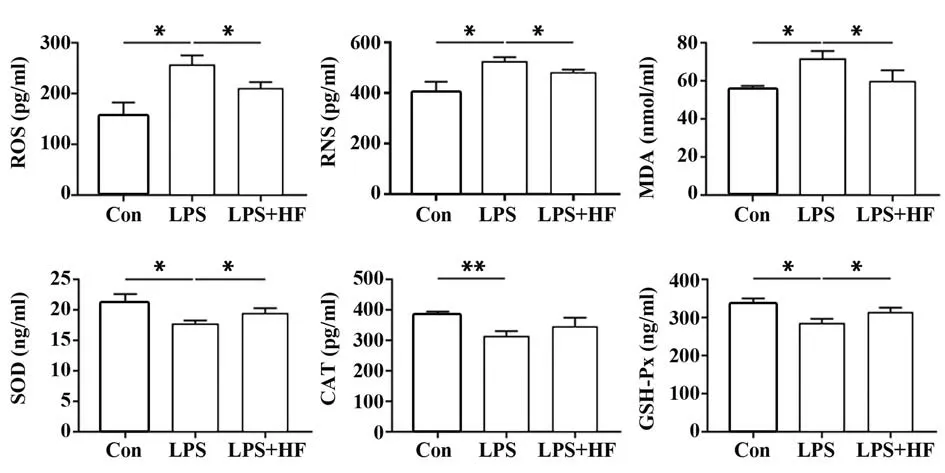
图3 HF对BV2细胞氧化应激的影响Fig.3 Effects of HF on oxidative stress in BV2 cells
2.4 HF 抑制EAE 小鼠的临床症状 自免疫后第11 天开始,EAE 组小鼠尾部远端张力减弱,出现下垂,且随免疫时间延长逐渐加重,平均发病时间为免疫后(16.34±4.98)d,临床评分的平均最高分值为(3.84±1.09)。HF 组小鼠并未出现任何临床症状,EAE 组小鼠临床评分持续上升。免疫后第16~28天,EAE组小鼠症状普遍较为严重,临床评分与HF 组相比开始出现统计学差异(P<0.05)。见图4。
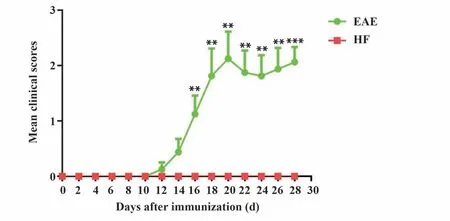
图4 EAE组和HF组小鼠临床评分变化Fig.4 Differences in clinical scores between EAE group and HF group mice
2.5 HF抑制脊髓炎症、改善髓鞘脱失 HE染色结果表明,EAE 组小鼠脊髓白质内有大量炎症细胞浸润,HF 组炎症细胞浸润明显减少(P<0.05)。根据LFB 对髓鞘染色的结果分析,EAE 组小鼠脊髓白质内可见大量未着色的空泡,说明白质内髓鞘脱失严重,而HF 组脊髓白质染色均一致密,未见明显脱失(P<0.05),与临床评分表现一致。见图5。
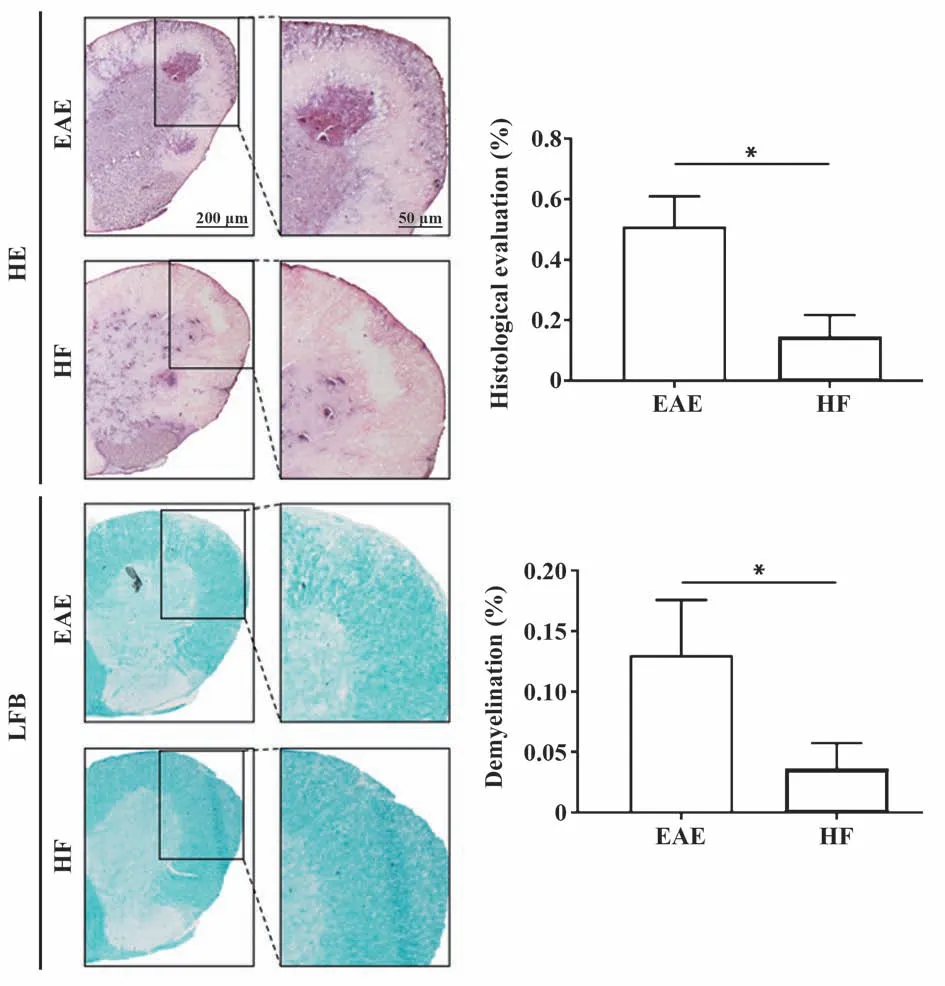
图5 HF 对EAE 小鼠脊髓内炎症细胞浸润和髓鞘脱失的影响Fig.5 Effects of HF on infiltration of inflammatory cells and demyelination in spinal cord of EAE mice
2.6 HF 对EAE 小鼠氧化应激的影响 与体外细胞实验结果基本一致,与EAE 组相比,HF 显著减少脊髓匀浆中氧化产物ROS、RNS 及MDA 含量(P<0.05),提高抗氧化酶SOD、CAT 和GSH-Px 含量,差异有统计学意义(P<0.05)。见图6。

图6 HF对EAE小鼠氧化应激的影响Fig.6 Effects of HF on oxidative stress in EAE mice
2.7 HF 激活Nrf2/HO-1抗氧化通路 Nrf2/HO-1是体内一条重要的抗氧化通路,为验证HF 的抗氧化作用是否与Nrf2/HO-1 通路有关,采用免疫荧光染色和Western blot 检测两组小鼠脊髓内Nrf2 和HO-1的表达情况。结果显示,与EAE 组相比,HF 组小鼠脊髓内Nrf2 和HO-1 蛋白表达明显增加,差异有统计学意义(P<0.05)。提示HF 可能通过激活Nrf2/HO-1信号通路发挥抗氧化作用。见图7。

图7 HF激活了Nrf2/HO-1抗氧化通路Fig.7 HF activated Nrf2/HO-1 antioxidant pathway
3 讨论
由于CNS 巨大的耗氧量及少突胶质细胞的高脂质含量使其容易受到氧化应激的攻击。在生理条件下,ROS 和RNS 作为信号传导过程的调节介质发挥重要作用,而SOD、CAT 和GSH-Px 等酶构成了酶抗氧化剂系统,反馈性地抑制氧化产物的过多产生,维持氧化还原稳态[8-9]。ROS 和RNS 的过多产生、线粒体功能障碍、抗氧化防御系统功能不佳均在MS 的病理中发挥关键作用[10]。事实上,氧化应激会对所有类型的胶质细胞产生损伤,但由于少突胶质细胞本身缺乏抗氧化防御能力,少突胶质细胞和神经元更为敏感,因此氧化应激在MS 患者大脑中诱导线粒体损伤和能量障碍,从而导致髓鞘脱失和神经变性。神经炎症和氧化应激密切相关,而在炎症环境下,ROS 和RNS 水平急剧升高,导致细胞死亡[11]。研究发现在MS 患者脑内活动脱髓鞘区域,大量蛋白质、脂质和核苷酸受到广泛的氧化损伤,受损的少突胶质细胞显示高水平的氧化DNA,而氧化磷脂优先在运输紊乱的轴突中积累[12]。有研究表明,ROCK 的激活能够促进自由基过度产生,提高氧化应激水平,其还可由氧化应激状态引起,加强恶性循环,最终导致神经元死亡[13-15]。在对EAE 小鼠CNS 氧化应激与神经元损伤之间的时空相关性研究中发现,激活的小胶质细胞是EAE 小鼠CNS内氧化损伤的主要来源之一[16]。因此在本实验中采用LPS 刺激的BV2 细胞进行ROCK 抑制剂HF在体外抗氧化能力的研究。结果表明HF 可明显减少氧化产物ROS、RNS 及MDA 产生,促进抗氧化酶SOD、CAT 和GSH-Px 表达,表现出良好的抗氧化能力,并且该结果在EAE小鼠中也得到验证。
Nrf2 是一种重要的抗氧化防御的调节因子,在受到氧化刺激时,其可由胞质转入核内,激活一种被称为抗氧化反应元件的基因表达,通过调节多种抗氧化蛋白、解毒酶和外源性转运蛋白的基础和诱导表达,消除过多的氧化产物,在维持细胞稳态中发挥重要作用[17]。Nrf2的另一个重要功能是通过抑制NF-κB 激活降低炎症反应,从而减少细胞因子的产生和氧化反应[18]。法舒地尔作为ROCK抑制剂可导致APP/PS1 转基因痴呆模型小鼠海马神经元中Nrf2 和抗氧化分子上调,因此可能是通过激活Nrf2信号通路,促进大脑抗凋亡能力,从而发挥神经保护作用[4]。有研究发现,法舒地尔静脉给药后,可以立刻在血液中检测到HF,血浆中HF 的浓度最高值约为母物的80%[19]。因此,HF可能是法舒地尔的重要活性成分。本实验在明确HF 抗氧化作用的基础上,进一步探索了其作用机制,发现HF 也可促进EAE 小鼠脊髓中Nrf2和HO-1蛋白表达。HF对Nrf2信号通路的激活表明其有潜力成为治疗MS 优良的抗氧化剂。
综上所述,HF 在体外对DPPH 和ABST 自由基无直接清除作用,在体内则改善EAE 小鼠的临床症状,减轻CNS 炎症细胞浸润和髓鞘脱失,表现出良好的治疗效果,其机制可能与激活Nrf2/HO-1 信号通路,抑制氧化应激有关。基于文献报道的其优良的药物代谢动力学特征,使HF 在临床治疗上具有良好的应用前景。